靶向T细胞共信号的肿瘤免疫治疗研究进展
2015-11-24支旺旺孙超王淑珍
支旺旺,孙超,王淑珍
(中国药科大学生命科学与技术学院,江苏 南京 210009)
靶向T细胞共信号的肿瘤免疫治疗研究进展
支旺旺,孙超,王淑珍*
(中国药科大学生命科学与技术学院,江苏 南京 210009)
T细胞介导的肿瘤免疫至少需要T细胞受体和共刺激分子“双信号”参与的学说目前得到了广泛支持。共抑制或共刺激分子提供的共信号决定了T细胞受体信号介导的免疫应答的最终效应。近年来,靶向共抑制分子如CTLA-4和PD-1开发的抗体药物在临床应用中获得了巨大成功,使得肿瘤免疫治疗成为最令人瞩目的研究领域,并被美国《科学》杂志评为2013年度十大科学突破之首。肿瘤免疫治疗有望成为与手术、放化疗和靶向治疗并驾齐驱的抗肿瘤主流治疗方案。针对共抑制分子CTLA-4、PD-1、PD-L1和共刺激分子CD137,综述其发挥免疫调节作用的分子机制及其相关靶向药物在肿瘤治疗方面的最新进展和应用。
肿瘤免疫治疗;T细胞共信号;共抑制;共刺激;拮抗剂;激动剂
随着分子免疫学的发展和研究的深入,人们对于免疫系统的复杂调控机制的认识取得了长足进步,为有效肿瘤免疫治疗策略的开发提供了理论基础。能否充分调动机体免疫系统的功能(尤其是T细胞的功能)是决定肿瘤免疫治疗效果的关键。目前,T细胞激活至少需要T细胞受体(T cell receptor,TCR)和共刺激分子参与的“双信号”学说得到了广泛支持[1]。第一信号由TCR识别抗原呈递细胞(antigen-presenting cell,APC)表面的抗原肽-MHC复合物(p-MHC)提供,第二信号则由T细胞和APC表面的共刺激分子间的相互作用提供。只有在两个信号都存在时,T细胞才能有效激活。此外,T细胞激活还受到共抑制分子(即免疫检查点)的负向调控。正常生理状态下,共抑制分子在维持免疫稳态和耐受过程中发挥重要作用,但在肿瘤发生时,则会抑制适应性免疫应答,参与肿瘤的免疫逃逸[1-2]。因此,存在于T细胞表面的众多共抑制或共刺激分子提供的共信号决定了TCR信号介导的免疫应答的最终效应(见图1)。
鉴于共抑制分子拮抗剂和共刺激分子激动剂均是有效增强抗原特异性T细胞反应的有效策略,围绕共信号分子已相继开展多项临床试验,结果显示相关药物也确实发挥了抗肿瘤免疫反应的巨大潜力[1-3]。例如,针对细胞毒T淋巴细胞抗原4(cytotoxic T lymphocyte antigen-4,CTLA-4)和程序性死亡蛋白1(programmed cell death protein-1,PD-1)及其配体(programmed cell death-1 ligand-1,PD-L1)开发的抗体药物在临床应用上均获得了巨大成功,这重新激起了人们对肿瘤免疫治疗的信心,并迅速成为世界各国的热门研究领域[2-6]。鉴于肿瘤免疫治疗取得的突破性进展,美国《科学》杂志将其评为“2013年度十大科学突破”之首,预测其有望成为与手术、放化疗和靶向治疗并驾齐驱的抗肿瘤主流治疗方案[7]。本文将针对共抑制分子CTLA-4、PD-1、PD-L1和共刺激分子CD137,综述其发挥免疫调节作用的分子机制及其相关靶向性药物(见表1)在肿瘤治疗方面的最新进展和应用。
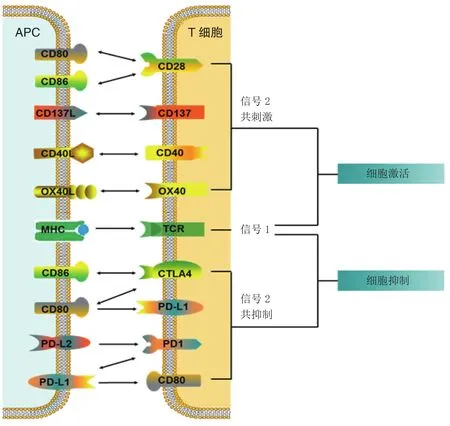
图1 T细胞激活或抑制的共受体信号示意图Figure 1 Schematic representation of the co-receptor signalling for T cell activation or inhibition
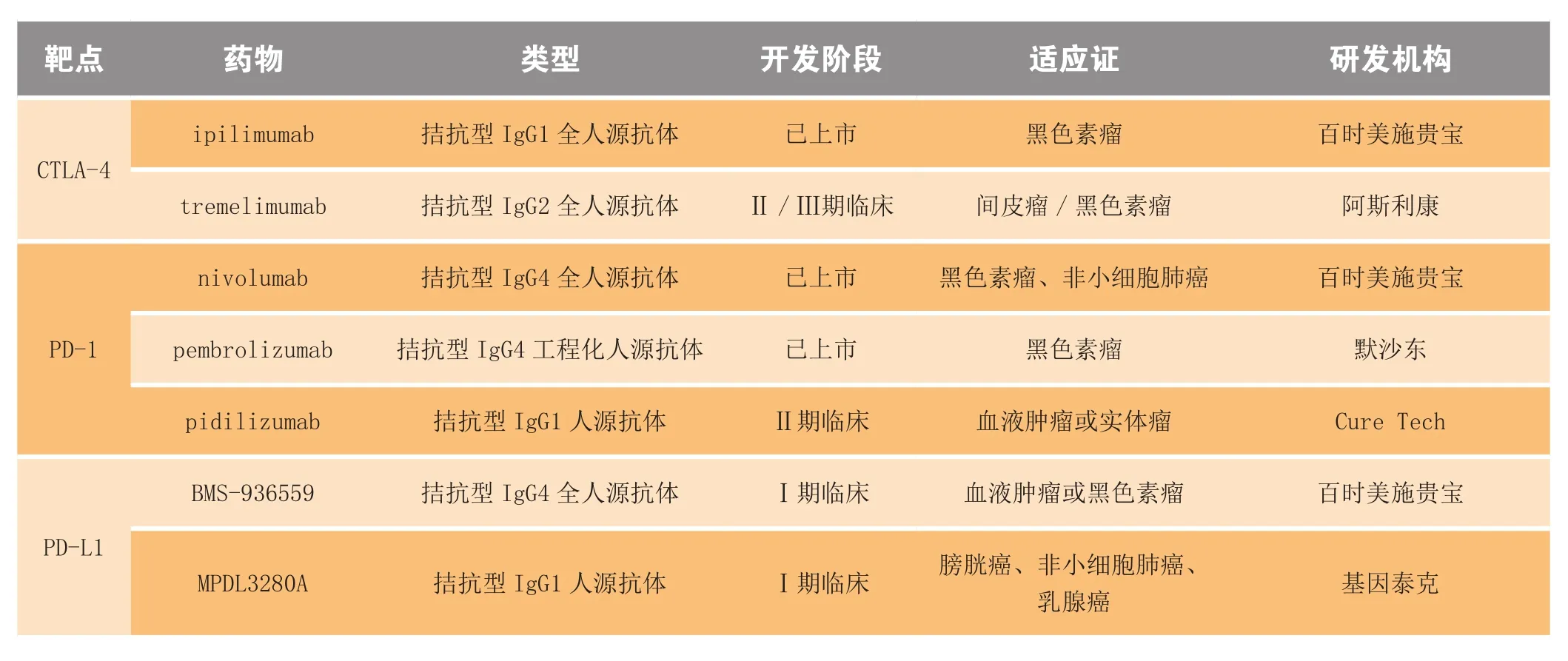
表1 部分已上市或在研共抑制分子拮抗剂和共刺激分子激动剂Table 1 Selected co-inhibitory antagonists and co-stimulatory agonists launched or in clinical trials
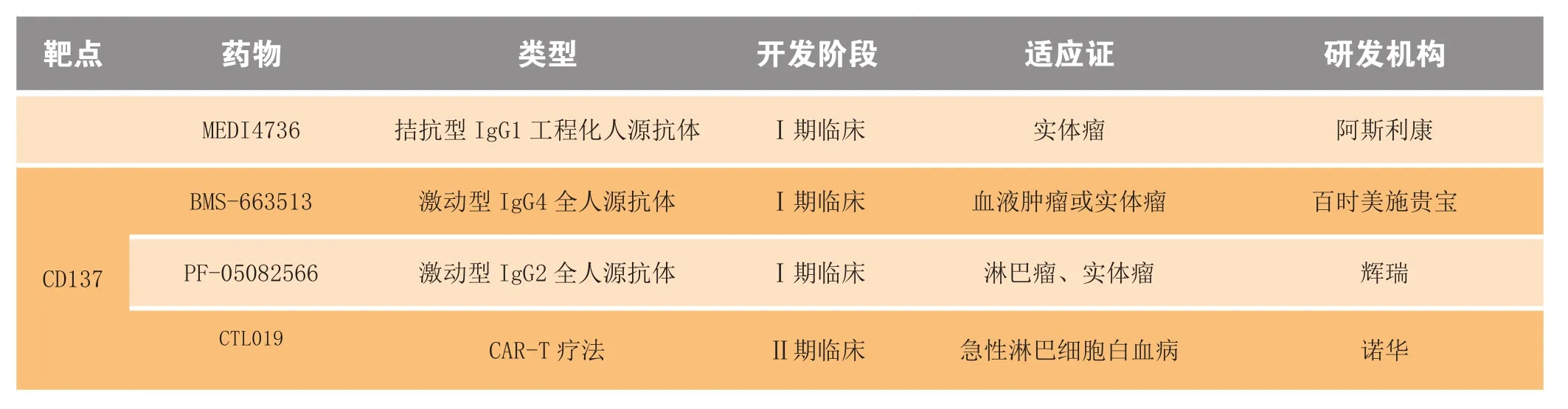
续表1
1 共抑制分子CTLA-4及其拮抗剂
1.1 CTLA-4参与免疫调节的分子机制
CTLA-4(又名CD152)是主要表达于激活的T细胞表面的一种共抑制分子,与T细胞表面组成型表达的T细胞激活活性最强的共刺激分子CD28具有30%的同源性,二者与相同的配体(CD80或CD86)结合[8]。CTLA-4在静息T细胞表面不表达,T细胞一旦激活后,ctla-4基因开始表达并被转运和聚集在免疫突触上,通过竞争性结合CD80或CD86阻断CD28介导的共刺激信号,并激活磷酸酶SHP2和PP2A,使TCR下游信号去磷酸化,抑制T细胞活化[9]。此外,CTLA-4也可组成型表达于调节性T细胞(Regulatory T cells,Treg)的表面,与配体结合后诱导APC表达吲哚酸2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO),增强Treg的功能,直接抑制效应T细胞反应[1]。
1.2 CTLA-4拮抗剂在肿瘤治疗中的应用
CTLA-4是临床上开发的首个共抑制分子靶点,目前已有2个拮抗型全人源单克隆抗体进入临床阶段,即ipilimumab和tremelimumab。针对黑色素瘤患者开展的两项大规模Ⅲ期临床试验结果显示,ipilimumab均可有效延长患者的总生存期[10-11]。第一项临床试验评价了ipilimumab和肽疫苗gp100对以往治疗过的不可切除Ⅲ期和Ⅳ期黑色素瘤患者总生存期的影响,结果表明,ipilimumab治疗组患者的中位总生存期为10.1个月,而gp100治疗组为6.4个月[10]。第二项临床试验对象为既往未接受过治疗的黑色素瘤患者,结果表明,ipilimumab和黑色素瘤常用化疗药物氮烯唑胺联合治疗组患者的中位总生存期为11.2个月,而氮烯唑胺和安慰剂联合治疗组为9.1个月[11]。最重要的是,ipilimumab诱发的抗肿瘤免疫反应可持续时间很长,有20%的患者生存满4年,有些患者甚至已生存达10年或以上[12]。这些研究促使ipilimumab于2011年获美国FDA批准上市,用于治疗不可切除或转移性恶性黑色素瘤。
与ipilimumab相似,tremelimumab的Ⅰ期和Ⅱ期临床试验均证明了其抗黑色素瘤效果的有效性[13-14]。但是,针对既往未接受过治疗的黑色素瘤患者开展的Ⅲ期临床试验数据显示,tremelimumab治疗组患者的总生存期和氮烯唑胺治疗组并没有显著差异[15]。分析造成该试验失败的原因可能与给药周期过长以及最初的化疗组患者接受过ipilimumab交叉治疗有关[4]。除了黑色素瘤,tremelimumab在作为单药治疗恶性间皮瘤的Ⅱ期临床试验中也表现出了较好的临床有效性和安全性,在2015年4月被FDA授予治疗恶性间皮瘤的孤儿药资格[16-17]。目前,有多项临床试验正在进行,旨在考察tremelimumab联合其他抗肿瘤药物治疗多种实体瘤的临床潜力[18-19]。
2 共抑制分子PD-1与配体PD-L1及其拮抗剂
2.1 PD-1及其配体参与免疫调节的分子机制
PD-1(又名CD279)是一种属于免疫球蛋白家族的Ⅰ型跨膜受体,主要表达于激活的T细胞表面,可与两个配体结合,即PD-L1(又名B7-H1)和PD-L2(又名B7-DC)。PD-L1在多种正常组织和肿瘤细胞中均有表达,而PD-L2则主要表达于APC上[4,8]。虽然PD-1和CTLA-4都是共抑制分子,但二者发挥的功能并不冗余。PD-1与其配体结合不会影响共刺激信号,而是通过招募磷酸酶SHP2,减弱TCR信号,降低T细胞功能[8]。因此,PD-1不会影响T细胞或记忆T细胞的早期激活,而是调控活化T细胞的免疫应答,最终抑制T细胞免疫。
2.2 PD-1及其配体拮抗剂在肿瘤治疗中的应用
据悉,针对PD-1/PD-L1通路正在或已开展的相关临床试验已达数百项,已使多种肿瘤(包括黑色素瘤、肾细胞癌、非小细胞肺癌和膀胱癌等)患者获显著临床受益[5]。抗PD-1的代表性抗体主要有pembrolizumab(又名MK3475和Lambrolizumab)、nivolumab(又名MDX1106、BMS-936558和ONO-4538)和pidilizumab(又名CT-011)。一项大规模Ⅰ期临床试验结果显示,晚期黑色素瘤患者对pembrolizumab的应答率为37~38%[20],随后又有文献报道ipilimumab难治性晚期黑色素瘤患者对其总体应答率为26%[21],这使其在2014年9月获美国FDA批准上市。针对转移性黑色素瘤患者开展的另一项Ⅲ期临床试验显示,nivolumab治疗组的主观应答率和总体生存率分别为40%和72.9%,而氮烯唑胺化疗组仅为13.9%和42.1%,nivolumab治疗组患者临床受益明显[22]。Nivolumab在2014年12月获美国FDA批准上市用于治疗转移性黑色素瘤,鉴于其在肺癌临床试验中的突出表现[23],2015年3月又获扩展批准用于先前有过治疗的晚期或转移性非小细胞肺癌患者。
PD-L1作为PD-1结合的主要配体可在有些肿瘤组织中高度表达,二者结合后能抑制细胞因子释放和PD-1阳性肿瘤浸润T细胞的细胞裂解活性[2]。此外,PD-L1还可以和CD80结合,进一步抑制T细胞功能[2]。这些特征使得PD-L1也成为一种非常具有潜力的抗肿瘤靶点。目前,抗PD-L1的代表性抗体药物主要有BMS-936559(又名MDX1105)[24]、MPDL3280A[25-26]和MEDI4736[27]等,已针对多种肿瘤开展临床试验,并取得了可喜的成果。毋庸置疑,阻断PD-1/PD-L1共抑制信号已成为最令人兴奋的研究领域,并引领了肿瘤治疗迈进新时代[28]。
3 共刺激分子CD137及其激动剂
3.1 CD137参与免疫调节的分子机制
共刺激分子CD137(又名4-1BB和TNFRSF9)属肿瘤坏死因子受体家族成员,可诱导表达于激活的T细胞和自然杀伤(Natural killer,NK)细胞的表面,也可表达于激活的树突状细胞、肿瘤内皮细胞表面。其配体CD137L(又名4-1BBL和TNFSF9)可诱导表达于多种激活的APC表面,例如,树突状细胞、B细胞和巨噬细胞[29-31]。二者结合后不仅为T细胞(或NK细胞)激活提供共刺激信号,还可通过NF-κB信号通路促进抗凋亡基因Bcl-XL和Bf-1的表达,抑制激活诱导的细胞死亡,诱导T细胞增殖并增强其效应功能。此外,内皮细胞表达的CD137还可在胞内黏附分子ICAM-1和VCAM-1的帮助下,促进激活的T细胞浸润到肿瘤位点[29-31]。CD137分子功能的多效性使其成为一个非常具有吸引力的肿瘤免疫治疗靶点。
3.2 CD137激动剂在肿瘤治疗中的应用
目前,有2个CD137激动型抗体处于Ⅰ期临床研究阶段,即百时美施贵宝公司开发的IgG4型全人源单克隆抗体BMS-663513(又名Urelumab)和辉瑞公司开发的IgG4型全人源单克隆抗体PF-05082566。初步试验结果证明,CD137激动剂可显著增强T细胞和NK细胞的增殖和活性[32-33]。虽然BMS-663513在之前针对黑色素瘤患者开展的Ⅰ期临床试验中抗肿瘤效果表现较好,但其Ⅱ期临床试验却因产生严重的肝毒性而不得不提前终止[30,33]。为了获得BMS-663513的安全有效剂量,新一轮临床试验已经展开,包括单独治疗晚期或转移性实体瘤和复发性或难治性B细胞非霍奇金淋巴瘤,以及与其他药物联合治疗多种血液肿瘤或实体瘤。PF-05082566单独或联合其他药物(如利妥昔单抗)治疗不同肿瘤的多项Ⅰ期临床试验也已开始招募受试者[30,32-33]。
除了抗CD137抗体具有抗肿瘤作用外,靶向CD137或CD137L的其他策略也非常具有开发前景,例如,CD137嵌合抗原受体(chimeric antigen receptor,CAR)[34-35]和可溶性CD137L[32,36]等。CAR修饰T细胞(CAR-T)疗法是近年来迅速发展的一种过继细胞免疫治疗新手段,它利用基因工程技术将能够与肿瘤抗原结合的胞外受体区、中间跨膜区和胞内信号转导区结合起来,体外转染至肿瘤患者T细胞中使其表面表达肿瘤抗原受体,将该T细胞进行体外扩增和纯化后再回输给肿瘤患者,从而达到靶向性杀伤肿瘤的目的[37]。在CAR胞内信号区加入共刺激分子CD137的第二代CAR大大提高了CAR-T细胞的细胞毒性、增殖活性和T细胞应答的持久性[32,35]。在治疗急性淋巴细胞白血病的Ⅰ期临床试验中,靶向CD19的CAR-T细胞药物CTL019(一种由慢病毒载体表达的嵌合抗原受体,其T细胞激活信号由CD3ζ链和CD137结构域提供)取得令人鼓舞的治疗效果,90%患者的病情得到完全缓解,总生存率达78%,2014年7月被美国FDA认证为“突破性疗法”[35,38-39]。
4 联合免疫疗法
由于免疫系统在肿瘤发展过程中的相互作用是动态的,而且各种共受体信号分子的表达调控也比较复杂,因此,仅仅依靠针对单一靶点的治疗不可能彻底治愈癌症,联合免疫疗法势在必行。根据共受体信号发挥免疫调节分子机制的区别,合理选择不同靶点相关药物进行联合治疗在理论上都能使患者受益,初步临床试验也证明了该设想的可行性[5,33]。近期报道的一项针对既往未接受过治疗的黑色素瘤患者的Ⅲ期临床研究数据显示,抗PD-1抗体nivolumab和抗CTLA-4抗体ipilimumab联合治疗组的中位无进展生存期为11.5个月,而nivolumab和ipilimumab单药治疗组分别为6.9和2.9个月[40]。由于传统疗法(例如放疗、化疗、手术、基因组靶向药物或血管生成抑制剂)能通过诱发肿瘤死亡、释放新抗原等机制来增加肿瘤细胞的抗原性、免疫原性和被免疫系统攻击的敏感性,因此免疫疗法与传统疗法联合将能创造具有免疫原性的肿瘤微环境,恢复免疫监视,增强机体对肿瘤的免疫反应[5,33]。Ipilimumab联合放疗治疗转移性黑色素瘤和肺癌等实体瘤的多项临床试验正在招募受试者[41]。Nivolumab联合酪氨酸激酶抑制剂ibrutinib或sunitib治疗转移性肾细胞癌的临床试验获得了有希望的结果,不管患者有无表达PD-L1均表现出了相似的应答率[5]。已有越来越多的证据提示,联合免疫疗法能显著增强抗肿瘤免疫应答,具有广阔开发空间。
5 结语
经过多年的曲折发展,肿瘤免疫治疗,尤其是针对T细胞共信号分子的抗体治疗,已成为新一代对抗肿瘤的主流手段。抗PD-1和PD-L1抗体在多种肿瘤患者中均产生了出乎意料的持续应答反应,改革了肿瘤患者的治疗策略,大大提高了晚期恶性肿瘤患者的生存质量。除了本文涉及的靶点外,新的T细胞共信号治疗靶点(例如共抑制分子BTLA、TIM3和LIGHT,共刺激分子CD40、OX40和ICOS等)不断涌现,人们已开展一系列试验评价其相关药物在肿瘤治疗中的临床价值。但是,为了能使更多肿瘤患者获益,仍有大量工作要做。其中,如何与其他药物或治疗方式合理联用将是肿瘤免疫治疗今后发展的重要方向。
[1]Chen L, Flies D B. Molecular mechanisms of T cell co-stimulation and co-inhibition[J]. Nat Rev Immunol, 2013, 13 (4): 227-242.
[2]Pardoll D M. The blockade of immune checkpoints in cancer immunotherapy [J]. Nat Rev Cancer, 2012, 12 (4): 252-264.
[3]Croft M, Benedict C A, Ware C F. Clinical targeting of the TNF and TNFR superfamilies [J]. Nat Rev Drug Discov, 2013, 12 (2): 147-168.
[4]Kyi C, Postow M A. Checkpoint blocking antibodies in cancer immunotherapy [J]. FEBS Lett, 2014, 588 (2): 368-376.
[5]Sharma P, Allison J P. The future of immune checkpoint therapy [J]. Science, 2015, 348 (6230): 56-61.
[6]Blank C U. The perspective of immunotherapy: new molecules and new mechanisms of action in immune modulation [J]. Curr Opin Oncol,2014, 26 (2): 204-214.
[7]Couzin-Frankel J. Breakthrough of the year 2013. Cancer immunotherapy [J]. Science, 2013, 342 (6165): 1432-1433.
[8]Shin D S, Ribas A. The evolution of checkpoint blockade as a cancer therapy: what's here, what's next? [J]. Curr Opin Immunol, 2015, 33: 23-35.
[9]Nirschl C J, Drake C G. Molecular pathways: coexpression of immune checkpoint molecules: signaling pathways and implications for cancer immunotherapy [J]. Clin Cancer Res, 2013, 19 (18): 4917-4924.
[10]Hodi F S, O'Day S J, McDermott D F, et al. Improved survival withipilimumab in patients with metastatic melanoma [J]. N Enql J Med,2010, 363 (8): 711-723.
[11]Robert C, Thomas L, Bondarenko I, et al. Ipilimumab plus dacarbazine for previously untreated metastatic melanoma[J]. N Engl J Med, 2011,364 (26): 2517-2526.
[12]Schadendorf D, Hodi F S, Robert C, et al. Pooled analysis of longterm survival data from phase II and phase III trials of ipilimumab in un-resectable or metastatic melanoma [J]. J Clin Oncol, 2015, 33 (17):1889-1894.
[13]Camacho L H, Antonia S, Sosman J, et al. Phase I/II trial of tremelimumab in patients with metastatic melanoma [J]. J Clin Oncol, 2009,27 (7): 1075-1081.
[14]Kirkwood J M, Lorigan P, Hersey P, et al. Phase II trial of tremelimumab(CP-675,206) in patients with advanced refractory or relapsed melanoma[J]. Clin Cancer Res, 2010, 16 (3): 1042-1048.
[15]Ribas A, Kefford R, Marshall M A, et al. Phase III randomized clinical trial comparing tremelimumab with standard-of-care chemotherapy in patients with advanced melanoma [J]. J Clin Oncol, 2013, 31: 616-622.
[16]Calabrò L, Morra A, Fonsatti E, et al. Tremelimumab for patients with chemotherapy-resistant advanced malignant mesothelioma: an openlabel, single-arm, phase 2 trial [J]. Lancet Oncol, 2013, 14 (11): 1104-1111.
[17]Calabrò L, Morra A, Fonsatti E, et al. Efficacy and safety of an intensified schedule of tremelimumab for chemotherapy-resistant malignant mesothelioma: an open-label, single-arm, phase 2 study [J]. Lancet Respir Med, 2015, 3 (4): 301-309.
[18]Rini B I, Stein M, Shannon P, et al. Phase 1 dose-escalation trial of tremelimumab plus sunitinib in patients with metastatic renal cell carcinoma [J]. Cancer, 2011, 117 (4): 758-767.
[19]Aglietta M, Barone C, Sawyer M B, et al. A phase I dose escalation trial of tremelimumab (CP-675,206) in combination with gemcitabine in chemotherapy-naive patients with metastatic pancreatic cancer [J]. Ann Oncol, 2014, 25 (9): 1750-1755.
[20]Hamid O, Robert C, Daud A, et al. Safety and tumor responses with lambrolizumab (anti-PD-1) in melanoma [J]. N Engl J Med, 2013, 369(2): 134-144.
[21]Robert C, Ribas A, Wolchok J D, et al. Anti-programmed-deathreceptor-1 treatment with pembrolizumab in ipilimumab-refractory advanced melanoma: a randomized dosecomparison cohort of a phase 1 trial [J]. Lancet, 2014, 384: 1109-1117.
[22]Robert C, Long G V, Brady B, et al. Nivolumab in previously untreated melanoma without BRAF mutation [J]. N Engl J Med, 2015, 372 (4):320-330.
[23]Gettinger S N, Horn L, Gandhi L, et al. Overall survival and long-term safety of nivolumab (anti-programmed death 1 antibody, BMS-936558,ONO-4538) in patients with previously treated advanced non-small-cell lung cancer [J]. J Clin Oncol, 2015, 33 (18): 2004-2012.
[24]Brahmer J R, Tykodi S S, Chow L Q, et al. Safety and activity of anti-PD-L1 antibody in patients with advanced cancer [J]. N Engl J Med,2012, 366 (26): 2455-2465.
[25]Powles T, Eder J P, Fine G D, et al. MPDL3280A (anti-PD-L1) treatment leads to clinical activity in metastatic bladder cancer [J]. Nature, 2014,515 (7528): 558-562.
[26]Herbst R S, Soria J C, Kowanetz M, et al. Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients [J]. Nature, 2014, 515: 563-567.
[27]Ibrahim R, Stewart R, Shalabi A. PD-L1 blockade for cancer treatment:MEDI4736 [J]. Semin Oncol, 2015, 42 (3): 474-483.
[28]Ribas A. Tumor immunotherapy directed at PD-1 [J]. N Engl J Med,2012, 366: 2517-2519.
[29]Vinay D S, Kwon B S. Immunotherapy of cancer with 4-1BB [J]. Mol Cancer Ther, 2012, 11 (5): 1062-1070.
[30]Moran A E, Kovacsovics-Bankowski M, Weinberg A D. The TNFRsOX40, 4-1BB, and CD40 as targets for cancer immunotherapy [J]. Curr Opin Immunol, 2013, 25 (2): 230-237.
[31]Vinay D S, Kwon B S. 4-1BB (CD137), an inducible costimulatory receptor, as a specifc target for cancer therapy [J]. BMB Rep, 2014, 47(3): 122-129.
[32]Bartkowiak T, Curran M A. 4-1BB agonists: multi-potent potentiators of tumor immunity [J]. Front Oncol, 2015, 5: 117.
[33]Mahoney K M, Rennert P D, Freeman G J. Combination cancer immunotherapy and new immunomodulatory targets [J]. Nat Rev Drug Discov, 2015, 14 (8): 561-584.
[34]Campana D, Schwarz H, Imai C. 4-1BB chimeric antigen receptors [J]. Cancer J, 2014, 20 (2): 134-140.
[35]Van der Stegen S J, Hamieh M, Sadelain M. The pharmacology ofsecond-generation chimeric antigen receptors [J]. Nat Rev Drug Discov,2015, 14 (7): 499-509.
[36]Wang S, Lv J, Wang P, et al. Recombinant human CD137L for cancer immunotherapy: effects of different fusions and linkers on its activity [J]. Cancer Immunol Immunother, 2012, 61 (4): 489-495.
[37]Lizée G, Overwijk W W, Radvanyi L, et al. Harnessing the power of the immune system to target cancer[J]. Annu Rev Med, 2013, 64: 71-90.
[38]Grupp S A, Kalos M, Barrett D, et al. Chimeric antigen receptormodifed T cells for acute lymphoid leukemia [J]. N Engl J Med, 2013,368 (16): 1509-1518.
[39]Maude S L, Frey N, Shaw P A, et al. Chimeric antigen receptor T cells for sustained remissions in leukemia [J]. N Engl J Med, 2014, 371 (16):1507-1517.
[40]Larkin J, Chiarion-Sileni V, Gonzalez R, et al. Combined nivolumab and ipilimumab or monotherapy in untreated melanoma [J]. N Engl J Med,2015, 373 (1): 23-34.
[41]Crittenden M, Kohrt H, Levy R, et al. Current clinical trials testing combinations of immunotherapy and radiation [J]. Semin Radiat Oncol,2015, 25 (1): 54-64.

[专家介绍] 王淑珍 : 博士,副教授,硕士生导师。2005年获南京师范大学细胞生物学专业硕士学位;2008年获中国药科大学微生物与生化药学专业博士学位。现为中国药科大学生命科学与技术学院化学生物学研究室副教授,主要从事硫肽类抗生素生物合成途径和抗肿瘤分子靶向创新药物方面的研究。迄今共发表学术论文10余篇,申请PCT和中国发明专利8项,授权3项。现主持国家自然科学基金面上项目1项,先后参与“重大新药创制”国家科技重大专项项目、国家自然科学基金项目和江苏省科技支撑计划项目等多项国家和省级课题。
Advances in Research on Cancer Immunotherapy Targeting T Cell Co-signalling
ZHI Wangwang, SUN Chao, WANG Shuzhen
(School of Life Science and Technology, China Pharmaceutical University, Nanjing 210009, China)
It has been widely accepted that T cell-mediated antitumor immunity requires at least two signals from T cell receptor and costimulatory molecules. The co-signal provided by co-inhibitory or co-stimulatory molecules determines the fnal outcome of the immune response mediated by T cell receptor signalling. Recently, great clinical successes have been achieved in drugs targeting co-inhibitory signaling such as CTLA-4 and PD-1, which makes immunotherapy become the most notable research area and receive the 2013's Breakthrough of Year award made by the journal Science. Cancer immunotherapy is expected to become a mainstay treatment for cancer in addition to surgery, radiation, chemotherapy, and targeted therapy. In this review, the most important co-inhibitory (CTLA4, PD-1/PD-L1) and co-stimulatory drug targets (CD137), their mechanisms of regulating cellular immune responses, as well as the recent development and applications of the targeted agents in cancer therapy were discussed.[Key words] cancer immunotherapy; T cell co-signalling; co-inhibition; co-stimulation; antagonist; agonist
R979.1
A
1001-5094(2015)09-0659-07
接受日期:2015-06-05
项目资助:国家自然科学基金(No. 81473126);
*通讯作者:王淑珍,副教授;
研究方向:抗肿瘤分子靶向创新药物研究;
Tel:025-83271031;E-mail:shuzhenwang@cpu.edu.cn
