丹参有效部位的一般药理学和长期毒性研究
2015-11-24庞晶刘尚裕张伟新李国庆杨信怡李聪然游雪甫
庞晶,刘尚裕,张伟新,李国庆,杨信怡,李聪然,游雪甫
·论著·
丹参有效部位的一般药理学和长期毒性研究
庞晶,刘尚裕,张伟新,李国庆,杨信怡,李聪然,游雪甫
目的研究丹参抗HIV有效部位(DS-MEF)对小鼠精神神经系统的影响、对麻醉犬心血管系统和呼吸系统的影响以及长期给药对大鼠产生的毒性反应,为DS-MEF的进一步研究和应用提供依据。
方法DS-MEF 2000、4000、8000 mg/kg对小鼠灌胃给药一次后,观察其对小鼠自主活动、协调平衡运动以及戊巴比妥钠阈下催眠作用的影响;DS-MEF 500、1000、2000 mg/kg对犬灌胃给药一次后,考察240 min内其对犬血压、心率、心电图和呼吸系统的影响;DS-MEF 2000、4000、8000 mg/kg对大鼠连续灌胃给药12周,末次给药24 h和停药3周后,每组取半数动物(雌雄各半)进行体重、血液学、血液生化、尿液、脏器系数及病理组织学变化等检查。
结果DS-MEF对小鼠精神神经系统未见明显影响;对犬血压、心率和心电图各指标以及呼吸频率和呼吸深度未见明显影响;长期给药后,大鼠外观体征、一般活动等未见异常,体重变化和饲料消耗量与对照组比较无显著差异,动物心、肝、脾、肺、肾等主要脏器组织病理学检查未见药物引起的异常改变。
结论本实验条件下,未观察到丹参有效部位对小鼠精神神经系统、对犬的心血管系统和呼吸系统的显著影响,且在长期毒性研究中,未见其对大鼠产生显著的毒性反应。
丹参;毒性试验,慢性;一般药理学;DS-MEF
丹参(Salvia miltiorrhiza-Bunge)是唇型科鼠尾属多年生草本植物,是我国传统医药学中广泛使用的药物之一,临床应用历史悠久。现代药理学研究证明丹参功能多样,药理活性广泛,具有活血化瘀、活络通痹、养心安神、解毒凉血、排脓生肌、消肿止痛、疗疮止痢等多种功效,丹参尤以治疗冠心病及缺血性脑血管病最为常用[1]。陈鸿珊等[2]发现丹参提取物具有抗艾滋病和乙型肝炎活性。
彭宗根等[3]以云南小紫丹参根为原料,以体外抑制HIV-1逆转录酶和整合酶活性为检测指标,经导向提取分离,获得抗HIV-1的复合有效部位DS-MEF。经放射性核素3H掺入法、荧光方法酶联免疫吸附实验测定,证明DS-MEF可同时抑制HIV-1逆转录酶、蛋白酶和整合酶的活性,提示它是一个有多靶点作用环节的抗HIV-1药物。细胞实验结果表明,DS-MEF在人传代T淋巴细胞MT-4细胞培养内对HIV-1 IIIB病毒株有抑制作用;同时,在人外周血单核细胞(PBMC)培养中,不仅对AZT敏感株HIV-1018a有效,对AZT临床耐药株HIV-1018c也有抑制作用。以上研究结果证明,DS-MEF与已知药物可能具有不同的作用靶点,对敏感株和耐药株均有较好的疗效。DS-MEF灌胃20 g/kg对昆明种小鼠无明显的不良反应,无致死剂量(LD0>20 g/kg),腹腔注射的半数致死剂量(LD50)为1.18 g/kg,LD0为0.71 g/kg,提示DS-MEF毒性较低。因此,从丹参根中提取分离获得的DS-MEF具有多靶点、毒性小等特点,具有进一步研究和开发的价值。故本研究对该丹参有效部位的一般药理学和长期毒性开展研究,为其进一步的应用提供安全性理论依据。
1 材料与方法
1.1 材料
1.1.1 药品与试剂丹参有效部位DS-MEF(棕色粉末,批号:20051231-H)由本所病毒室提供;生化检测试剂盒购自中生北控科技股份有限公司和英国Randox公司。
1.1.2 主要仪器及设备7060型全自动生化分析仪购自日本Hitachi公司;Mini Aution Analyzer MA-4210尿液分析仪购自日本DIC公司;XZ-4小鼠自主活动计数仪为中国医学科学院药物研究所产品;GY-640多道生理记录仪为开封华南仪器厂产品。
1.1.3 药物配制原料药由本实验室常温密闭保存。每次给药前,以灭菌蒸馏水配制成适当浓度的药液。
1.1.4 实验动物SPF级ICR小鼠,120只,雌雄各半,体重19~23 g,由北京维通利华实验动物技术有限公司提供,合格证号:SCXK(京)2002-0003;普通级比格犬,24只,雄性,体重9.6~11.4 kg,由北京市通利试验动物养殖场提供,合格证号:SCXK京动管犬字2005-0003号;SPF级Wistar大鼠,160只,雌雄各半,体重90~110 g,由北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2002-0003。
1.1.5 给药DS-MEF临床试验拟采用的给药途径为口服给药,故在一般药理学实验中,小鼠和犬为单剂量灌胃给药;长期毒性研究中,大鼠灌胃给药1次/d,连续给药90 d。DS-MEF的人临床拟采用剂量为250 mg/kg,换算动物的给药剂量,以相当于人临床拟用剂量、2倍临床剂量和4倍临床剂量的剂量作为动物的低、中、高剂量,小鼠设置2000、4000、8000 mg/kg剂量组,犬设置500、1000、2000 mg/kg剂量组。综合考虑剂量换算结果,以及DS-MEF的溶解度,长期毒性研究中,大鼠的给药剂量组设置为2000、4000、8000 mg/kg。
1.2 方法
1.2.1 对小鼠精神神经系统的影响120只小鼠按性别随机分为12组,每组10只,每个测定项目4组小鼠,分别为DS-MEF 8000、4000、2000 mg/kg 3个给药剂量组和溶剂对照组,分别从DS-MEF对小鼠自主活动、攀坡能力以及戊巴比妥钠阈下催眠作用的影响等3个方面,考察丹参有效部位对小鼠精神神经系统的影响[4-5]。
使用小鼠自主活动计数仪记录给药1、2、4和6 h后,小鼠5 min内的自主活动数。将25 cm宽,75 cm高的木板放置呈75°角,记录给药1、2、4和6 h后,各组置于板上向上攀爬的小鼠中未能爬上板或落下的小鼠数(统称为落板小鼠数)。小鼠灌胃给药后30 min,腹腔注射25 mg/kg戊巴比妥钠,观察10 min内睡眠情况(以翻正反射消失达1 min以上为准)。
1.2.2 对犬心血管系统和呼吸系统的影响24只比格犬分为4组,2000、1000、500 mg/kg剂量组和溶剂对照组。动物经30%戊巴比妥钠30 mg/kg静脉注射麻醉,于左侧腹股沟动脉内插入动脉插管,与压力传感器连接,另一端与多导生理仪的血压测定仪连接,记录血压;并连接四肢心电导线,记录肢体标准II导联的心电图变化;拉力传感器经导线与胸部皮肤连接,记录呼吸变化。待血压、心率、心电图和呼吸平稳后,记录给药前上述各指标作为对照,并根据体重灌胃给药,给药后15、30、45、60、90、120、180和240 min,分别测定血压、心电图、呼吸频率和深度,与给药前进行比较,同时给药组各时间点各指标与溶剂对照组进行组间对比[4-6]。各组动物均在给药2 h后静脉注射补充2 ml戊巴比妥钠。
1.2.3 长期毒性160只大鼠分为4组,8000、4000、2000 mg/kg剂量组和溶剂对照组。大鼠每天口服给药1次,连续给药3个月。给药容积为2 ml/100 g体重,给药量随每次称量体重的变化而调整。给药1个月后调整给药容积为1 ml/100 g体重。试验期间观察动物外观体征和行为活动等,每3天称重一次,每周测定一次24 h食物消耗量。分别于末次给药24 h和停药3周后每组采用颈动脉放血方法处死20只大鼠,雌雄各半。动物处死前一天进行尿液检查,处死当天进行血液学检查、血清生化检查和器官称重,并留取器官组织标本做病理检查[7-10]。
血液学检查由中国医学科学院药物研究所安全评价中心进行,检查红细胞(RBC)、血红蛋白(HGB)、红细胞压积(HCT)、平均红细胞容积(MCV)、平均血红蛋白量(MCH)、平均红细胞蛋白浓度(MCHC)、血小板(PLT)、网织红细胞(RET)、凝血时间、白细胞(WBC)总数和分类等血液学参数。血液生化检查包括天门冬氨酸氨基转移酶(GOT)、丙氨酸氨基转移酶(GPT)、碱性磷酸酶(ALP)、总胆红素(T-BIL)、总胆固醇(CHO)、血糖(GLU)、总蛋白(TP)、白蛋白(ALB)、尿素氮(BUN)、肌酐(CRE)、甘油三酯(TG)、肌酸激酶(CK)、钾(K+)、钠(Na+)、氯(Cl-)等参数的测定。尿液检查包括亚硝酸盐(NHT)、酸碱度(pH)、尿糖(GLU)、尿蛋白(PRO)、尿潜血(BLD)、酮体(KET)、尿胆红素(BIL)和尿胆原(URO)、白细胞和尿比重(SG)及尿沉渣显微镜检查等10项检查。病理学检查通过大体解剖,观察各系统脏器的肉眼可见的病理变化;测定主要脏器的重量和脏器系数;主要组织的组织病理学检查由中国疾病预防控制中心辐射防护与核安全医学所进行[11]。
1.3 统计学处理
小鼠攀坡能力和戊巴比妥钠阈下催眠作用实验数据使用χ2检验。小鼠自主活动以及犬心血管系统和呼吸系统数据用表示,使用student's t检验。大鼠长期毒性试验数据采用方差分析的方法。所有统计学处理经SPSS13.0统计软件进行计算。
2 结果
2.1 DS-MEF对小鼠精神神经系统的影响
2.1.1 对正常小鼠自主活动的影响小鼠口服DS-MEF后各时间点的小鼠自主活动数见表1。小鼠口服DS-MEF 1、2、4、6 h后,各给药组与对照组相比,自主活动次数无显著性统计学差异(P>0.05),表明DS-MEF对小鼠自主活动无明显影响。
2.1.2 对正常小鼠攀坡能力的影响小鼠攀坡能力试验中对照组及各给药组均无小鼠落板,表明DS-MEF对小鼠攀坡能力无明显影响。
2.1.3 对戊巴比妥钠阈下催眠作用的影响给药组及对照组小鼠注射戊巴比妥钠后,观察其10 min内睡眠情况(翻正反射消失)用以评价DS-MEF对戊巴比妥钠阈下催眠作用的影响。结果显示,8000 mg/kg组出现翻正反射消失小鼠数为5只,其他给药组及对照组均为3只,χ2检验无显著性差异,说明DS-MEF对戊巴比妥钠阈下催眠作用无明显影响。
2.2 DS-MEF对犬心血管系统和呼吸系统的影响
2.2.1 对犬心血管系统的影响DS-MEF对麻醉犬收缩压和舒张压的影响见表2。结果表明,对照组中,犬的收缩压和舒张压呈现缓慢轻度下降趋势,多数给药组麻醉犬的收缩压和舒张压在30、45、60和90 min时间点略有上升,但与给药前相比没有显著差异,120 min后逐渐下降。各时间点血压与对照组相比也无显著差异。
DS-MEF对犬心率的影响见表3。结果表明,各给药组和对照组麻醉犬的心率随麻醉时间的延长而逐渐下降。2000 mg/kg组与对照组相应时间点心率相比,有显著差异(P<0.01),但给药后各时间点心率与给药前相比没有显著差异,且两组动物心率均在正常生理范围内波动。1000、500 mg/kg组各时间点心率与对照组相比无显著性差异,并且各组给药后各时间点心率与给药前相比也无显著性差异。

表1 小鼠自主活动次数(n=10)Table 1Locomotor activity times of the mice(n=10)

表2 麻醉犬的收缩压和舒张压(kPa,n=6)Table 2Systolic and diastolic blood pressure of anesthetized dogs(kPa,n=6)

表3 麻醉犬的心率(次/min,n=6)Table 3The heart rates of anesthetized dogs(times/min,n=6)

表4 麻醉犬心电图S-T间期和T波间期(s,n=6)Table 4S-T segment and T wave interval of anesthetized dogs(s,n=6)
各给药组麻醉犬给药后的其他心电图指标,如P波、P-R间期、QRS间期、QRS波电压、T波电压等,与给药前相比未见明显影响,与对照组相比无显著差异。
2.2.2 对犬呼吸系统的影响DS-MEF对犬呼吸频率和呼吸深度的影响结果见表5。结果表明,各给药组给药后4 h内犬的呼吸频率和呼吸深度与给药前相比没有显著变化,各给药组各时间点的呼吸频率和呼吸深度与对照组相应时间点相比也未见显著差异。
2.3 对大鼠的长期毒性作用
2.3.1 一般观察动物在试验期间未见外观体征和行为活动等异常。试验期间,各剂量组动物的食物消耗量和水消耗量未见异常。给药期间,2000 mg/kg组和4000 mg/kg组动物体重与对照组和8000 mg/kg组相比增速较快,但除2000 mg/kg组雌鼠第12周以及2000 mg/kg组雄鼠第4周与对照组相比体重有明显差异(P<0.05),其他剂量组的动物各给药阶段与对照组相比无明显差异(表6)。
2.3.2 血液学检查停药时以及恢复期的血液学检查结果见表7。停药时,8000 mg/kg给药组雌鼠和雄鼠的MCV指标均高于对照组,具有显著性差异(P<0.05),而其他检测指标均未见异常,2000 mg/kg组和4000 mg/kg组的各项检测指标均未见异常。停药3周后,8000 mg/kg组雌鼠的WBC、HCT、MCHC和MCV指标均高于对照组(P<0.05),其他指标未见异常。
2.3.3 血液生化检查停药时以及恢复期的血液生化检查结果见表8。停药时,对于雌性大鼠,4000 mg/kg组和8000 mg/kg组ALP低于对照组(P<0.05),而其他指标未见异常;对于雄性大鼠,各剂量组GPT均低于对照组,具有极显著性差异(P<0.01),4000 mg/kg组和8000 mg/kg组雄鼠ALP低于对照组(P<0.05),4000 mg/kg组雄鼠Cre低于对照组(P<0.01),2000 mg/kg组雄鼠Na+高于对照组(P<0.01),其他指标未见异常。停药3周后,对于雌性大鼠,8000 mg/kg组的GPT以及4000、8000 mg/kg组的ALP低于对照组(P<0.05),而8000 mg/kg组雌鼠T-BIL和K+高于对照组(P<0.05),其他各项指标未见异常;对于雄性大鼠,8000 mg/kg组雄鼠GPT和ALP均低于对照组(P<0.05),其他指标均未见异常。

表5 麻醉犬呼吸频率和呼吸深度(n=6)Table 5The respiratory rate and depth of anesthetized dogs(n=6)

表6 给药期间大鼠的体重(g,n=40)Table 6The body weight of rats(g,n=40)

表7 停药时和恢复3周后大鼠血液学指标(n=20)Table 7Haematological parameters of rats 24 h and 3 weeks post last dose(n=20)
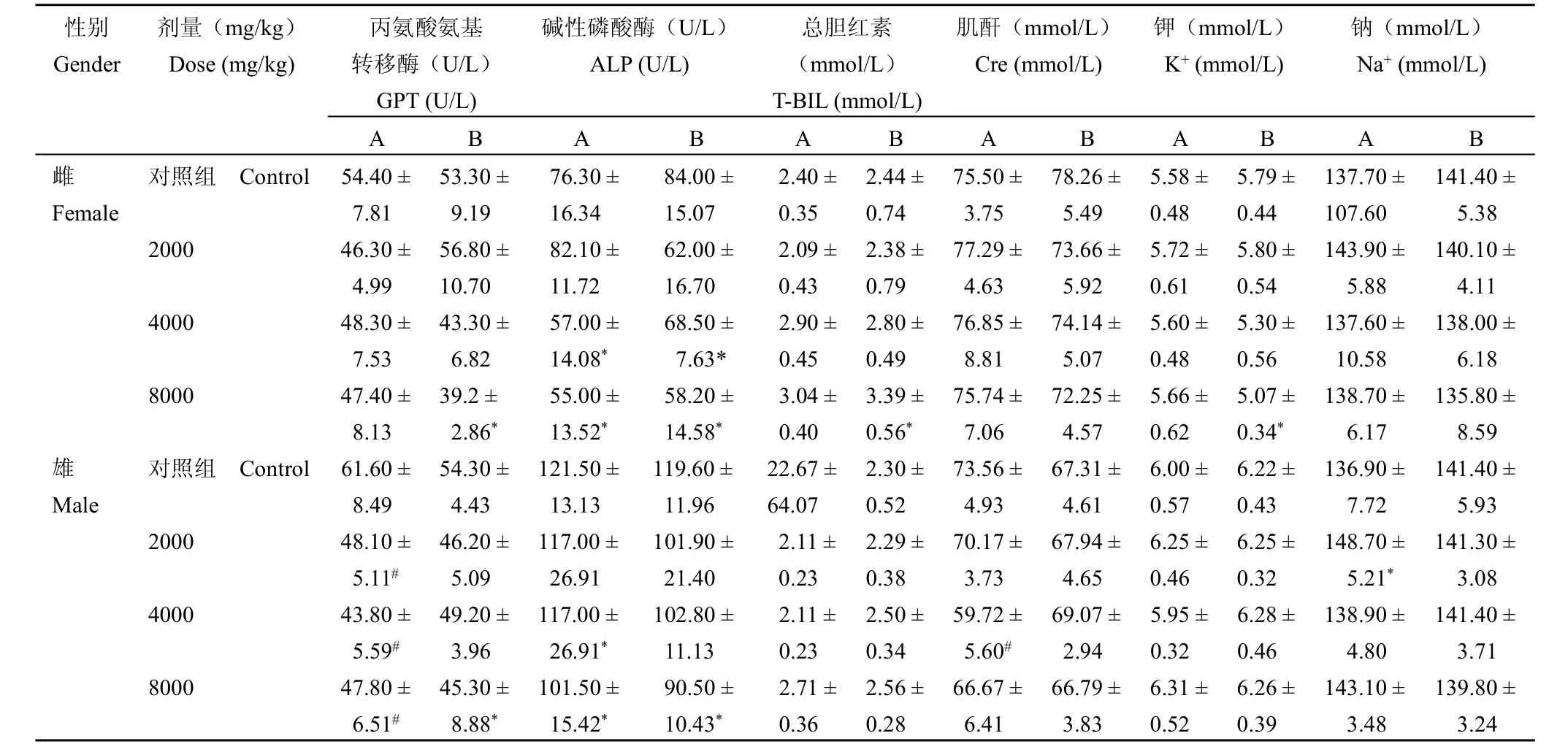
表8 停药时和恢复3周后大鼠血清生化指标(n=20)Table 8The biochemical parameters of rat serum 24 h and 3 weeks post last dose(n=20)
2.3.4 尿液检查停药24 h的尿液检查结果(表9)显示,对于雌性大鼠,4000 mg/kg(P<0.01)和8000 mg/kg(P<0.05)给药组尿液pH值均低于对照组;各给药组雌鼠均出现蛋白尿(PRO)个体,其他指标无异常。对于雄性大鼠,2000 mg/kg(P<0.05)和8000 mg/kg(P<0.05)给药组pH值均低于对照组;各给药组均出现PRO个体,其他指标无异常。停药3周后(恢复期结束时),各剂量组大鼠尿液指标均无异常。
2.3.5 大体解剖检查与脏器系数停药时,除观察到各剂量组雄鼠盲肠段增大以及4000 mg/kg组雄鼠肾脏系数高于对照组(P<0.05)外,未见其他器官组织的肉眼可见病理变化以及脏器系数异常。恢复期结束时,各剂量组与对照组相比,大鼠大体解剖检查和脏器系数均未见异常。
由于大体解剖检查观察到DS-MEF各剂量组雄鼠盲肠段增大,所以对盲肠段进行了称重比较。停药时丹参有效部位各组盲肠段的增大与剂量相关,8000 mg/kg组盲肠段重于2000和4000 mg/kg组(P<0.01),差异有极显著性意义。
2.3.6 组织病理检查结果组织病理学检查结果显示,各剂量组脑、甲状腺、唾液腺、食道、骨髓、胸腺、肺脏、心脏、胰腺、脾脏、肝脏、肾上腺、肾脏、膀胱、雄性动物睾丸、附睾、前列腺、雌性动物卵巢、子宫、乳腺、胃、小肠、大肠、淋巴结、脊髓、坐骨神经以及给药局部(食道)等各受检器官、组织未见病理性改变。
3 讨论
丹参是我国传统医药学中广泛使用的中药之一,药理活性主要是对心脑血管系统的作用,用于治疗冠心病、高脂血症、脑血管病。彭宗根等[3]应用体外抗HIV-1活性追踪,采用现代分离技术,获得了DS-MEF。其具有同时抑制HIV-1整合酶、逆转录酶和蛋白酶的活性,提示它是一个有多靶点作用环节的抗HIV-1药物,可实现多重靶点的抗HIV-1的复合作用,理论上可降低耐药株的出现。故本研究对DS-MEF的一般药理学和长期毒性开展研究,为其进一步的应用提供安全性理论依据。
丹参有效部位单剂量口服给药后,小鼠自主活动次数、攀坡落板小鼠数以及戊巴比妥钠阈下剂量催眠小鼠数量与对照组相比均无显著差异,证明其对小鼠精神神经系统均未产生显著影响。犬单剂量给药后,虽然收缩压、舒张压,心率以及S-T间期、T波间期与对照组相比虽略有差别,但与本组给药前相比没有显著性差异,且均在正常生理范围内波动,因此认为丹参有效部位对犬心血管系统和呼吸系统无显著影响。大鼠连续口服丹参12周的长期毒性试验结果可见,虽然各给药组连续给药后部分指标略有异常(如MCV增高等血液学指标变化,T-BIL升高等血液生化参数变化以及出现尿蛋白等尿液异常),并出现部分动物盲肠段增大和肾脏系数增大等异常,但组织病理学检查结果显示,各给药组均未引起大鼠脏器的病理性改变,故认为大鼠3个月长期毒性的安全剂量为8000 mg/kg。
综上所述,一般药理学和长期毒性研究表明,丹参有效部位DS-MEF在上述给药剂量下,未产生显著不良反应,提示其安全性较高。
[1]Zhou L,Zuo Z,Chow MS.Danshen:an overview of its chemistry,pharmacology,pharmacokinetics,and clinical use.J Clin Pharmacol,2005,45(12):1345-1359.
[2]Chen HS,Yan XG,Zhang XQ,et al.Study on anti-HIV and hepatitis B virus activity of Salvia in vitro.Acta Acad Med Sinicae,1996,18(6):481.(in Chinese)
陈鸿珊,阎旭光,张兴权,等.中药丹参体内外抗艾滋病和乙型肝炎病毒作用的研究(简报).中国医学科学院学报,1996,18(6):481.
[3]Peng ZG,Qin DH,Teng L,et al.Study on ant-iHIV-1 activities of composite extract from Salvia Yunnanensis.Chin J Integr Traditional West Med,2008,28(8):711-715.(in Chinese)
彭宗根,秦德华,滕立,等.丹参复合有效部位抗HIV-1活性的实验研究.中国中西医结合杂志,2008,28(8):711-715.
[4]China Food and Drug Administration.Guiding principles for general pharmacology study of chemical drugs.2005-03-18.(in Chinese)
国家食品药品监督管理总局.化学药物一般药理学研究技术指导原则.2005-03-18.
[5]The International Conference on Harmonisation.Safety Pharmacology Studies for Human Pharmaceuticals S7A.2000[2014-01-15].http:// www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Sa fety/S7A/Step4/S7A_Guideline.pdf.
[6]The International Conference on Harmonisation.Safety Pharmacology Studies for assessing the potential for delayed ventricular repolarization(QT interval prolongation)by Human Pharmaceuticals S7B.2005[2014-01-15].http://www.fda.gov/downloads/drugs/guidancecomplian ceregulatoryinformation/guidances/ucm074963.pdf.
[7]China Food and Drug Administration.Guiding principles for long term toxicity of chemical drugs.2005-03-18.(in Chinese)
国家食品药品监督管理总局.化学药物长期毒性试验技术指导原则.2005-03-18.
[8]Wilson NH,Hardisty JF,Hayes JR.Short-term,subchronic,and chronic toxicology studies//Hays AW.Principles and methods of toxicology.4th ed.Philadelphia:Taylor&Francis,2001:917-957.
[9]The International Conference on Harmonisation.Duration of chronic toxicity testing in animals(rodent and non-rodent toxicity testing)S4. 1998[2014-01-15].http://www.ich.org/fileadmin/Public_Web_Site/ ICH_Products/Guidelines/Safety/S4/Step4/S4_Guideline.pdf.
[10]European Medicines Agency.Note for Guidance for Repeated Dose Toxicity.2000[2014-01-15].http://www.ema.europa.eu/docs/en_GB/ document_library/Scientific_guideline/2009/09/WC500003102.pdf.
[11]Bregman CL,Adler RR,Morton DG,et al.Recommended tissue list forhistopathologicexaminationinrepeat-dosetoxicityand carcinogenicity studies:a proposal of the Society of Toxicologic Pathology(STP).Toxicol Pathol,2003,31(2):251-253.
MethodsThe effects of the effective fraction of Salvia on the locomotor activity,motor balance and coordination,and nembutalsubthreshold hypnosis of mice were evaluated after a single oral dose of 2000,4000 and 8000 mg/kg test article.The effects of a single oral administration of 500,1000 and 2000 mg/kg DS-MEF on dogs were investigated within 240 minutes for its impact on the blood pressure,heart rate,ECG and respiratory system.After 12-week repeated doses of 2000,4000 and 8000 mg/kg,half animals of each group(half male and half female)were sacrificed at 24 h and 3 weeks post last dose for detection of body weight,hematology,blood biochemistry,urine,organ coefficient,and histopathological changes,respectively.
ResultsThe anti-HIV effective fraction of Salvia exhibited no effect on the nervous system of mice.No significant impact on blood pressure,heart rate,ECG,and respiratory depth and rate of dogs was observed.After long-term administration to rats,no abnormality was observed in the appearance characteristics and general activities,no significant difference in body weight and food consumption was found between the dosing groups and control group,and no abnormal change was detected in heart,liver,spleen,lung,kidney,and other major organs in the histopathological examinations.
ConclusionThe anti-HIV effective fraction of Salvia did not show significant impact on the nervous system of mice,cardiovascular and respiratory system of dogs.No significant DS-MEF related toxicity effect was observed in the long-term toxicity research in rats as well.
Study on general pharmacology and long-term toxicity of the Salvia effective fraction
PANG Jing,LIU Shang-yu,ZHANG Wei-xin,LI Guo-qing,YANG Xin-yi,LI Cong-ran,YOU Xue-fu
ObjectiveThe effects of anti-HIV effective fraction of Salvia(DS-MEF)on mouse's nervous system and canine cardiovascular and respiration systems,as well as its long-term toxicity in rats were investigated so as to provide evidence for further research and its application.
Salvia miltiorrhiza;Toxicity tests,chronic;General pharmacology;DS-MEF
s:LI Cong-ran,Email:cong5885@aliyun.com;YOU Xue-fu,Email:xuefuyou@hotmail.com
10.3969/cmba.j.issn.1673-713X.2015.01.007
“十二五”国家科技重大专项(2008ZX09305-001、2012ZX0 9301002-001、2012ZX09301002-005)
100050北京,中国医学科学院北京协和医学院医药生物技术研究所药理室
李聪然,Email:cong5885@aliyun.com;游雪甫,Email:xuefuyou@hotmail.com
2014-02-06
www.cmbp.net.cn中国医药生物技术,2015,10(1):31-38
Author Affiliation:Department of Pharmacology,Institute of Medicinal Biotechnology,Chinese Academy of Medical Sciences& Peking Union Medical College,Beijing 100050,China
www.cmbp.net.cnChin Med Biotechnol,2015,10(1):31-38
