正性调节区锌指蛋白8的研究进展
2015-11-24路兆宁颜景斌
路兆宁,颜景斌
·综述·
正性调节区锌指蛋白8的研究进展
路兆宁,颜景斌
正性调节区锌指蛋白8(PR domain zinc finger protein 8,PRDM8)是PRDM家族中非常具有代表性的蛋白,它拥有典型的PR结构域和锌指结构,是神经系统发育和睾丸发育中重要的调控因子。
PRDM名称来源于N端保守的结构域——PR结构域(PR domain)[1]。PR结构域最初是在正性调节区I-结合因子1(positive regulatory domain I-binding factor 1,PRDI-BF1)和视网膜母细胞瘤蛋白质结合的锌指蛋白1(retinoblastoma protein-interacting zinc finger protein 1,RIZ1)两个蛋白(现在常分别称为PRDM1、PRDM2)中发现,从而被命名为PR(PRDI-BF1-RIZ1 homologous)domain[2]。
PRDM家族在进化过程中行使的功能逐渐专业化。PRDM基因最初出现在多细胞动物中,在脊椎动物中其家族成员不断扩大,在人类基因组中共有17个基因编码该家族蛋白[3]。该家族在基因表达调控和信号转导等过程中起着非常重要的作用,与细胞的增殖调控、分化、发育等密切相关,癌症以及一些其他疾病也与其家族中某些成员的异常有关[1,4]。
1 PRDM蛋白概述
1.1 PRDM蛋白的结构特点
PRDM蛋白家族具有两个显著的结构特点——PR结构域和不等数量的锌指结构(zinc fingers),此外有些成员还具有锌关节(zinc knuckle)[1](图1)。
⑴PR结构域。PR结构域是一段长约130个氨基酸的同源域,大多数位于蛋白质的N端。该结构域的氨基酸有20%~30%与SET[Su(var)3-9,E(z)and trithorax]结构域一致[5-6]。大部分SET结构域蛋白都具有组蛋白甲基转移酶(histone methyltransferase,HMT)活性[7]。然而只有PRDM2、PRDM8和PRDM9的PR结构域具有HMT活性[8-10]。
⑵锌指结构域。除了PRDM11外,其他所有的PRDM家族成员都具有数量不等的锌指结构[11]。锌指结构介导PRDM与DNA和蛋白相互作用:已证实PRDM1、3、4、5、9、14和16能够通过锌指结构进行序列特异性的DNA结合;一些成员通过锌指结构募集组蛋白修饰酶[12-13]。
⑶锌关节。锌关节是一段长约20个氨基酸的基序,因含有半胱氨酸和组氨酸,所以能结合锌离子。锌关节位于PR结构域之前,存在于PRDM4、6、7、9、10、11和15中,很可能参与蛋白-蛋白相互作用[14]。

图1 人类PRDM蛋白结构示意图[1]
1.2 PRDM蛋白的作用方式
目前的研究显示,PRDM蛋白家族主要通过以下三种方式来行使功能。
⑴内在的HMT活性。具有HMT活性的PRDM成员直接对靶基因的染色质结构进行修饰,从而调控基因的表达[4]。PRDM2和PRDM8通过催化组蛋白H3K9的二甲基化(H3K9me2)来抑制基因的表达,而PRDM9通过催化H3K4me3来激活基因的表达[8-10]。PRDM3和PRDM16催化的H3K9me1对于维持哺乳动物异染色质的完整性是必需的[15]。
⑵结合染色质编辑器。一部分成员通过与染色质编辑器(能够修饰染色质结构进而控制基因表达的蛋白[16])结合,完成对染色质的修饰,实现基因表达调控(表1)[1,13]。PRDM家族募集的染色质修饰酶包括HMT、组蛋白去乙酰化酶、组蛋白乙酰转移酶等,大部分通过对染色质的修饰而抑制转录[13]。
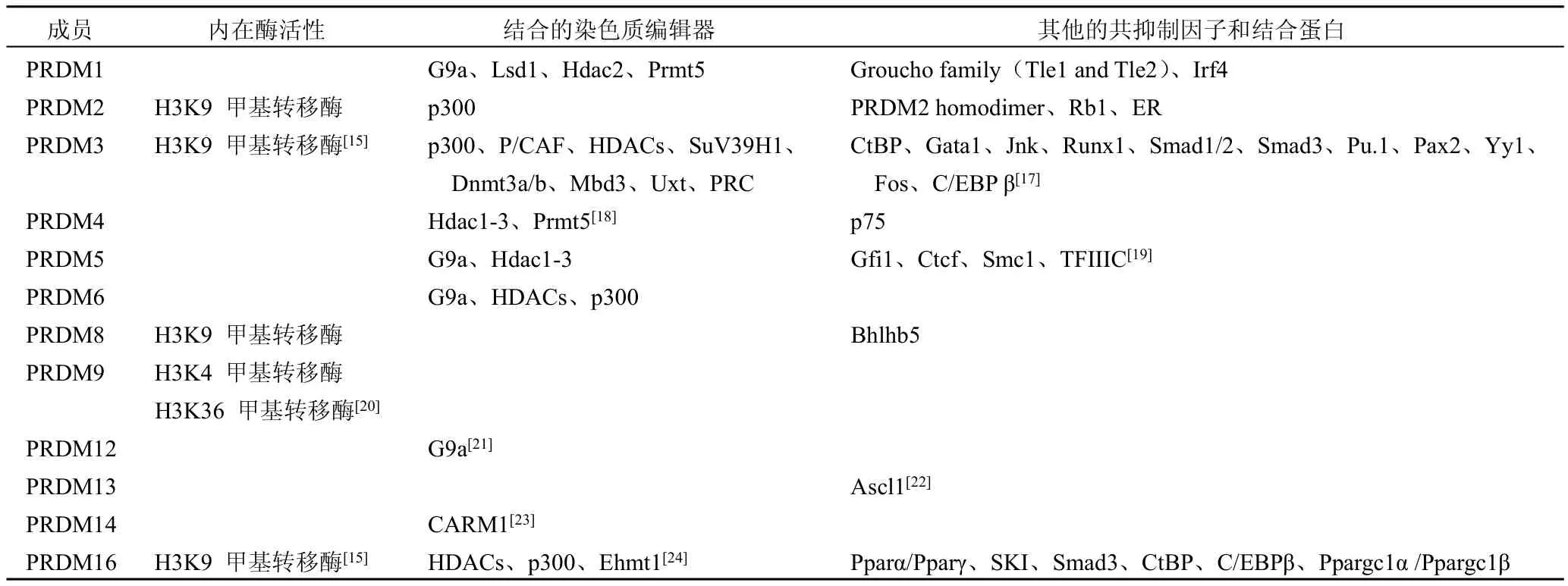
表1 PRDM酶活性和结合蛋白[12]
⑶与其他蛋白结合。除了与染色质编辑器结合外,PRDM蛋白还能与许多蛋白相互作用(表1),从而调控基因表达,参与信号转导等[12]。
2 PRDM8
2.1 PRDM8基因的结构
人PRDM8基因位于4q21,全长19 060 bp,包含10个外显子和9个内含子。PRDM8具有两个转录本:转录本1包括所有的外显子;转录本2包括内含子6的一部分及之后的外显子。两个转录本表达同一个全长689个氨基酸的蛋白。PRDM8中PR结构域位于蛋白的N端,一个锌指结构紧随PR结构域之后,另两个位于蛋白的C端(图1)。
小鼠的PRDM8基因位于5号染色体,全长6580 bp,包含4个外显子和3个内含子。只有一个转录本,表达的蛋白全长688个氨基酸。该基因在脊椎动物中是保守的,人类与小鼠的DNA序列一致性达86.2%;而氨基酸序列一致性更是高达90.4%。因此常以小鼠为工具,对PRDM8的功能进行研究。
2.2 PRDM8蛋白的表达
PRDM8的表达具有组织特异性和时空特异性。蛋白主要在成熟和发育的神经系统中表达,此外在肺、睾丸、骨骼肌等组织中也有表达[9,25-26]。PRDM8蛋白的时空特异性表达主要在发育的中枢神经系统中体现。
⑴在视网膜中,PRDM8在内核层和神经节细胞层的有丝分裂后神经元中表达,当视网膜发育完成后,主要限制在视杆双极细胞中表达;
⑵在脊髓中,起初PRDM8在腹侧中间神经元和运动神经元的祖先细胞中表达,后来在腹侧中间神经元(包括V2a)中表达;
⑶在胎脑中,PRDM8在大脑皮层中间区和皮质板中的有丝分裂后神经元中表达;
⑷在出生后的脑中,PRDM8主要在大脑皮层的第四层神经元中表达。
这些结果表明,在神经发育过程中,PRDM8的表达受严格的时空特异性调控,除脊髓外,主要限制在有丝分裂后神经元[26]。PRDM8的组织特异性和时空特异性表达表明它在特定组织和特定发育时期发挥着重要作用。
2.3 PRDM8的生物学功能
PRDM8在多种组织中都有表达,目前发现它主要是在神经系统发育和睾丸发育中起重要的作用,主要体现在以下四个方面。
⑴以转录抑制因子的形式参与神经回路的装配。Bhlhb5同源二聚体结合在序列特异性的DNA调控元件上,然后募集PRDM8,形成转录抑制复合物,抑制靶基因的表达,从而保证神经回路的正确形成(图2)。
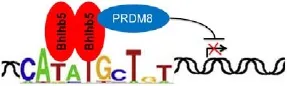
图2 PRDM8与Bhlhb5作用机制示意图[27]
Bhlhb5属于bHLH(basic helix-loop-helix)转录因子,可以与八核苷酸保守基序——CATATGNTNT结合。PRDM8与Bhlhb5的相互作用对于抑制复合物的功能是至关重要的。当小鼠缺少其中任何一种蛋白,都会出现极为类似的表型,包括脑端背侧神经元轴突的错误定位和非正常的类痒行为。
钙黏着蛋白Cdh11是一种细胞-细胞黏着分子,参与神经回路的装配,是PRDM8/Bhlhb5抑制复合物重要的靶基因之一。当Bhlhb5缺陷小鼠缺少Cdh11时,上面提到的两种表型会得到明显的改善,这一结果表明Cdh11是抑制复合物的靶基因。由此可见,PRDM8作为Bhlhb5必需的伴侣共同形成抑制复合物,通过对Cdh11的精确调控,在某种程度上指导神经回路的装配[27]。
⑵在端脑发育时受Notch-Hes信号通路的调控。Notch-Hes信号通路对于调控哺乳动物的神经发育是一个至关重要的机制。在哺乳动物皮质神经形成时,高水平的Notch-Hes信号通路通过上调bHLH效应器Hes1和Hes5来维持神经前体细胞。尤其是Hes1,不仅维持神经前体细胞的一致性而且会抑制以Ngn2(neurogenin2)为代表的原神经基因表达。这些前神经因子驱使前体细胞离开细胞周期,开始神经分化。因此,Hes活性的缺失会导致原神经基因表达的上调,从而导致神经过早地形成。
通过分析Hes(Hes1、2和5)cTKO突变体小鼠的端脑发现:与野生型相比,PRDM8和Ngn2的表达大幅增加。这说明,与Ngn2一样,PRDM8的表达水平也会受到Hes抑制,而且PRDM8可能也会在短暂的神经发育过程中得到激活[11]。
⑶在大脑新皮层发育过程中,调控神经元多极阶段的形态转变。在神经元多级阶段的晚期和末期,PRDM8主要在大脑皮层中间区的中间和上方表达,其表达几乎与一个晚期多极阶段的标记物Unc5D一致,只是Unc5D的表达逐渐下调而PRDM8的表达逐渐上调,该表达模式预示着PRDM8可能参与晚期和末期神经元多极阶段的调控,即控制形态转变的时间。
通过对大脑新皮层发育的功能获得和缺失分析发现,PRDM8敲除导致神经元多极形态过早地向双极形态转变,而过表达PRDM8则维持多极形态。此外,出生后分析显示,PRDM8敲除会增加早期新生神经元的数量,使得已分化神经元位于大脑新皮层的更深处,而且这些细胞中的大多数没有获得与层状位置相应的分子特点。通过对表达的分析得到,过表达PRDM8会上调或下调一些主要在神经元多级阶段的晚期和末期表达的基因。这些结果表明,PRDM8通过调控一些基因的表达实现对神经元从多极形态到双极形态转变的控制[28]。
⑷以组蛋白甲基转移酶(H3K9)活性调控小鼠睾丸类固醇合成。当PRDM8过表达时,类固醇合成的标记基因p450c17(属于细胞色素P450家族成员)和促黄体生成激素受体(luteinizing hormone receptor,LHR)的表达受抑制。
睾丸发育和精子形成是由内分泌激素控制,例如促性腺激素中的促黄体生成激素(LH)促进间质细胞类固醇的合成。间质细胞中类固醇合成起始于胆固醇向线粒体的转移,该过程受类固醇合成快速调节蛋白、细胞色素P450家族、3β-羟基类固醇脱氢酶等类固醇合成酶和LHR的调控。
体外组蛋白甲基转移酶实验发现,PRDM8具有H3K9甲基转移酶活性,其活性主要由PR结构域产生,会起到转录抑制的作用。当用LH处理小鼠间质细胞(TM3细胞系)刺激类固醇合成时,PRDM8的过表达导致p450c17和LHR的表达大幅度下调;而过表达失去甲基转移酶活性的PRDM8缺失突变体,抑制程度就没有那么明显。这说明在LH信号通路中,PRDM8利用组蛋白甲基转移酶活性,通过抑制类固醇合成标记基因p450c17和LHR的转录,对睾丸的发育进行调控[9]。
2.4 PRDM8与疾病发生的关系
2.4.1 PRDM8与早发型Lafora小体病有文献报道PRDM8与早发型Lafora小体病(early-onset lafora body disease)有关。PRDM8蛋白通过与磷酸酶laforin和泛素连接酶malin相互作用,引起这两种蛋白向核内转移。而这两种蛋白是在细胞质中行使功能,调控糖原的构建,当糖原构建出现问题产生沉淀时就形成lafora小体。早发型Lafora小体病患者的PRDM8发生突变——c.781T>C(Phe261Leu),导致laforin和malin过度地集中于核内,而细胞质中的含量明显不足,会导致该病的发生[29]。
2.4.2 PRDM8与唐氏综合征唐氏综合征又称21三体综合征,是由于多了一整条或大部分21号染色体引起的。可能的致病机制包括特定剂量敏感基因的过表达、非编码调控元件的失控、非21号染色体基因的异常表达和表观遗传影响等[30]。我们利用DNA甲基化芯片对唐氏综合征患者的甲基化修饰进行研究时发现,唐氏综合征患者的PRDM8甲基化程度明显高于正常对照,并可能对其转录产生影响。神经系统异常引起的智力低下是唐氏综合征患者最主要的症状,部分男性患者还存在生育障碍,这些症状均与PRDM8的生物学功能存在一定关联,两者之间的相关性还需要我们进一步的研究。
3 结语
PRDM蛋白家族的结构特点决定了其行使功能的方式,令人感兴趣的是,尽管PR结构域与SET甲基转移酶结构域类似,但是到目前为止只确认3个成员的PR结构域具有组蛋白甲基转移酶活性,或许其他成员中的PR结构域主要在蛋白结合上发挥重要作用。PRDM8主要在神经系统中表达,其功能主要通过组蛋白甲基转移酶活性或者与其他蛋白相互作用产生。PRDM8蛋白实现时空特异性表达的分子机制及在神经发育和睾丸发育中所起的作用还有待探索,是否还有其他的功能仍需要人们进一步研究与发现。
[1]Fog CK,Galli GG,Lund AH.PRDM proteins:important players in differentiation and disease.Bioessays,2012,34(1):50-60.
[2]Huang S,Shao G,Liu L.The PR domain of the Rb-binding zinc finger protein RIZ1 is a protein binding interface and is related to the SET domain functioning in chromatin-mediated gene expression.J Biol Chem,1998,273(26):15933-15939.
[3]Fumasoni I,Meani N,Rambaldi D,et al.Family expansion and gene rearrangements contributed to the functional specialization of PRDM genes in vertebrates.BMC Evol Biol,2007,7:187.
[4]Di Zazzo E,De Rosa C,Abbondanza C,et al.PRDM proteins:molecular mechanisms in signal transduction and transcriptional regulation.Biology(Basel),2013,2(1):107-141.
[5]Huang S.Histone methyltransferases,diet nutrients and tumour suppressors.Nat Rev Cancer,2002,2(6):469-476.
[6]Alvarez-Venegas R,Avramova Z.SET-domain proteins of the Su(var)3-9,E(z)and trithorax families.Gene,2002,285(1-2):25-37.
[7]XiaoB,Wilson JR,GamblinSJ.SET domainsandhistone methylation.Curr Opin Struct Biol,2003,13(6):699-705.
[8]Derunes C,Briknarova K,Geng L,et al.Characterization of the PR domain of RIZ1 histone methyltransferase.Biochem Biophys Res Commun,2005,333(3):925-934.
[9]Eom GH,Kim K,Kim SM,et al.Histone methyltransferase PRDM8 regulatesmousetestissteroidogenesis.BiochemBiophysRes Commun,2009,388(1):131-136.
[10]Hayashi K,Yoshida K,Matsui Y.A histone H3 methyltransferase controls epigenetic events required for meiotic prophase.Nature,2005,438(7066):374-378.
[11]KinameriE,InoueT,ArugaJ,etal.Prdmproto-oncogene transcription factor family expression and interaction with the Notch-Hes pathway in mouse neurogenesis.PLoS One,2008,3(12):e3859.
[12]Hohenauer T,Moore AW.The Prdm family:expanding roles in stem cells and development.Development,2012,139(13):2267-2282.
[13]Bogani D,Morgan MA,Nelson AC,et al.The PR/SET domain zinc finger protein Prdm4 regulates gene expression in embryonic stem cells but plays a nonessential role in the developing mouse embryo. Mol Cell Biol,2013,33(19):3936-3950.
[14]Briknarová K,Atwater DZ,Glicken JM,et al.The PR/SET domain in PRDM4 is preceded by a zinc knuckle.Proteins,2011,79(7):2341-2345.
[15]Pinheiro I,Margueron R,Shukeir N,et al.Prdm3 and Prdm16 are H3K9me1 methyltransferases required for mammalian heterochromatin integrity.Cell,2012,150(5):948-960.
[16]Buganim Y,Faddah DA,Jaenisch R.Mechanisms and models of somatic cell reprogramming.Nat Rev Genet,2013,14(6):427-439.
[17]Ishibashi J,Firtina Z,Rajakumari S,et al.An Evi1-C/EBPβ complex controls peroxisome proliferator-activated receptor γ2 gene expression to initiate white fat cell differentiation.Mol Cell Biol,2012,32(12):2289-2299.
[18]Chittka A.Differential regulation of SC1/PRDM4 and PRMT5 mediated protein arginine methylation by the nerve growth factor and the epidermal growth factor in PC12 cells.Neurosci Lett,2013,550:87-92.
[19]Galli GG,Carrara M,Francavilla C,et al.Genomic and proteomic analyses of Prdm5 reveal interactions with insulator binding proteins in embryonic stem cells.Mol Cell Biol,2013,33(22):4504-4516.
[20]Eram MS,Bustos SP,Lima-Fernandes E,et al.Trimethylation of histone H3 lysine 36 by human methyltransferase PRDM9 protein. J Biol Chem,2014,289(17):12177-12188.
[21]Yang CM,Shinkai Y.Prdm12 is induced by retinoic acid and exhibits anti-proliferative properties through the cell cycle modulation of P19 embryonic carcinoma cells.Cell Struct Funct,2013,38(2):197-206.
[22]Chang JC,Meredith DM,Mayer PR,et al.Prdm13 mediates the balance of inhibitory and excitatory neurons in somatosensory circuits. Dev Cell,2013,25(2):182-195.
[23]Burton A,Muller J,Tu S,et al.Single-cell profiling of epigenetic modifiers identifies PRDM14 as an inducer of cell fate in the mammalian embryo.Cell Rep,2013,5(3):687-701.
[24]Harms MJ,Ishibashi J,Wang W,et al.Prdm16 is required for the maintenance of brown adipocyte identity and function in adult mice. Cell Metab,2014,19(4):593-604.
[25]Singh S,Ganesh S.Lafora progressive myoclonus epilepsy:a meta-analysis of reported mutations in the first decade following the discovery of the EPM2A and NHLRC1 genes.Hum Mutat,2009,30(5):715-723.
[26]Komai T,Iwanari H,Mochizuki Y,et al.Expression of the mouse PR domain protein Prdm8 in the developing central nervous system.Gene Expr Patterns,2009,9(7):503-514.
[27]Ross SE,McCord AE,Jung C,et al.Bhlhb5 and Prdm8 form a repressor complex involved in neuronal circuit assembly.Neuron,2012,73(2):292-303.
[28]InoueM,KurodaT,Honda A,etal.Prdm8regulatesthe morphological transition at multipolar phase during neocortical development.PLoS One,2014,9(1):e86356.
[29]Turnbull J,Girard JM,Lohi H,et al.Early-onset Lafora body disease. Brain,2012,135(Pt 9):2684-2698.
[30]Dierssen M.Down syndrome:the brain in trisomic mode.Nat Rev Neurosci,2012,13(12):844-858.
10.3969/cmba.j.issn.1673-713X.2015.01.014
上海市科委基础研究重点项目(11JC1411000)
200040上海交通大学附属儿童医院/上海市儿童医院/上海交通大学医学遗传研究所
颜景斌,Email:yanjingbin0130@hotmail.com
2014-04-15
