浅谈药物或医疗器械临床试验过程中的妊娠
2015-11-24张育玮黄艳春薛立明武海波
张育玮,黄艳春,薛立明,武海波
·调查与研究·
浅谈药物或医疗器械临床试验过程中的妊娠
张育玮,黄艳春,薛立明,武海波
按照GCP中的技术要求,临床试验选择的受试者均以自愿为原则,女性受试者应排除妊娠及哺乳期,因此在筛选时均应对孕龄女性进行早孕检测,以确保受试者的安全及试验顺利进行。但由于实际操作缺乏严密性,在试验中出现个别女性受试者妊娠现象,且目前我国没有明确的法律规定及伦理要求,使其处理方式多样化。
目前大多数药物临床试验机构采用检测尿液人绒毛膜促性腺激素(HCG)的方法,但该方法不能定量检测HCG,女性在妊娠8~10 d才能被检测出阳性结果,且个体差异大,部分女性甚至会在末次月经后35~40 d才能检出尿HCG。因此,筛选时单凭化验结果来判断是不足以确认妊娠的,相关的知情及伦理要求不足以成为事件的重要原因。
1 预防措施
1.1 完善妊娠检测方案
相比尿液8~10 d甚至35~40 d才能检出阳性结果,血液HCG的检测更为准确,往往在停经1~2 d就可检出,可以把确诊妊娠的时间提前,能更准确对妊娠做出判断。由于血液HCG检测要比尿液检测费用高许多,可根据受试者的具体情况来判断是否有必要对其进行血液检测。如若受试者确定未发生过性行为或根据其月经周期判断妊娠发生几率极低,可以只在筛选期对其进行尿妊娠检查,若无法判断,可以对其进行血液HCG检查。
有些试验筛选与入组存在时间间隔,为确保在此时间段内不会发生妊娠,建议于入组前对女性进行妊娠检测,或根据具体情况在入组前对其再次进行妊娠检查,若无法确认在这段时间内女性受试者是否发生性行为而具有发生妊娠的可能,则有必要在入组时确定其血液HCG含量。
1.2 全面知情同意
研究者要将试验药物基本信息、试验流程、入排标准、可能会产生的风险完全列入知情同意书并告知受试者,包括对其基本信息的保密、对其权利的保护、由于检测方法的局限而无法100%检出妊娠、妊娠后的危害、生育能力有无影响及采取的相应措施等,并且告知其在接受试验前、中、后的注意事项(如饮食、运动、避孕、服药后多长时间才能发生妊娠或使其配偶妊娠等)及相关规定,研究者必须保证全面知情且使受试者了解、接受这些信息后才能签署知情同意书和开展筛查工作。此外,对于男性受试者知情同意时也应告知在试验期间不得使其配偶妊娠或进行捐精活动。也可印发简单的临床试验注意事项供受试者学习。
1.3 入选前基本情况的询问及保密
在筛选过程中,除基本的病史、家族史的询问外,对于女性受试者年龄、婚姻状况、近期是否发生性行为、月经周期及末次月经时间、是否已有子女或预备妊娠、文化信仰(有些文化信仰认为胎儿比妇女的生命或健康更重要[1])等信息也要详细收集并记录,以确定对其进行血液还是尿液HCG检测,及检查的时间和频次。如:①月经周期是多长?上次月经是什么时间?有无延迟史?延迟多久?②近两个月是否有性生活?如有,是否频繁?大概频率?最后一次是什么时候?是否采取避孕措施?采用何种方式进行避孕?③近期是否有妊娠的计划?是否有子女?根据以上问题,做出判断,如:无性生活或两个月内无性生活,则可以根据尿HCG检测结果判断是否妊娠。若两个月内有性生活(Δt为入组与筛选的时间差),具体可参考图1和图2。
询问以上问题均应单独进行,并由同性别研究人员进行,过程中应注意措辞,解释清楚原因,消除受试者的紧张感,相关记录应保密,其他人员不可随意查看,可将记录收归伦理委员会相关部门,除必要情况不得对任何人公开。
1.4 伦理委员会成立专管部门
在伦理委员会成立专管部门,可负责试验中妊娠的相关监管工作,其职责包括试验方案中女性受试者特殊权利的伦理审查及保护、试验中涉及的相关隐私信息的保管及判断孕妇的参加是否会对胎儿或哺育婴儿造成风险、发生妊娠或意外的处理规程的制定及补偿措施的把控。也可以把妊娠与不良事件的监管统一到一个部门,但需要由专人专项负责,因妊娠受试者人群的特殊性,尽管其处理上与不良事件有很多相似点,但本质不同。
1.5 保险制度
在申办方和研究者达成一致的前提下,可以针对孕龄女性受试者在试验期间妊娠设立专项保险,在伦理机构备案,并对受试者进行知情同意。
1.6 强化医学常识的宣教
研究人员在知情和宣教的过程中充分告知受试者,如涉及药物会对妊娠造成不同程度的伤害,可能会导致流产、胎儿致畸、先天疾病等后果,建议在试验过程中注意采取有效的避孕措施及在试验结束3个月内不要妊娠或使配偶妊娠。但不要使受试者产生所有临床试验的药物或器械都会影响胎儿发育的错误观念,应根据具体药物具体分析。
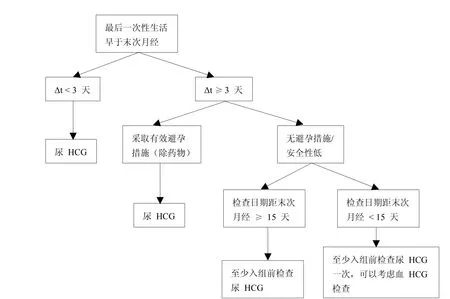
图1 最后一次性生活早于末次月经妊娠筛查参考流程图
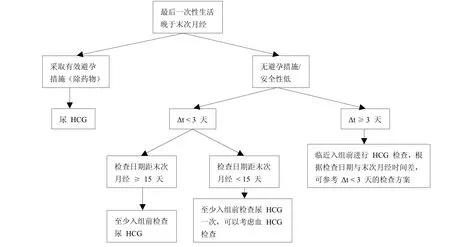
图2 最后一次性生活晚于末次月经妊娠筛查参考流程图
1.7 建立相关规章制度
鉴于女性受试者特殊的生理现象,为保护女性受试者的权益、尊重新生命,相关部门制定相应的临床试验规章制度显得尤为重要。此外,伦理委员会也应在临床试验的操作过程中实施监督,规范研究者或其他试验相关人员的行为,将伤害降至最低[2]。
2 处理
2.1 停药检查
如确认受试者妊娠,首先要立即停药,对其进行全面检查,确定妊娠发生的具体时间、受试者基本状况、试验期间有无合并用药及对妊娠的影响,征求专科医生或专家的意见,确定是否采取相应的救护措施。
2.2 上报妊娠事件
临床研究过程中发生的妊娠,研究者应在获知后的24 h内上报该事件,并注明发生的时间、受试者目前的状况、是否伴有其他不良反应等。上报程序可按照《药物临床试验质量管理规范》中的相关规定进行。
需要说明的是妊娠本身不属于严重不良事件。如在妊娠期间服用药物或在发现妊娠前服用药物,且血药浓度仍保持在有效范围,而对孕妇或胎儿产生的如异位妊娠、流产或致畸等则属于不良事件或严重不良事件,需另行上报。
2.3 是否继续妊娠
是否继续妊娠的决定要在道德、正义、自愿的前提下进行,充分保护受试者利益[2]。
2.3.1 终止妊娠若已知试验药物具有明显的妊娠毒性而必须要终止妊娠,或受试者自身要求终止妊娠,或为异位妊娠,请专科医生判断其身体状况是否适合进行人工流产,若允许,在手术进行前,申办方、研究者应与受试者达成书面协议,阐明三方均自愿签署协议、手术存在的风险、术后的随访及相应的补偿措施。询问受试者是否为首次妊娠、是否曾经发生流产(人工或意外)及其次数、是否有子女(可由筛选时信息获得)、以后是否打算妊娠等信息,并根据受试者具体情况对其进行补偿,但是补偿额度不应过大,避免诱使他们过度冒险、或不考虑自己的实际情况而自愿参加,使知情同意无效。所有提供给受试者的报酬、补偿和医疗服务都必须得到伦理审查委员会的批准[3]。
2.3.2 继续妊娠首先要与受试者达成书面协议,阐明申办方对受试者给予相应的补偿,在妊娠期间每三个月跟踪随访一次,做相应的随访记录,记录妊娠时间、孕妇生命体征、各项检测指标值、有无其他不适及胎儿状况,受试者和随访人员签字确认。胎儿出生后检测是否存在药物导致的先天疾病或畸形(家族遗传除外),可在婴儿2、6、12和24个月进行随访[4],分别检测其体格发育情况,可采用“Gesell婴幼儿智能发育阶段初步检查表”测量其DQ(发育商,即智龄)[5]。经医生判断受试者和婴儿健康状况良好后可结束随访。若在妊娠期间发生意外流产且可能与药物相关,应及时申报严重不良事件。
3 风险等级
可根据具体情况分级处理妊娠事件,按照等级做出相应的赔偿,统一标准,使处理过程有据可循。评判可参考表1。

表1 风险等级表
4 小结
加强临床试验妊娠管理,目的不是给受试者造成药物试验会危害妊娠、影响生育的印象,而是强调应一直采取预防危害的措施,这是对受试者权益和安全及对未来生命的保护,也是对研究者和申办方的保护。只有保障了受试者的权益,保障了研究人员操作的流畅性,临床试验才能得到最真实、最可靠的结果,才能为大众提供更多的放心药。
[1]Liu SL,Wang XQ,Xiong NN,et al.Ethic review in clinical research:women and pregnant women.Chin J Clin Pharmacol Ther,2006,11(4):477-480.(in Chinese)
刘沈林,汪秀琴,熊宁宁,等.临床试验的伦理审查:妇女和孕妇.中国临床药理学与治疗学,2006,11(4):477-480.
[2]Allesee L,Gallagher CM.Pregnancy and protection:the ethics of limiting a pregnant woman's participation in clinical trials.J Clin Res Bioeth,2011,2(108):1000108.
[3]Wang XQ,Xiong NN,Liu SL,et al.Ethic review in clinical research:subjects recruitment.Chin J Clin Pharmacol Ther,2004,9(11):1313-1316.(in Chinese)
汪秀琴,熊宁宁,刘沈林,等.临床试验的伦理审查:招募受试者.中国临床药理学与治疗学,2004,9(11):1313-1316.
[4]Mei XX.The effect of early intervention on growth and development of premature infants.J Practical Med Tech,2008,15(35):134-135.(in Chinese)
梅晓霞.早期干预对早产儿生长发育的效果观察.实用医技杂志,2008,15(35):134-135.
[5]Wang Q.To discuss issues related to the guiding principle of clinical research on traditional Chinese medicine in the treatment of male infertility.Sexology,1999,8(2):27-30.(in Chinese)
王琦.对《中药治疗男性不育的临床研究指导原则》有关问题的商讨.性学,1999,8(2):27-30.
10.3969/cmba.j.issn.1673-713X.2015.01.018
100005北京精诚泰和医药信息咨询有限公司(张育玮、黄艳春、武海波);100050北京,中国医学科学院药物研究所科技开发处(薛立明)
武海波,Email:wuhaibo@giantcro.com
2014-11-16
