番木瓜脂肪酶的应用进展
2015-11-23辛嘉英孙立瑞
谢 龙,辛嘉英,2*,王 艳,孙立瑞
(1.哈尔滨商业大学食品科学与工程重点实验室,黑龙江哈尔滨150076;
2.中国科学院兰州化学物理研究所羰基合成与选择氧化国家重点实验室,甘肃兰州730000)
番木瓜脂肪酶的应用进展
谢 龙1,辛嘉英1,2*,王 艳1,孙立瑞1
(1.哈尔滨商业大学食品科学与工程重点实验室,黑龙江哈尔滨150076;
2.中国科学院兰州化学物理研究所羰基合成与选择氧化国家重点实验室,甘肃兰州730000)
介绍了番木瓜脂肪酶(CPL)的来源及应用。CPL作为一个与木瓜中的水不溶部分紧密结合的自固定化脂肪水解酶,应用前景非常广泛:能够催化脂肪酸和油酸;催化酸与醇的酯化,醇与酯的酯交换反应;催化2-芳基丙酸类药物的酶促拆分;及在其他方面的应用。
番木瓜脂肪酶;植物脂肪酶;生物催化;选择性;酯合成
脂肪酶,又称三酰基甘油酰基水解酶,是指分解或合成高级脂肪酸和丙三醇形成的甘油三酸酯脂键的酶,一般情况下脂肪酶都具有很好的水解酯酶底物短链甘油酯的能力。脂肪酶来源广泛,不仅仅在动植物中存在,在微生物中也广泛存在,目前,在实验室中常用的动物脂肪酶一般是经过冷冻干燥的猪胰脂肪酶,成本高,且提取工艺复杂。因此,微生物是脂肪酶的主要来源,产酶的菌株主要有曲霉、根霉、青霉、南极念珠菌(脂肪酶B)[1]、脂肪酶A[2]、皱褶念珠菌[3,4]等。对于脂肪酶的研究大多集中在微生物脂肪酶中。近年来,由于植物脂肪酶具有易于分离纯化,原材料来源充足,在价格上更具有竟争优势等特点,植物来源的脂肪酶也受到了越来越多的关注[5,6]。目前,针对植物脂肪酶研究较多的是来源于大戟科萝蘑科木瓜科植物中的脂肪酶。木瓜未成熟的果实里含有丰富的乳白色番木瓜汁,其中15%的干物中含有多种水解酶,主要是蛋白酶[7]。根据木瓜树年龄和性别的不同,干物中蛋白质成分也不同。由于木瓜乳液里含有多种酶,所以CPL得纯化非常难。目前,在工业中使用的是一种天然混合物。从1935年到1990年,对CPL的报道已经很多,随着三硝酸甘油酯广泛用于酶底物,这种具有较强的界面活性的水解酶才引起人们的关注。CPL天然状态下紧密结合于木瓜乳汁中不溶于水的类似于纤维的未知物质上,呈天然固定化状态,因此,迄今为止关于CPL纯化的所有努力均以失败告终,但这并不妨碍其在酶催化领域的应用[8]。CPL的活性是独立的,并不依靠木瓜胶乳中的蛋白酶[9],但对于它的一些天然作用还不清楚[10]。到目前为止,也没有实验对于CPL的一些生物化学特征进行说明。尽管CPL的纯化很困难,但在最近几年里,以天然的商品化CPL或半纯化的CPL作为催化剂在生物技术上的应用的报道已有很多。
1 CPL催化脂肪酸和油酸
利用CPL在位置上的立体选择性可以对油脂和脂肪酸进行修饰。低热量的三酰基丙三醇(TAGs)的合成就是利用CPL的这种立体选择性,TAGs是由短链和长链的酰基残基结合成的,最常见的低热量脂肪酸是SalatrimTM,与天然的脂肪酸相比,它的热量很低,也为酯交换提供了一个可行的方法。此外,Gandhi等研究了在CPL催化丙三醇三棕榈酸酯的反应中,对不同脂肪酸乙酯的选择性[11,12]。发现当使用脂肪酸乙酯作为供体时,可以提高CPL对中长链衍生物的选择性,也有助于获得自由脂肪酸。Carla Tecelao等利用低成本的番木瓜乳胶催化合成人乳脂肪替代物。这个实验的目的是使用固定在番木瓜乳胶上的CPL作为一种低成本的商业脂肪酶来催化合成人乳脂肪替代物,并评价其催化效果。实验中使用了两种不同的木瓜脂肪酶,一种是从木瓜果实(CPLI)中提取的,另一种是从木瓜树的叶柄(CPLII)中提取的。使用这两种脂肪酶来催化三棕榈酸甘油酯和油酸的酸解反应,在60℃无溶剂体系中分批次反应24h,使用了CPL I的油酸的转化率更高,所以对该酶做进一步研究。建模反应条件:底物摩尔比为n油酸∶n三棕榈酸甘油酯=1.2~6.8∶1,温度在58~72℃之间,结果随摩尔比的增加,酰基转移率降低。在60℃下进行稳定性试验,采用的摩尔比为2∶1和6∶1,得到稳定性较高的摩尔比是2∶1[13]。ErzhengSu等利用低成本的固定化CPL催化合成脂肪酸正丁酯,发现CPL对不同的醇酰基受体的选择性不同。在CPL催化脂肪酸正丁酯的合成实验中,最优条件下反应24h,转换率可以达到96%。在最优条件下使用CPL催化其他植物油,得到的转化率都非常高。进一步将CPL用于填充床反应器中,可连续运行150h以上。这些结果表明,低成本的CPL可以作为生物柴油生产的催化剂[14]。
使用番木瓜脂肪酶和甲醇可以催化分解鱼油来生产生物柴油燃料。P.Pinyaphong等从鱼的废弃部分提取精制的鱼油,使用CPL催化其分解,其产物用作于生产生物柴油的原料。在该实验中考察了脂肪酶用量、甲醇用量、油的摩尔比、初始水活度、温度和溶剂的种类等对CPL催化能力的影响。实验得到当油和甲醇的摩尔比为1∶4,酶量为20%(基于油),初始水活度为0.23和叔丁醇为20%(基于油)时,40℃反应18h后甲酯达到最大产率,最大产率为83%。重复使用30个循环后,损失的脂肪酶活性较少,可以忽略不计[15]。这方面的应用涵盖领域较为广泛,如有机物的改性、酯化、酯交换、酯合成、不同手性酸或醇的不对称拆分[15-17]。因为CPL是自然非水溶性的,可以被看作是一种“自然固定化”的脂肪酶,所以相比微生物脂肪酶和动物脂肪酶CPL有几个优点,如[18]在有机溶剂中有较稳定的pH值和热稳定性,;可回收和再利用;不需要界面活化剂激活活性中心;在不同的生物化学反应中具有较高的通用性、区域选择性、立体选择性和酶作用物的选择性;可以持续从未成熟果实中收集。所有的优点说明低成本的CPL具有非常好的发展前景。
2 CPL催化转酯化拆分芳香仲醇及合成萜烯醇芳香酯
一些研究表明,CPL可以催化多种酰基供体和醇。苏二正等将CPL用于手性拆分芳香仲醇,以4-苯基-2-丁醇作为模式底物,考察了反应温度、反应溶剂、酰基供体以及底物摩尔比对CPL拆分能力的影响[19]。结果表明,当使用活性乙烯酯为酰基供体,正己烷或环己烷作为反应溶剂,底物/酰基供体摩尔比为1∶2时,在30~45℃下底物的转化率接近50%,底物对映体过量值e.es大于99%,反应的对映体比值E大于200。CPL对其他结构类似的芳香仲醇也具有很好的拆分能力。该研究为手性芳香仲醇的酶催化制备提供了新的催化剂选择。
为建立经济绿色高效的萜烯醇芳香酯合成工艺,以木瓜蛋白酶粗品为原料制备获得了天然固定化木瓜脂肪酶(CPL),苏二正等研究了CPL在非水相体系中催化合成萜烯醇芳香酯的效果,探讨了在有机溶剂体系中萜烯醇种类、有机溶剂种类以及初始水分活度对反应的影响[20]。结果表明:伯醇类萜烯醇(香茅醇和香叶醇)是较适宜的底物,中等极性的有机溶剂如正己烷为适宜的反应溶剂,0.328的初始水分活度有利于CPL发挥催化活性,此时转化率为95.2%,与商业脂肪酶催化效果相当CPL在有机溶剂中重复使用性较差,考察了不同离子液体处理方法对CPL催化性能的影响,结果表明,使用微量离子液体对CPL进行包裹前处理可以显著地提高CPL的重复使用性,反应15次后,催化活性仍保留90%以上。
3 CPL催化2-芳基丙酸类药物的酶促拆分
对于脂肪酶介导的非甾体抗菌药异构体拆分已有报道[21]。光学纯药物在治疗方面的应用是制药行业非常有吸引力的。事实上,纯对映体相比外消旋药物具有高特异性和生物活性,使用它们也可以避免产生相关的潜在副作用。手性药物的不同对映体具有不同药理特性,因此,制备单一构型对映体药物对提高药效,减少毒副作用具有重要意义。通过利用酶对外消旋药物进行手性拆分,是目前制备手性药物比较常见同时也比较经济的一种方法。利用对一类重要的外消旋药物,同时也是脂肪酶拆分反应中常见的一类重要化合物,布洛芬类非甾体抗炎药进行了手性拆分。通过改变底物布洛芬酯的醇部分的电荷性质,将布洛芬乙酯替换为布洛芬三氟乙酯,反应转化率由40%提高到45%,E值由12提高到了14。对非甾体抗炎药物布洛芬类化合物均有一定的拆分效果,其中对萘普生的拆分效果最好。经过30h反应转化率达到49%,反应的E值为173,对一系列化合物的拆分结果表明位上空间位阻较大的底物比空间位阻小的化合物具有更好的拆分效果[22]。以CPL为催化剂,利用环己烷酯化对(R,S)-2-(4-氯氧基)-丙酸消旋体拆分,在最适宜的反应条件下,其E值为113(见图1,a)。对氯氧基的衍生物的研究表明,在非甾体抗菌药的消旋体拆分中,代表反应是(R,S)-甲氧萘丙酸三氟乙酯与硫酯的反应[23,24]。Ng等[25]对该反应进行了热力学模型和动力学模型的研究。在最优的反应条件下,其E值为122(见图1,b)[22]。现在可以利用CPL拆分消旋体洛芬分子[25],CPL若能被进一步纯化,则能产生更好的活性和对映选择性。人们还研究了CPL来源对活性的影响[26],除了皱褶念珠菌脂肪酶,大部分脂肪酶对羧酸的对映选择性较差,但皱褶念珠菌脂肪酶在极性有机溶剂和高温的条件下,活性会受到抑制[27]。在番木瓜胶乳中,除了众所周知的木瓜蛋白酶,脂解活性是另一个有趣的酶活性存在。脂解活性强烈附着到胶乳固相上,从而产生自然固定的生物催化剂。番木瓜脂肪酶对前药(R,S)-2-溴苯基乙酸辛酯呈现高对映选择性。Ivanna Rivera等描述了用番木瓜粗胶乳和纯化胶乳对(R,S)-2-溴苯基乙酸辛酯的动力学拆分[28]。对底物浓度和溶剂的影响都进行了研究。最好的结果是用50mM底物和50mg·mL-1酶,癸烷作为溶剂;在这些条件下,用粗胶乳获得一个高对映选择性(E>200)。采用初始速率保持在E>200纯组分无蛋白酶和酯酶的CPL进行反应,也没有得到两倍的效果。根据有史以来研究,番木瓜胶乳脂酶是具有最高对映选择性野生型酶。
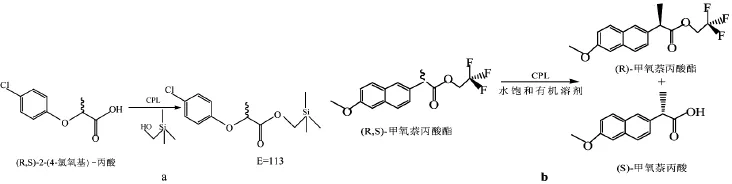
图1 手性酸的消旋体拆分Fig.1 Racemic separation of chiral acids
4 其他
4.1 CPL催化拆分beta-氨基酸及其在达泊西汀生物法合成中的应用
在非水相有机溶剂正己烷中拆分另一类重要的化合物氨基酸。分别对这一类氨基酸中两种具有代表性的氨基酸:芳香族氨基酸β-苯丙氨酸和脂肪族氨基酸丙氨酸进行了拆分。实验发现CPL对N-Ac-β-苯丙氨酸甲酯的对映体选择性不高,E为14。我们从底物工程的角度考虑如何提高CPL对底物的对映体选择性,以及底物结构对CPL拆分效果的影响。将酯基团替换为三氟乙基,CPL对S型底物的反应速率明显提高,相比底物N-Ac-β-苯丙氨酸甲酯,其反应速率提高了400倍以上,而对R型的反应速率仅提高了20几倍,反应的对映体选择性也得到了较大的提高。E值达到230[29]。
4.2 长链醚作为溶剂可提高番木瓜脂肪酶催化2-(取代的苯氧基)丙酸酯的酯交换的对映选择性
Toshifumi Miyazawa等通过研究使用长链醚作为溶剂,CPL催化2-(取代的苯氧基)丙酸与2,2,2-三氟乙基酯的酯交换反应,当用二正己基醚代替常规二异丙醚作为溶剂[30]时,对映体选择性有很大的提高,在同样的反应条件下,CPL(10mg)催化2,2,2-三氟乙基酯(RS)-2-苯氧丙酸(0.1mmol)与甲醇(0.4mmol)的酯交换反应,E值从21[二异丙醚(0.8mL)]提高至57[二正己基醚(0.8mL)];催化2,2,2-三氟乙基(RS)-2-(2-氯苯氧基)丙酸乙酯和甲醇的酯交换反应,E值从13(二异丙醚)提高至44(二正己基醚)。
5 结果与展望
最近几年,CPL作为一种新型、多用途的生物催化剂,得到了大量应用。目前,在油酸和脂肪酸的修饰,有机相的转酯化,芳香酯的合成,重要手性化合物的拆分方面,都取得了非常好的效果,扩展了其应用领域。不仅表明CPL具有优良的催化性能,同时说明木瓜源酶类具有较高的开发价值,作为植物来源的酶,经过一些简单的物理过程就可以纯化,没有化学溶剂的污染,相比微生物来源的酶,其更适宜用于食品、香精香料、化妆品等行业,相比其他来源脂肪酶,植物脂肪酶具有不同的酶学性质。综上所述,木瓜脂肪酶具有很好的应用前景。
[1]Kirk O,Christensen MW.Lipases from candida antarctica:unique biocatalysts from aunique origin[J].Org.Process Res.Dev.,2002,(6):446-451.
[2]de DomnguezMP,Carboni-Oerlemans C,Tuin B,et al.Biotechnological applications of Candida antarctica lipase A:state of the art[J].J Mol Catal BEnzym,2005,37:36-46.
[3]Caro Y,Pina M,Turon F,et al.Plant lipases:Biocatalyst aqueous environment in relation to optimal catalytic activity in lipase catalyzed synthesis reactions[J].Biotechnology and Bioengineering, 2002,77(6):693-703.
[4]Villeneuve P.Plant lipases and their applications in oils and fats modification[J].European Journal of Lipid Science and Technology,2003,105(6):308-317.
[5]Palocci C,Soro S,Cernia E,et al.Lipolytic isoenzymes from euphorbia latex[J].Plant Sci.,2003,165:577-582.
[6]Villeneuve P,Turon F,Caro Y,et al.Lipase-catalyzed synthesis of canola phytosterols oleate esters as cholesterol low ering agents[J]. Enzyme Microb Technol,2005,37:150-155.
[7]Azarkan M,El Moussaoui A,van Wuytswinkel D,et al.Fractionantion and purification ofthe enzymes stored in the latexof Carica papaya[J].J Chromatogr B,2003,790:229-238.
[8]Domnguezde Mara P,Sinisterra J V,Tsai S W,et al.Carica papaya lipase(CPL):An emerging and versatile biocatalyst[J].BiotechnologyAdvances,2006,24(5):493-499.
[9]Caro Y,Pina M,Turon F,et al.Plant lipases:biocatalyst aqueous environment in relation to optimal catalytic activity in lipase-catalyzedsynthesisreactions[J].BiotechnolBioeng,2002,77:693-703.
[10]El Moussaoui A,Nijs M,Paul C,et al.Revisiting the enzymes stored in the laticifers ofCarica papaya in the context of their possible participation in the plant defence mechanism[J].Cell Mol Life Sci,2001,58:556-570.
[11]Villeneuve P,Pina M,Montet D,et al.Carica papaya latex lipase: sn-3 stereoselectivity or short-chain selectivity model chiral triglycerides are removing the ambiguity[J].J.Am.Oil.Chem.Soc.,1995,72:753-755.
[12]Gandhi N N,Mukherjee K D.Reactivity of mediumchain substrates in the interesterification of tripalmitin catalyzed by papaya lipase[J].J.Am.Oil.Chem.Soc.,2001,78:965-968.
[13]Carla Tecelao,Ivanna Rivera,Georgina Sandoval and Suzana Ferreira-Dias.Carica papaya latex:A low-cost biocatalyst for human milk fat substitutes production[J].Eur.J.Lipid Sci.Technol,2012, 114:266-276.
[14]Erzheng Su and Dongzhi Wei.Production of Fatty Acid Butyl Esters Using the LowCost Naturally Immobilized Carica papaya Lipase[J].Journal of agricultural and food chemistry,2014,62:6375-638.
[15]P.Pinyaphong,P.Sriburi and S.Phutrakul Biodiesel fuel production by methanolysis of fish oil derived from the discarded parts of fish catalyzed byCarica papaya Lipase[J].World AcademyofScience,Engineeringand Technology.2011,52.
[16]Domínguez de María P,Sánchez-Montero JM,Sinisterra JV, Alcántara AR.UnderstandingCandida rugosalipases:an overview. BiotechnolAdv.,2006,24:180-96.
[17]Chen,H.M.Wang,P.Y.Tsai,S.W.Carica papaya lipase catalyzed transesterification resolution of secondary alcohols in organic solvents.J.Taiwan Inst.Chem.Eng.,2009,40,549-554.
[18]Gonzalo,C.A.;Ricardo,T.M.Recent advances and applications of the lipolytic activity of Carica papaya latex.J.Mol.Catal.B:Enzym.2013,90:49-60.
[19]苏二正,尤鹏永,魏东芝.天然固定化木瓜脂肪酶催化芳香仲醇动力学拆分[J].精细化工,2014,(9):1075-1079+1168.
[20]苏二正,尤鹏永,魏东芝.非水相体系中木瓜脂肪酶催化合成萜烯醇芳香酯的研究[J].林产化学与工业,2015,(1):45-50.
[21]Cheng Y,Tsai S W.Enantioselective esterification of(R,S)-2-(4-chloro phenoxy)-propionic acid via Carica papaya lipase in organicsolvents[J].Tetrahedron:Asymmetry,2004,15:2917-2920.
[22]尤朋永,邱健,蔡雯雯.木瓜脂肪酶催化洛芬类药物的酶促拆分[J].华东理工大学学报(自然科学版),2012,(6):687-693.
[23]Chun C C,Shau-Wei Tsai.Carica papaya lipase:a novel biocatalystfortheenantioselectivehydrolysisof(R,S)-naproxen 2,2,2-trifluoroethyl ester[J].Enzyme and Microbial Technology, 2005,36:127-132.
[24]Chen C C,Tsai S W,Villeneuve P.Enantioselective hydrolysis of(R,S)-naproxen 2,2,2-trifluoroethyl ester in water-saturated solvents via lipases from Carica pent agona heilborn and carica papaya[J].J.Mol.Catal.B.Enzym,2005,34:51-57.
[25]Ng I,Tsai S W.Partially purified carica papaya lipase:a versatile biocatalyst for the hydrolytic resolution of(R,S)-2-arylpropionicthioesters in water-saturated or ganic solvents[J].Biotechnol Bioeng,2005,91:106-113.[26]NgI,Tsai S W.Investigation of lipases from various Carica papaya varieties for hydrolysis ofolive oil and kinetic resolution of(R,S)-profen2,2,2-trifluoroethylthioesters[J].ProcessBiochem,2006, 41:540-546.
[27]赵帅,刘均洪,刘海洲.番木瓜脂肪酶的应用前景[J].化学工业与工程技术,2007,(6):47-49.
[28]Ivanna Rivera,Juan Carlos Mateos,Alain Marty,Georgina Sandoval,Sophie Duquesne.Lipase fromCarica papaya latex presents high enantioselectivity toward the resolution of prodrug(R,S)-2-bromophenylacetic acid octyl ester[J].Tetrahedron Letters 2013,54:5523-5526.
[29]尤朋永.木瓜脂肪酶的制备、性质及应用研究[D].华东理工大学,2012.
[30]Toshifumi Miyazawa,Wakana Iguchi.Long-chain ethers as solvents can amplify the enantioselectivity of the Carica papaya lipase-catalyzed transesterification of 2-(substituted phenoxy)propanoic acid esters[J].Biotechnol Lett,2013,35:1639-1643.
Application progress of carica papaya lipase
XIE Long1,XIN Jia-ying1,2*,WANG Yan1,SUN Li-rui1
(1.Key Laboratory for Food Science and Engineering,Harbin University of Commerce,Harbin 150076,China;2.State Key Laboratory for Oxo Synthesis and Selective Oxidation,Lanzhou Institute of Chemical Physics,Chinese Academy of Sciences, Lanzhou 730000,China)
Carica papaya lipase(CPL)is attracting more and more interest.This hydrolase,being tightly bonded to the water-insoluble fraction of crude papain,is thus considered as a“naturally immobilized”biocatalyst. Several applications have already been described:Capable of catalyzing fatty acid and oleic acid;Catalyzed esterification of acids and alcohols,alcohol and ester exchange reaction;Catalyze enzymatic resolution 2-aryl-propionic acid drugs;Applications in other areas.
carica papaya lipase;plant lipases;biocatalysis;selectivity;ester synthesis
Q556
A
10.16247/j.cnki.23-1171/tq.20151141
2015-09-06
谢龙(1989-),男,大庆人,哈尔滨商业大学硕士研究生,研究方向:农产品加工。
导师简介:辛嘉英(1966-),男,博士,龙江学者特聘教授,博士生导师。
