猪清道夫受体SRA/CD204多克隆抗体的制备以及该受体介导的细菌吞噬功能分析
2015-11-23黎倩倩张彦兵魏建超齐鹏飞石元元陆莹梅邵东华李蓓蓓马志永孙延鸣邱亚峰
黎倩倩,张彦兵,相 笑,魏建超,齐鹏飞,石元元,陆莹梅,夏 鹏,刘 珂,邵东华,李蓓蓓,马志永,孙延鸣,邱亚峰
(1. 石河子大学动物科技学院,石河子 832003;2. 中国农业科学院上海兽医研究所,上海 200241)
·研究论文·
猪清道夫受体SRA/CD204多克隆抗体的制备以及该受体介导的细菌吞噬功能分析
黎倩倩1,2,张彦兵1,2,相 笑2,魏建超2,齐鹏飞2,石元元2,陆莹梅2,夏 鹏2,刘 珂2,邵东华2,李蓓蓓2,马志永2,孙延鸣1,邱亚峰2
(1. 石河子大学动物科技学院,石河子 832003;2. 中国农业科学院上海兽医研究所,上海 200241)
针对猪SRA/CD204胞外区对应的基因片段(614~1324 bp)进行引物设计,PCR扩增获得目的片段并克隆至原核表达载体 pET-28a中,构建重组表达质粒pET-SRA-c。利用原核表达系统获得高效表达于包涵体中的重组蛋白rSRA-c(约32 kDa),利用亲和层析技术获得纯化的rSRA-c。利用纯化的rSRA-c为免疫原,免疫Balb/c小鼠(100 μg/小鼠),制备多抗血清。经Western blot结果显示,该多抗血清不仅可以识别rSRA-c,而且可以识别真核表达的全长的猪SRA/CD204(约55 kDa)。免疫荧光分析表明该多抗血清可以清楚地识别表达于CHO细胞膜上的SRA/CD204。最后,利用表达猪SRA/CD204的CHO细胞,对其介导的细菌吞噬功能进行了研究,结果表明猪SRA/CD204可以有效地介导大肠杆菌和金黄色葡萄球菌的吞噬。本研究为进一步研究猪SRA/CD204在病原微生物感染中的作用奠定了基础。
清道夫受体;重组蛋白;多克隆抗体;细菌;吞噬
清道夫受体(scavenger receptors,SRs)由于可介导乙酰化的低密度脂蛋白(Ac-LDL)的吞噬和降解,而被首次发现。研究表明SRs在动脉粥样硬化、阿尔兹海默氏症、骨代谢、肺损伤、炎症、先天性免疫、宿主防御等多方面也起着重要的作用[1]。SRs现已成为重要的先天性免疫受体,在维护生理平衡和疾病发生的过程中起着重要的作用。
根据分子结构和功能的不同,清道夫受体家族可以分为A-H八个亚类[2]。其中,A类清道夫受体最先被鉴定,其功能也研究的最为深入[3]。A类清道夫受体共有5类成员,均为含有同源三聚体结构的跨膜蛋白。其中,巨噬细胞清道夫受体A(SRA),又名CD204,是最早被克隆鉴定的。自然情况下,SRA以3种形式存在:SRA-I、SRA-II以及SRA-III,他们是同一基因的不同剪接体(alternatively spliced variants)。现有研究显示,在哺乳动物中,主要以SRA-I/II两种功能形式存在,因此,有关SRA的报道基本上是关于SRA-I/II[4]。SRA/CD204作为巨噬细胞清道夫受体,主要表达于巨噬细胞和树突状细胞,有研究表明,SRA/CD204也在内皮细胞[5]、肺上皮细胞[6]、原代的鼠成纤维细胞中表达[7]。迄今为止,SRA/ CD204是研究最为深入的清道夫受体分子,它不仅参与脂代谢,在动脉粥样硬化、脑中风、败血症、病原微生物感染等中也起着重要的作用。但是,到目前为止,由于受到抗体等限制,猪SRA/CD204分子的功能还鲜有报道。
本研究利用原核表达系统成功表达了猪SRA/ CD204胞外区部分,并利用纯化的重组蛋白为免疫原,成功制备了可以识别猪SRA/CD204的多克隆抗体,并用表达猪SRA/CD204的CHO细胞,对其介导的细菌吞噬功能进行了初步研究。
1 材料与方法
1.1 材料 原核表达载体 pET-28a和真核表载体pcDNA3.0由本实验室保存;各种限制核酸内切酶购自Fermentas公司;DNA Marker购自北京天根生物公司;大肠杆菌感受态DH5α和大肠杆菌感受态BL21(DE3)细胞购自生工生物工程(上海)股份有限公司;镍离子亲和柱购自美国BIO-RAD生命医学产品有限公司;氨苄霉素、卡那霉素、IPTG、蛋白预染Marker、抗His标签鼠源单抗、辣根过氧化物酶(HRP)标记的羊抗鼠二抗购自Sigma公司;Lipofectamine 2000和荧光二抗购自购自赛默飞世尔科技(中国)有限公司;小提质粒试剂盒、大提质粒试剂盒、DNA胶回收试剂盒均购置于Axygen公司;CHO细胞购于中科院细胞库。
1.2 方法
1.2.1 猪SRA/CD204基因的克隆 根据GenBank登录的序列(登录号:NM_001243874)设计引物(序列见表1),以猪肺提取的RNA反转录成的cDNA为模板,进行PCR扩增。反应条件:95℃预变性 5 min;95℃变性30 s,55℃退火45 s,72℃延伸30 s,共35个循环;72℃再延伸10 min,4℃保存。将产物经1%的琼脂糖凝胶电泳进行鉴定后,切胶回收后连接至T载体,将重组质粒送生物公司进行测序。
1.2.2 抗体制备
1.2.2.1 原核表达载体构建 以pMD18-T-SRA/CD204wt为模板,用特异性引物Pet-SRA-Forward和Pet-SRA-Reverse(序列见表1),扩增获取胞外区部分基因片段,PCR产物用DNA胶回收试剂盒回收,将胶回收产物和载体pET-28a利用Sac I和Xho I双酶切,分别利用DNA纯化回收试剂盒回收SRA-c和pET-28a的酶切产物,16℃连接过夜。将连接产物转化至感受态DH5α中,涂在含有卡纳霉素的LB固体培养基上,37℃恒温培养12~18 h。挑取单克隆菌落,置于含有卡那霉素的LB液体培养基(50 μg/mL)中,5~8 h后提取质粒并进行酶切鉴定,将产物进行1%的琼脂糖凝胶电泳,把鉴定阳性的重组原核表达质粒送生物公司进行测序验证。
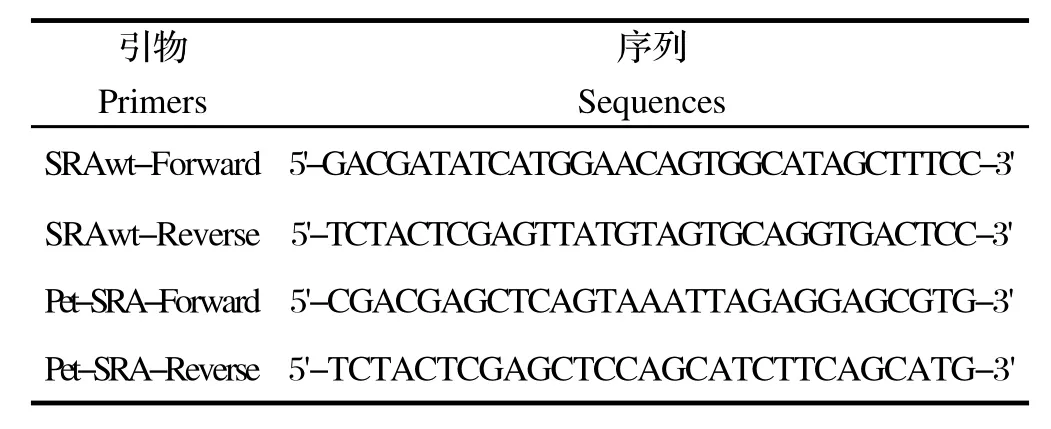
表1 PCR扩增所用引物序列Table 1 The primers in this study
1.2.2.2 重组蛋白的诱导表达鉴定 将测序结果无误的重组质粒pET-rSRA-c转染至感受态细胞BL21(DE3)中,对其诱导条件及温度进行优化后,最终确定最佳条件:37℃振荡培养至OD600为0.4~0.6时,加入终浓度为1 mmol/L的IPTG,常温诱导过夜。诱导后离心收集菌体,用1×binding buffer悬浮于冰上超声破碎处理,超声后的菌体,4℃、12 000×g 离心25 min。收集上清,用5×SDS buffer沸水浴5~10 min制样;沉淀用含有6 mol/L 尿素的Binding buffer充分溶解,4℃放置过夜并制样(同上清)。分别取上清和沉淀样品,进行SDS-PAGE电泳。
1.2.2.3 蛋白的纯化及小鼠免疫 将诱导表达的蛋白进行纯化,具体操作步骤按照His-tag亲和层析纯化说明书进行,纯化的蛋白进行透析后测定其蛋白浓度。蛋白乳化后按照每只小鼠100 μg的剂量进行皮下多点免疫,每14 d 免疫1次,共免疫5次,第5次免疫后7 d 进行采血,获取多抗血清。
1.2.2.4 Western blot检测重组蛋白的表达 重组蛋白SDS-PAGE电泳后,转印于硝酸纤维素膜。室温封闭2 h或4℃封闭过夜,TBST洗涤3次;加入的一抗分别为抗His标签鼠源单克隆抗体(稀释度为1∶5000)以及制备的鼠多克隆抗体(稀释度为1∶1000),4℃孵育过夜,TBST洗膜3次;加入辣根过氧化物酶(HRP)标记的羊抗鼠二抗,稀释度为1∶10 000,室温孵育2 h后,显色。
1.2.3 真核表达质粒构建,转染及鉴定
1.2.3.1 真核表达质粒的构建 将克隆的基因以及真核表达载体pcDNA3.0经EcoR V和Xho I双酶切,使用胶回收试剂盒回收,16℃连接过夜。将连接产物转化至感受态DH5α中,加入800 LB液体培养基摇菌,40~60 min后将摇好的细菌涂在含有氨苄青霉素的LB固体培养基上,37℃恒温培养12~18 h。挑取单克隆菌落于含有一定量氨苄青霉素的LB中(100 μg/ mL)摇菌5~8 h,提取质粒并对质粒进行酶切鉴定,将酶切产物进行1%的琼脂糖凝胶电泳,把阳性重组表达质粒送生物公司进行测序验证。
1.2.3.2 细胞转染 当细胞长到70%~80%时,根据Lipofectamine 2000的说明书,将真核载体pcDNA3.0和pcDNA-SRA/CD204wt瞬时转染入CHO细胞,转染后24 h后进行细胞样品的制备,用于后续的实验。
1.2.3.3 Western blot 检测 转染24 h后,分别收取转染了pcDNA-SRA/CD204wt及pcDNA3.0细胞样品,制备蛋白样品,置于-20℃保存,用于Western blot。
1.2.3.4 间接免疫荧光检测(indirect immunofluorescence assay,IFA) 按照上述1.2.3.2的方法进行细胞转染,24 h后,利用4%的多聚甲醛对细胞进行固定,用于间接免疫荧光分析。
1.2.4 猪SRA/CD204介导的细菌吞噬功能分析 按照上述1.2.3.2的方法进行细胞转染,获得瞬时转染的细胞样品,分别为:CHO-vector和CHO-SRA/ CD204wt,将FITC标记的大肠杆菌和金黄色葡萄球菌,分别以100∶1(细菌:细胞)接种转染的细胞样品,37℃孵育2 h,PBS洗涤2遍,加入台盼蓝(250 μg/mL)作用1min,然后进行荧光强度分析,每组实验重复3~5次,并进行差异分析。
2 结果
2.1 全长猪SRA/CD204编码基因的克隆及测序分析利用猪肺组织,提取总RNA,反转录成cDNA作为模板,利用RT-PCR方法,扩增全长猪SRA/CD204编码基因(1341 bp),电泳结果显示,在约1300 bp处出现特异的条带,与预期的结果一致(图1A)。随后,将纯化回收的PCR产物,克隆至pMD18-T载体中构建pMD18-T-SRAwt,经PCR鉴定阳性的克隆送上海桑尼生物公司进行测序,测序结果显示与GenBank上登录的序列(NM_001243874)一致。
2.2 猪SRA/CD204胞外区部分基因片段的克隆及其原核表达载体的构建 以pMD18-T-SRAwt为模板,利用P CR扩增胞外区部分基因片段(614~1324 bp),琼脂糖凝胶电泳的结果显示,在约700bp处出现特异的条带,与预期的结果一致(图1B)。将PCR产物经Sac I和Xho I双酶切后连接入原核表达质粒pET-28a中,构建重组表达质粒pET-rSRA-c,对pET-rSRA-c进行Sac I和Xho I双酶切鉴定,可以切出约700 bp的目的条带,表明融合蛋白基因构建成功。对阳性质粒进行测序验证,结果显示编码rSRA-c的基因片段正确地插入到pET-28a中。
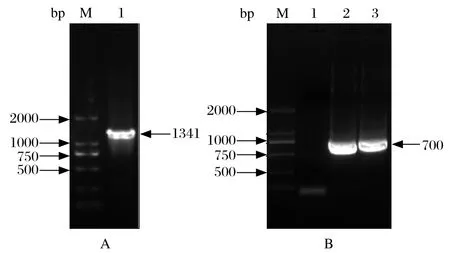
图1 猪SRA/CD204基因的PCR扩增Fig.1 Amplifi cation of SRA/CD204 gene from pig by PCR
2.3 rSRA-c的表达、纯化及多克隆抗体制备 重组质粒pET-rSRA-c转化大肠杆菌BL21(DE3),经IPTG诱导后,进行SDS-PAGE电泳,结果在约32 kDa处出现一明显的蛋白质条带,大小与预期结果相符,而pET-28a/ BL21(DE3)没有出现该条带。将诱导菌超声波裂解后的产物进行SDS-PAGE电泳,发现表达的目的蛋白大多存在于沉淀中,说明该蛋白是以包涵体的形式存在。将表达的蛋白按照His·Bind 纯化试剂盒说明书进行纯化后,取不同收集管中适量的洗脱产物进行SDS-PAGE电泳,结果在约32 kDa处出现一条清晰的蛋白条带,表明表达产物纯化良好(图2)。蛋白经透析处理后,进行小鼠免疫(100 μg/只),第5次免疫后7 d,进行采血,获得多抗血清。

图2 纯化蛋白rSRA-C的SDS-PAGE分析Fig.2 Analysis of the purifi ed fusion protein by SDS-PAGE
2.4 Western blot分析 对rSRA-c进行Western blot分析,抗His标签的抗体和自制的多克隆抗体均可以识别约32 kDa的蛋白,并且大小吻合,说明自制的多克隆抗体可以识别rSRA-c(图3)。将猪SRA/ CD204全长基因克隆至真核表达载体pcDNA3.0中,构建重组表达载体pcDNA-SRAwt,并对阳性质粒进行测序验证。随后,将pcDNA3.0 vector和pcDNA-SRA/CD204wt转染入CHO细胞系,24 h后,对收获的样品进行Western blot分析。结果发现转染CHO-SRA/CD204wt的细胞样品在约55 kDa处出现特异的反应条带,与预期的蛋白吻合,CHO-vector没有出现条带。可见,制备的多克隆抗体不仅可以识别rSRA-c,而且可以识别瞬时表达的全长SRAwt,具有特异性。
2.5 间接免疫荧光分析 为了进一步验证多抗血清的特异性,对瞬时转染的CHO-vector和CHO-SRA/ CD204wt进行免疫荧光分析。结果显示该多抗血清可以区分CHO-vector和CHO-SRA/CD204wt,SRA在CHO细胞中,主要表达于细胞膜和细胞质中(图4),制备的多抗血清可以有效地识别猪SRA分子。

图3 rSRA-c的Western blot分析Fig.3 Analysis of rSRA-c by Western blot
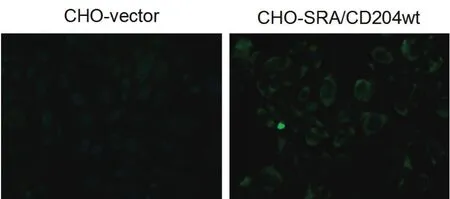
图4 间接免疫荧光分析结果(×200)Fig.4 Analysis of SRA/CD204 expression by indirect immunofl uorescence asssay (IFA)
2.6 吞噬实验 为了验证猪SRA/CD204介导的吞噬功能,分别将pCDNA3.0-vector和pCDNA-SRA/ CD204wt转染CHO细胞,24 h后,进行细菌吞噬分析。研究发现,相对于CHO-vector,CHO-SRA/ CD204wt显示出对大肠杆菌和金黄色葡萄球菌的吞噬作用(图5)。
3 讨论
清道夫受体SRA/CD204作为一类先天性免疫受体,参与调控脂蛋白的代谢,协同调控TLRs介导的炎性反应、参与病原微生物的识别等,在疾病和生理情况下起着重要的作用。相对于人类医学研究以及以小鼠为模型的研究,猪SRA/CD204的功能研究相对滞后。本研究利用基因工程的手段,制备了猪SRA/CD204的保外区的重组蛋白,并成功利用该重组蛋白制备了能特异识别猪SRA/CD204的多克隆抗体。通过真核表达技术,验证了猪SRA/CD204对病原菌的吞噬作用的发生。这些新的研究成果对于揭示猪SRA/CD204的功能,尤其是病原与宿主相互作用方面的功能,具有重要意义。
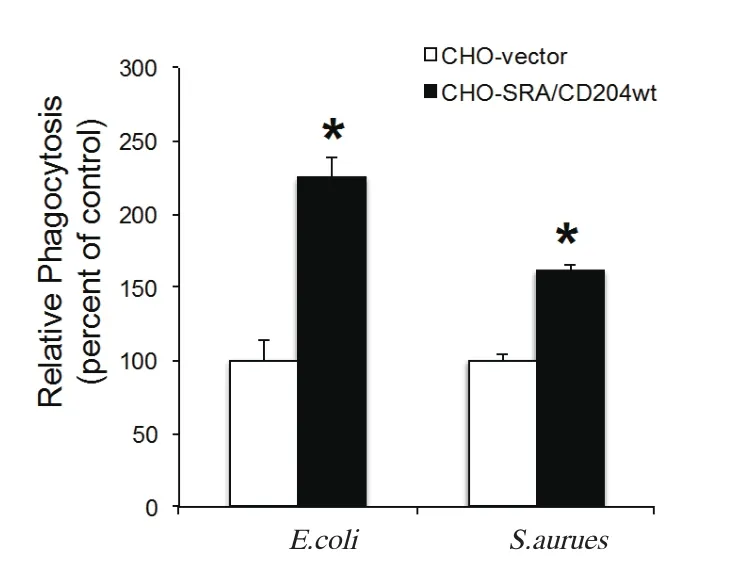
图5 猪SRA/CD204介导的细菌吞噬分析Fig.5 Analysis of bacterial phagocytosis mediated by SRA/CD204 from pig
作为一种跨膜糖蛋白,可分为胞外区、跨膜区以及胞内区,其中胞外区为主体部分,是进行配体包括LDL[3]、LPS[8]、LTA[9]等识别的区域。SRA/ CD204的胞外区由半胱氨酸富含区(SRCR)、胶原蛋白样区域(collagen-like)、卷曲螺旋区(coiled coil)以及间隔区组成。其中,半胱氨酸富含区和胶原蛋白样区域是主要的功能区域。本研究选取编码半胱氨酸富含区和胶原蛋白样区域的基因片段,进行原核表达,制备重组蛋白rSRA-c,通过免疫小鼠获得多克隆抗体,Western blot和间接免疫荧光分析结果显示,该多抗血清可以特异地识别rSRA-c以及真核表达的猪SRA/CD204。
有研究显示,SRA/CD204可以介导大肠杆菌[10]、单增李斯特杆菌[11]、奈瑟氏脑膜炎球菌[12]、链球菌[13]、金黄色葡萄球菌[14]等识别。研究表明SRA是通过结合细菌表面的相关分子,进行细菌的识别和吞噬,比如大肠杆菌的脂蛋白A(lipid A)[8]、链球菌或金黄色葡萄球菌等细菌的脂磷壁酸(LTA)[9]、奈瑟氏脑膜炎球菌表面蛋白NMB1220[12]等。我们的初步研究结果显示猪SRA/CD204可介导大肠杆菌和金黄色葡萄球菌的识别和吞噬,与上述结果相符。尽管具体的机制以及详细的细菌识别谱还需要进一步研究,但是这一结果显示了清道夫受体在不同物种的细胞中的功能保守性。
尽管猪SRA/CD204显示了与人或小鼠SRA/ CD204的功能相似性,但是猪SRA/CD204功能的研究才刚刚开始,大量的问题需要深入的探讨,比如其在猪细胞或组织中的表达特点、调控机制等。本研究成功制备了针对猪SRA/CD204的多克隆抗体,为将来探讨猪SRA/CD204在猪源细胞中的表达调控奠定了基础。对猪SRA/CD204与兽医临床相关病原菌作用的研究,将为揭示兽医临床相关细菌病的发病机制提供理论基础。
[1] Zani I A, Stephen S L, Mughal N A, et al. Scavenger receptor structure and function in health and disease[J]. Cells, 2015, 4(2)∶ 178-201.
[2] Krieger M. The other side of scavenger receptors∶ pattern recognition for host defense[J]. Curr Opin Lipidol, 1997,8(5)∶ 275-280.
[3] Goldstein J L, Ho Y K, Basu S K, et al. Binding site on macrophages that mediates uptake and degradation of acetylated low density lipoprotein, producing massive cholesterol deposition[J]. Proc Natl Acad Sci USA, 1979,76(1)∶ 333-337.
[4] De Winther M P, van Dijk K W, Havekes L M, et al. Macrophage scavenger receptor class A∶ A multifunctional receptor in atherosclerosis[J]. Arterioscler Thromb Vasc Biol, 2000, 20(2)∶ 290-297.
[5] Hashizume M, Mihara M. Blockade of IL-6 and TNF-alpha inhibited oxLDL-induced production of MCP-1 via scavenger receptor induction[J]. Eur J Pharmacol, 2012,689(1-3)∶ 249-254.
[6] Gran J T, Myklebust G, Wilsgaard T, et al. Survival in polymyalgia rheumatica and temporal arteritis∶ a study of 398 cases and matched population controls[J]. Rheumatology(Oxford), 2001, 40(11)∶ 1238-1242.
[7] DeWitte-Orr S J, Collins S E, Bauer C M, et al. An accessory to the 'Trinity'∶ SR-As are essential pathogen sensors of extracellular dsRNA, mediating entry and leading to subsequent type I IFN responses[J]. PLoS Pathog, 2010, 6(3)∶ e1000829.
[8] Hampton R Y, Golenbock D T, Penman M, et al. Recognition and plasma clearance of endotoxin by scavenger receptors[J]. Nature, 1991, 352(6333)∶ 342-344.
[9] Dunne D W, Resnick D, Greenberg J, et al. The type I macrophage scavenger receptor binds to gram-positive bacteria and recognizes lipoteichoic acid[J]. Proc Natl Acad Sci USA, 1994, 91(5)∶ 1863-1867.
[10] Peiser L, Gough P J, Kodama T, et al. Macrophage class A scavenger receptor-mediated phagocytosis of Escherichia coli∶ role of cell heterogeneity, microbial strain, and culture conditions in vitro[J]. Infect Immun,2000, 68(4)∶ 1953-1963.
[11] Suzuki H, Kurihara Y, Takeya M, et al. A role for macrophage scavenger receptors in atherosclerosis and susceptibility to infection[J]. Nature, 1997, 386(6622)∶292-296.
[12] Peiser L, De Winther M P, Makepeace K, et al. The class A macrophage scavenger receptor is a major pattern recognition receptor for Neisseria meningitidis which is independent of lipopolysaccharide and not required for secretory responses[J]. Infect Immun, 2002, 70(10)∶5346-5354.
[13] Arredouani M S, Yang Z, Imrich A, et al. The macrophage scavenger receptor SR-AI/II and lung defense against pneumococci and particles[J]. Am J Respir Cell Mol Biol,2006, 35(4)∶ 474-478.
[14] Thomas C A, Li Y, Kodama T, et al. Protection from lethal gram-positive infection by macrophage scavenger receptor-dependent phagocytosis[J]. J Exp Med, 2000,191(1)∶ 147-156.
GENERATION OF POLYCLONAL ANTIBODIES AGAINST PIG SCAVENGER RECEPTOR SRA/CD204 AND FUNCTIONAL ANALYSIS OF BACTERIAL PHAGOCYTOSIS MEDIATED BY PIG SRA/CD204
LI Qian-qian1,2, ZHANG Yan-bing1,2, XIANG Xiao2, WEI Jian-chao2, QI Peng-fei2, SHI Yuan-yuan2,LU Ying-mei2, XIA PENG2, LIU Ke2, SHAO Dong-hua2, LI Bei-bei2,MA Zhi-yong2, SUN Yan-ming1, QIU Ya-feng2
(1. College of Animal Science and Technology, Shihezi University, Shihezi 832003, China; 2. Shanghai Veterinary Research Institute, CAAS,Shanghai 200241, China)
To gain insights on biological functions of pig scavenger receptor SRA/CD204, we first sought to generate polyclonal antibodies against pig SRA/CD204. Firstly, a C-terminal gene fragment (614-1324bp) of pig SRA/CD204 gene was amplifi ed in PCR from pMD18-SRAwt and cloned into pET-28a to construct the recombinant plasmid pET-rSRA-c. The recombinant protein rSRA-c(about 32kDa) was mainly expressed as inclusion body and purified by His-Bind affinity chromatography. Furthermore, Balb/c mice were immunized with purifi ed rSRA-c for generation of polyclonal antibodies. The results showed that the polyclonal antibodies recognized rSRA-c and full-length pig SRA/CD204 expressed in CHO cell line (about 55 kDa) in Western blot. Furthermore, the polyclonal antibodies strongly reacted with pig SRA/CD204 in indirect immunofl uorescence assay, which mainly located in membranes and cytosolof CHO cells. Finally, we used the CHO cell line for over-expressing pig SRA/CD204 via transient transfection. The results showed that pig SRA/CD204 mediated phagocytosis of bacteria like E.coli and S. aureus.
Scavenger receptor; recombinant protein; polyclonal antibody; bacteria; phagocytosis
S852.61
A
1674-6422(2015)06-0042-06
2015-09-14
中国农业科学院上海兽医研究所中央级公益性科研院所基本科研业务费专项资金项目(2014JB06)
黎倩倩,女,硕士研究生,兽医技术服务专业
孙延鸣,E-mail:sym@shzu.edu.cn;邱亚峰,E-mail:yafengq@shvri.ac.cn
