山羊痘病毒 P32 基因的克隆及毕赤酵母中的表达
2015-11-23田启会祁光宇杨织瑞
田启会,祁光宇,杨织瑞
(1. 甘肃畜牧工程职业技术学院,武威 733006;2. 中农威特生物科技股份有限公司,兰州 730046)
·研究论文·
山羊痘病毒 P32 基因的克隆及毕赤酵母中的表达
田启会1,祁光宇2,杨织瑞2
(1. 甘肃畜牧工程职业技术学院,武威 733006;2. 中农威特生物科技股份有限公司,兰州 730046)
将人工优化合成的山羊痘病毒 P32基因和表达载体pPIC9K同时双酶切后相连,构建pPIC9K-IL-2 重组表达载体。将线性化的载体pPIC9K-P32电转化毕赤酵母GS115,对重组酵母转化子经 MD 平板筛选和 PCR 分析鉴定后,经 G418 抗性梯度筛选,获得多拷贝重组菌株,甲醇诱导表达后进行SDS-PAGE和Western blot。SDS-PAGE 电泳显示出相对分子质量约为30 kDa 目的蛋白表达条带,Western blot分析表明表达的蛋白具有反应原性。本研究成功构建载体pPIC9K-P32,并且P32基因已整合到酵母基因组中,为亚单位疫苗和鉴别诊断试剂奠定了基础。
羊痘病毒;P32 基因;毕赤酵母;分泌型表达载体;诱导表达;SDS-PAGE;Western blot
山羊痘(goat pox)是由山羊痘病毒(goat Poxvirus,GPV)感染山羊引起的一种高度接触性的地方流行性传染病,是所有动物痘病中最为严重的一种,OIE规定其必须上报,我国将其列为一类传染病。山羊痘发病率高,对养羊生产危害性较大[1]。亚洲、非洲、欧洲以及中国的青海省、甘肃省、江西省、福建省、四川省、云南省等地均有山羊痘的发生[2]。欧洲和加拿大等国家的家羊和山羊群中 GPV 抗体阳性率高达95%,GPV 对易感羊群的致死率达75%~100%[3,4]。研究表明 GPV 基因组大小为143~147 kb,GPV P32位于GPV 基因组的64~65 kb处,GPV P32 具有抗原特异性,含有一个抗原决定簇、是由319~324 个氨基酸组成的囊膜蛋白,羧基端有一个跨膜结构域,对细胞有毒害作用[5-8]。GPV P32蛋白位于羊痘病毒膜表面,是目前世界各地分离鉴定的所有羊痘病毒毒株共有的且特异性很强的结构蛋白,具有羊痘病毒主要的抗原决定位点,免疫动物后能使机体产生保护性抗体[9,10]。P32蛋白既能用于预防羊痘的新型疫苗的研究,也可以用于羊痘诊断试剂盒的研制。巴斯德毕赤酵母是具有很多优点的高效异源蛋白表达系统,能够对蛋白进行正确的折叠和加工,具有较高的生物活性,同时易于培养、成本低廉、表达量高,非常适合于大规模工业化生产[11]。本研究使用毕赤酵母表达系统表达经过优化后GPV P32 基因,为进一步羊痘病毒亚单位疫苗及诊断试剂盒研究奠定基础。
1 材料与方法
1.1 质粒和菌株 pMD19-T Simple Vector购自TaKaRa公司;Trans109 Chemically Competent Cell购于北京全式金生物公司;毕赤酵母(Pichia pastoris)GS115和酵母分泌型表达质粒 pPIC9K 菌株由中国农业科学院兰州兽医研究所家畜疫病病原生物学国家重点实验室保存;pUC57-Simple-P32合成质粒(P32基因由南京金斯瑞合成,合成基因参考GeneBank中登录号:AY159333)。
1.2 酶和相关试剂 限制性内切酶 EcoRⅠ、NotⅠ、SalⅠ均为TaKaRa公司产品;限制性内切酶、DNA Marker(DL2000);低分子量蛋白质Marker、Agarose Gel DNA Extraction Kit 均购自OMEGA公司;D-生物素、T4 DNA连接酶、G418、D-山梨醇均购自 Promega公司;YNB(无氨基酸酵母氮源)购自北京经科公司。
1.3 引物设计与合成 参考基因序列(NC_004003)优化后合成pUC57-Simple-P32质粒,利用 Primer Premier 5.0设计并合成了用于鉴定P32 基因的特异性引物 P32-F/P32-R。同时合成用于载体构建鉴定和重组酵母菌鉴定用载体引物P-5'AOX1/P-3'AOX1,序列由南京金斯瑞合成,引物序列见表1。

表1 引物序列Table 1 Sequences of primer
1.4 表达载体的构建 用限制性内切酶 EcoR I 与Not Ⅰ分别对pUC57-Simple-P32质粒和pPIC9K表达载体进行双酶切,胶回收后将载体片段和目的基因片段,在16℃ T4 DNA 连接酶的作用下连接过夜,并将连接产物转化感受态细胞Trans109,提取质粒分别进行 PCR 和酶切鉴定,将 PCR 和双酶切鉴定均为阳性的重组质粒送大连宝生物有限公司进行测序,将鉴定正确的重组质粒命名 pPIC9K-P32。
1.5 重组酵母菌的构建与重组酵母菌株的筛选 将10 μg经测序鉴定为阳性的重组质粒用限制性内切酶SalⅠ进行酶切,切胶回收后,将线性化质粒电转化至感受态酵母菌GS115中进行重组。将MD培养基平皿中长出的转化子,采用影印法依次接种到含G418浓度梯度 0.5、2.0、4.0 mg/mL的 YPD 培养基中,逐级筛选 G418 抗性菌株即目的基因高拷贝重组菌株,筛选得到的重组多拷贝菌株经PCR法确认。
1.6 重组酵母菌株的诱导表达 将转化的单克隆重组酵母菌 GS115/pPIC9K-P32 分别接种于10 mL BMGY 培养基中,28℃、260~280 r/min振荡培养16~18h,至菌体 OD600值大于2时,室温离心5 min 收获菌体。菌体沉淀用 20 mL BMMY培养基悬浮,28℃、260~280 r/min诱导培养72 h,每 24 h向培养基中补加甲醇至终浓度为 1.5%,以保证持续诱导表达。诱导结束后,培养液 5000×g室温离心10 min,收集上清,-20℃保存备用。
1.7 表达产物的 SDS-PAGE和 Western blot 分析 取50 μL 丙酮沉淀法浓缩的表达菌液上清,加等量1×SDS 样品缓冲液100℃ 煮沸 5 min ,取30 μL样品进行SDS-PAGE 检测。取等量空载体表达菌液做相同处理,作为阴性对照。将凝胶中的蛋白带转印至PVDF膜上,3%BSA 室温封闭过夜;然后以山羊痘高免血清(1∶300)为一抗,HRP 标记兔抗山IgG(1∶500)为二抗进行 Western blot;最后在 DAB +H2O2溶液中显色观察。
2 结果
2.1 表达载体的构建
2.1.1 重组质粒的双酶切鉴定 以重组质粒pPIC9K-P32为模板,使用质粒提取试剂盒提取重组质粒。用限制性内切酶 EcoR I 与 Not I对重组质粒进行双酶切,酶切产物经1%琼脂糖电泳,可见1条约9300 bp片段和1条与目的基因片段大小相符的780 bp片段(图1)。

图1 重组pPIC9K-P32质粒的酶切鉴定结果Fig.1 Identifi cation of recombinant plasmid by enzyme digestion
2.1.2 重组质粒的 PCR 鉴定 以重组质粒pPIC9K-P32为模板,分别使用特异性引物P32-F/P32-R 和通用引物 5'-AOX1/3'-AOX1 进行 PCR 鉴定,分别扩增出大小约780 bp和1280 bp的条带,与理论推断大小一致(图2),初步证明了目的基因成功克隆入载体中。

图2 重组pPIC9K-P32质粒的PCR鉴定结果Fig.2 Identifi cation of recombinant plasmid by PCR
2.2 重组酵母菌的构建与重组酵母菌株的筛选 将初步经过MD培养基中长出的转化子,影印法依次接种到含G418的YPD 培养基中,逐级筛选 G418 抗性菌株,对菌株进行PCR法鉴定,扩增出目的基因约780 bp的菌株为重组多拷贝菌株(图3、图4)。
2.3 表达产物的 SDS-PAGE和 Western blot 分析 将GS115/pPIC9K-P32 毕赤酵母重组菌株培养产物进行 SDS-PAGE 检测,空载体菌体上清液中未检测到目的蛋白。随着甲醇的诱导从培养24 h的菌体沉淀中开始检测到目的蛋白,相对分子质量约30 kDa,与预期的大小一致。而空载体重组菌株 GS115/pPIC9K-P32 中未检测到目的蛋白(图5)。Western blot 检测结果显示,表达蛋白能与山羊痘阳性血清发生特异性的反应(图6),说明毕赤酵母菌系统成功表达的 GPV P32蛋白具有免疫学活性。
3 讨论
P32基因全长969 bp,是羊痘病毒最特异的主要结构蛋白,含有主要的抗原表位,在病毒感染早期产生抗体。针对该蛋白的单一血清可以中和羊痘病毒,这表明P32蛋白具有中和表位,可强烈诱导细胞免疫[12]。外源基因密码子中存在过多的宿主低利用密码子,尤其位于起始密码子附近的低利用密码子对基因的表达影响很大,解决这一问题的方法一般有两个:一是通过点突变的方法用同义高利用率密码子替代低利用密码子,而不改变其氨基酸序列;另一个方法是截去基因中影响其表达但不影响生物活性的部分[13]。根据酿酒酵母高表达密码子的偏爱性,对P32 基因进行人工合成,在不改变其氨基酸序列的前提下,将几个低利用率密码子同义突变为高利用率密码子,有利于蛋白表达量增加。P32完整蛋白对细胞有毒害作用[14],剔除3'端的跨膜区,只截取P32 基因非跨膜区进行人工合成。本实验室对P32 基因非跨膜区进行过酵母的表达,但表达量低,经过人工改造,位于10~12 bp碱基(AAA)、19~21 bp碱基(AAT)、22-24 bp碱基(GAT)、766~768 bp碱基(CAT)、778~780 bp碱基(TCA)分别同义突变为毕赤酵母高利用率的密码子:为AAG 赖氨酸(Lys)、AAC 天冬酰胺(Asn)、GAC 天冬氨酸(Asp)、CAC 组氨酸(His)、TCC丝氨酸(Ser),研究证明经过人工改造合成的P32基因表达量明显增加。

图3 含G418的 YPD 培养基重组多拷贝菌株Fig.3 Restructuring muti-copy strain in YPD medium containing G418
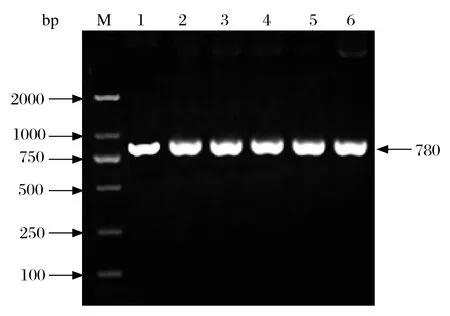
图4 高拷贝酵母转化子的PCR鉴定Fig.4 PCR identifi cation for the yeast transformants containing multicopy geneinsertion
图5 表达产物pPIC9K-P32的SDS-PAGE电泳分析Fig.5 SDS-PAGE analysis of the expression of pPIC9K-P32

图6 表达产物的Western blot分析Fig.6 Western blot analysis of the expression of pPIC9K-P32
毕赤酵母(Pichia parstoris)可高效表达异源蛋白的真核表达系统,毕赤酵母表达重组蛋白具有糖基化修饰,但毕赤酵母比酿酒酵母连接到蛋白上的寡糖链更短更精确[15]。毕赤酵母能对所表达的外源蛋白进行加工、折叠、翻译后修饰,并将其分泌到培养基中,这样使得目的蛋白分离纯化操作变得更简便,因而是一种十分理想的真核蛋白表达系统。研究人员越来越多的利用毕赤酵母表达外源基因来生产相关蛋白,并已成功表达多种相关目的蛋白[16-18]。
所有毕赤酵母表达菌株都来源于野生型菌株NRRL-Y 11430,大多数菌株(包括KM71、GS115和SMD1168在内)是组氨酸脱氢酶基因(his4)缺陷型菌株,可通过不含组氨酸培养基来筛选重组表达菌株。酵母菌 GS115 是营养缺陷型突变菌株[19],自身不能合成组氨酸,只有当表达载体转化酵母后利用载体上所携带的编码HIS4基因才能合成组氨酸,因此,使用缺乏组氨酸的选择性 MD 平板就可以筛选到重组的酵母菌株。pPIC9K载体上含有卡那霉素抗性基因,可抵抗与真核抗生素 G418 相关的药物[20],因此可以简单地认为对G418抗性的高低与载体的拷贝数相关。在使用G418筛选时,低浓度的G418可以获得数量较多的单个菌落,而拷贝数较少;使用高浓度的G418获得的单个菌落较少,而拷贝数较多,更加利于后续实验。
Carn等[21]用截短 P32 蛋白对动物进行免疫,并可以检测到 P32 抗体的产生,产生的抗体虽然不能阻止病毒在攻毒部位的复制,但有助于防止病毒的扩散,说明截短 P32 蛋白仍具有良好的免疫原性。本研究采用密码子优化和截短表达,在酵母菌中成功表达了GPV P32 蛋白,免疫印迹试验也证实表达重组蛋白具有免疫反应性,为亚单位疫苗和鉴别诊断试剂奠定了基础。
[1] 高顺平, 吴国华, 颜新敏, 等. 山羊痘病毒L1蛋白的原核表达及其功能分析[J]. 中国兽医科学, 2014, 44(12)∶1257-1261.
[2] 颜新敏, 吴国华, 李健, 等. 羊痘在中国的流行现状分析[J]. 中国农学通报, 2010, 26(24)∶ 6-9.
[3] Lamien C E, Le Goff C, Silber R, et al. Use of the Capripoxvirus homologue of vaccinia virus 30 kDa RNA polymerase subunit (RPO30) gene as a novel diagnostic and genotyping target∶ development of a classical PCR method to differentiate goat poxvirus from sheep poxvirus[J]. Vet Microbiol, 2011, 149(1-2)∶ 30-39.
[4] Yogisharadhya R, Bhanuprakash V, Hosamani M, et al. Comparative efficacy of live replicating sheeppox vaccine strains in Ovines[J]. Biologicals, 2011, 39(6)∶ 417-423.
[5] Markoulatos P, Mangana-Vougiouka O, Koptopoulos G,et al. Detection of sheep poxvirus in skin biopsy samples by a multiplex polymerase chain reaction[J]. Virol Methods, 2000, 84(2)∶ 161-167.
[6] Zheng M, Jin NY, Liu Q, H, et al. Immunogenicity and protective efficacy of Semliki forest virus repliconbased DNA vaccines encoding goatpox virus structural proteins[J]. Virology, 2009, 391(1)∶ 33-43.
[7] Mangana-Vougiouka O, Markoulatos P, Koptopoulos G N, et al. Sheep poxvirus identification from clinical specimens by PCR, cell culture, immunofluorescence and agar gel immunoprecipitation assay[J]. Mole Cell Probes,2000, 14(5)∶ 305-310.
[8] Beard P M, Sugar S, Bazarragchaa E G. A description of two outbreaks of capripoxvirus disease in Mongolia[J]. Vet Microbiol, 2010, 142(3-4)∶ 427-431.
[9] Ziovicv V V, T chikacv N A, Chcrtov O Y, et al. ldentification of the genome genome encoding vaccinia virus immunodominant protein P35[J]. Gene, 1994, 147∶209-214.
[10] Carn V M,Kitching R P, Hammond J M, et al. Use of a recombinant antigen in an indirect ELISA for detecting bovine antibody to ca-pripoxvirus[J]. J Virol Methods,1994, 49∶ 285-294.
[11] 刘斌, 祁光宇, 陈晓宇, 等. 重组质粒pPIC9K-IL-2的构建及在毕赤酵母中的表达[J]. 甘肃农业大学学报, 2014,3(49)∶ 32-36.
[12] 芦晓立, 张强. 羊痘病毒P32基因与羊CD58基因共表达载体的构建[J]. 甘肃农业大学学报, 2014, 6(49)∶ 1-4.
[13] Zhang S P, Zubay G, Goldman E. Low-usage condon inEscherichia Coli, yeast, fruit fly and primates[J]. Gene,1991, 105(1)∶ 60-72.
[14] 王效田, 兰朋云, 夏明龙, 等. 山羊痘的诊断与防制[J]. 中国兽医杂志. 2001, 37(3)∶ 28-29.
[15] Mattanovich D, Branduardi P, Dato L. Recombinant protein production in yeasts[J]. Methods Mol Biol, 2012,824∶ 329-358.
[16] Cardoso S A, Paixao V F, Oliveira M D, et al. Dengue-1 envelope protein domain III produced in Pichia pastoris∶potential use for serological diagnosis[J]. Protein Expr Purif, 2013, 92 (1)∶ 9-13.
[17] Kwon W T, Lee W S, Park P J, et al. H protective immunity of Pichia pastoris-expressed recombinant envelope protein of Japanese encephalitis virus[J]. J Microbiol Biotechnol, 2012, 22 (11)∶ 1580-1587.
[18] Subathra M, Santhakumar P, Satyam Naidu S, et al. Expression of Avian influenza virus (HSN1)hemagglutinin and matrix protein 1 in Pichia pastoris and evaluation of their immunogenicity in mice[J]. Appl Biochem Biotechnol, 2014, 172(7)∶ 3635-3645.
[19] Cereghino J L, Cregg J M. Heterologous protein expression in the methylotrophic yeast Pichia pastoris [J]. FEMS Microbiol Revi, 2000, 24(1)∶ 45-66.
[20] Scorer C A, Buckholz R G, Clare J J, et al. The intracellular production and secretion of HIV-1 envelope protein in the methylotrophic yeast Pichia pastoris[J]. Gene, 1993,136(1-2)∶ 111-119.
[21] Carn V M, Kitching R P, Hammond J M, et al. Use of a recombinant antigen in an indirect ELISA for detecting bovine antibody to capripoxvirus[J]. J Virol Methods,1994, 49(3)∶ 285-294.
CLONING AND EXPRESSION OF THE CAPRIPOXVIRUS P32 IN PICHIA PASTORIS
TIAN Qi-hui1, QI Guang-yu2, YANG Zhi-rui2
(1. Gasu Polytechnic College of Animal Husbandry & Engineering, Wuwei 733006, China; 2. Agricultural Veterinary Biological Science & Technology Co.,Ltd, Gansu 730046, China)
The recombinant Pichia pastoris GS115 was constructed for further research and development of the subunit vaccine and diagnosis reagent. The artifi cial synthetic P32 gene was subcloned into the Pichia pastoris expression vector pPIC9K, resulting in recombinant plasmid pPIC9K-P32.The plasmid was then transformed into Pichia pastoris GS115 by electroporation. The expressed product had a molecular weight of 30 kDa band in SDS-PAGE and reacted with the positive antiserum of CPV. The multi-copy recombinant P. pastoris strains were selected out with G418 and induced with methanol. The expressed product was analyzed in SDSPAGE and Western blot. The result showed that P32 gene was integrated with chromosome of Pichia pastoris as identifi ed in PCR.
Capripoxvirus; P32 gene; Pichia pastoris; secreted expression vector; induced expression; SDS-PAGE; Western blot
S852.659.3
A
1674-6422(2015)06-0031-06
2015-07-15
甘肃省科技计划资助(1104NKCA167)
田启会,硕士,主要从事临床研究教学工作
杨织瑞,E-mail:westdotianqihui@163.com
