轴突导向蛋白4D在肿瘤进展中的作用*
2015-11-23张磊陈颖王珂
张磊 陈颖 王珂
·国家基金研究进展综述·
轴突导向蛋白4D在肿瘤进展中的作用*
张磊 陈颖 王珂
轴突导向蛋白4D(SEMAPHORIN4D,SEMA4D)又称CD100,是轴突导向蛋白Ⅳ亚族(SEMAsⅣ)的重要成员之一,其最初作为影响神经发育的轴突导向分子被发现。近来越来越多的研究表明,SEMA4D在免疫调节、血管发生及肿瘤生长转移等方面也有重要的生物学功能,尤其作为新的促血管生成分子,SEMA4D的相关研究引起广泛关注。本文旨在对SEMA4D的结构、受体特点、促血管生成及肿瘤侵袭转移等方面的最新研究进展进行综述。
SEMA4D 轴突导向 肿瘤 免疫调节 血管生成
Department of Gynecologic Oncology,Tianjin Medical University Cancer Institute and Hospital,National Clinical Research
Center for Cancer,Key Laboratory of Cancer Prevention and Therapy of Tianjin,Tianjin 300060,China
This work was supported by the National Natural Science Foundation of China(No.81302250)and Tianjin Health Bureau of Science and Technology Funds(No.2012KZ073)
在神经发育过程中,轴突导向分子引导轴突选择正确生长方向,从而成功到达靶区,近年来关于轴突导向分子的研究进展迅速,SEMAPHORINs(SEMAs)家族是其中越来越受到关注的分子之一,该家族蛋白主要有2种受体:Plexins和Neuropilins[1]。但是,SEMAs家族除了最初作为轴突导向分子影响中枢神经系统的发育而被发现外,随后越来越多的研究表明在多种细胞中都有SEMAs及其受体表达,从而引起一系列关于其功能及信号转导通路的研究[2]。SEMAPHORIN4D(SEMA4D)又称CD100,是SEMAPHORINs家族的重要成员之一,许多研究发现其在神经系统、免疫调节、血管发生、肿瘤侵袭转移等方面均起着重要作用[3]。
1 SEMAPHORINs概述
SEMAs家族是一大类结构高度同源的分泌型或跨膜型蛋白分子,其蛋白结构中均包含一个SEMA结构域,其在神经系统发育过程中发挥重要作用。SEMAs分子可以调节神经轴突导向及介导细胞纺锤体的形成[4]。20多个SEMAs蛋白根据分子序列的相似度及结构的不同特点将其分为8个亚族,SEMAⅠ和SEMAⅡ亚族存在于无脊椎动物种属中,SEMAⅢ到SEMAⅦ亚族表达于脊椎动物种属,SEMAⅧ亚族则来自于非神经来源的病毒中[5](图1)。既往研究表明在神经系统发育中,SEMAs蛋白主要参与轴突生长调控,轴突分裂、收缩,神经极化以及神经细胞迁移等生理过程,但近来越来越多的研究证实SEMAs分子在神经元细胞凋亡、转化,免疫反应,细胞迁移,肿瘤发生发展等过程中均扮演重要角色[7-8]。
2 SEMA4D及其受体
2.1结构
SEMA4D是一个分子量为150 kD的跨膜蛋白分子,其结构包括一个氨基末端,一个SEMA结构域
(SEMA domain),一个免疫球蛋白域(Ig domain),一个富有赖氨酸的延长区,一个疏水的跨膜区和一个存在于细胞浆中的尾部结构。SEMA4D以同源二聚体形式分布在细胞表面,其细胞外的结构部分包括多个N-连接糖基化位点和17个高度保守的半胱氨酸残基,用于亚基内二硫键的形成;胞内区有一个酪氨酸及多个丝氨酸磷酸化位点[9](图2)[10]。经过蛋白酶水解作用,SEMA4D能够以分泌型蛋白形式从细胞膜上释放到局部微环境中。
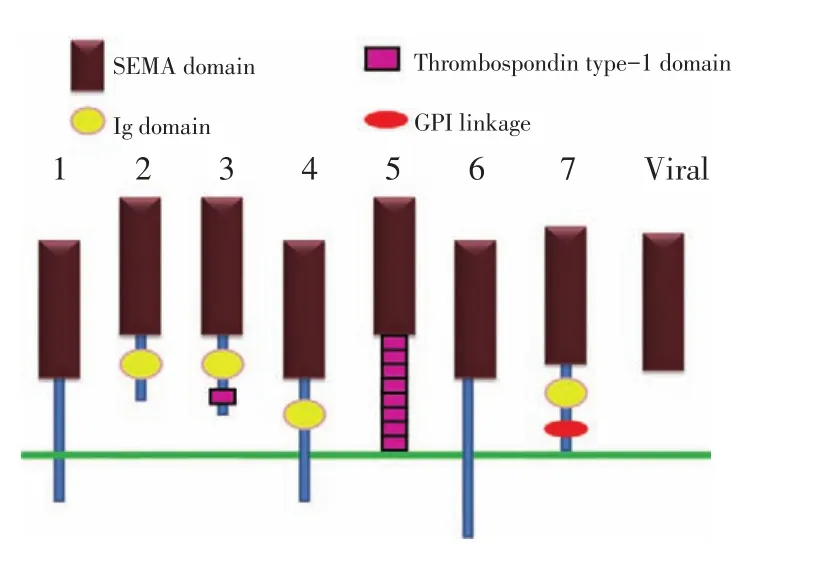
图1 SEMAPHORINs(SEMAs)蛋白家族结构示意图Figure 1Semaphorin(SEMA)family contains a large number of phylogenetically conserved,secreted,and transmembrane proteins.On the basis of structural features,the members were divided into eight classes,including a unique viral class.The members of SEMA family all share a common SEMA domain

图2 SEMPHORIN4D(SEMA4D)分子结构Figure 2The structure of semaphorin 4D(SEMA4D)consists of an amino-terminal signal sequence,a SEMA domain,Ig-like domain,a lysine-rich stretch,a transmembrane region,and a cytoplasmic region.Although SEMA4D is a transmembrane-type semaphorin,it is proteolytically cleaved into a soluble form
2.2分布
SEMA4D分布广泛,在胚胎及成人组织中均有较高表达,其中包括非淋巴组织(心、脑、肾)和淋巴组织(脾、胸腺和淋巴结)[11]。在淋巴器官中,SEMA4D主要表达于静息的T细胞表面,而在静息的B细胞及抗原呈递细胞(APC),如树突细胞(DC)上则表达较低。但当B细胞或DC细胞被活化后,SEMA4D的表达明显上调。在其他与宿主防御能力有关的细胞中,如单核巨噬细胞、中性粒细胞、内皮细胞和上皮细胞上也有SEMA4D的分布[12]。并且最近的研究表明多种实体肿瘤细胞上SEMA4D也有较高的表达,包括头颈鳞状细胞癌、乳腺癌、前列腺癌、结肠癌、软组织肉瘤和卵巢癌[13-17]。
2.3受体
SEMA4D的受体主要包括:CD72和PlexinB1。CD72是一个分子量为45 kD的Ⅱ型跨膜蛋白,其属于C型凝集素超家族,是SEMA4D在淋巴组织的主要受体。CD72主要表达于免疫细胞,如B细胞、APC及肥大细胞等。对于B细胞来说,CD72表达于从祖B细胞到成熟B细胞各阶段,而分化到浆细胞阶段CD72则不表达。CD72胞浆区含有2个免疫受体酪氨酸抑制序列(immunoreceptor tyrosine-based inhibitory mofifs,ITIMs),在B细胞发育分化及免疫应答中发挥负性调节作用。CD72与BCR发生交联诱导ITIM酪氨酸磷酸化,并与蛋白质酪氨酸磷酸酶(SHP-1)结合,诱导酪氨酸去磷酸化及下游信号蛋白灭活,继而促使静止的B细胞向祖细胞发生分化,并且可以降低活化的B细胞增殖。而SEMA4D和竞争性CD72单克隆抗体(CD72-mAb)与CD72结合,促进CD72从B细胞受体复合物上解离,ITIM酪氨酸去磷酸化及CD72与SHP-1解离,从而消除CD72的抑制作用,使B细胞活化,并提高B细胞的聚集、生存能力及APC的活化与成熟[18]。
PlexinB1是跨膜蛋白Plexins蛋白家族的重要成员之一,是SEMA4D的高亲和力受体,最初是从小鼠肾脏来源的细胞上发现的。PlexinB1细胞外部分的分子结构与Met分子有28%的相似度,包括一个SEMA结构域,3个PSI结构域,3个甘氨酸-脯氨酸(glycine-proline,G-P)富集模体,而胞浆部分含有2个GAP(GTPase活化蛋白)样结构域,中间1个GTPase结合结构域,胞质尾部有一个盘状同源区域(PSD-95,Discs large,zona occludens-1,PDZ)结构域结合位点。PlexinB1以异源二聚体的形式分布于内皮细胞胞膜上,包括α和β两个亚基。β跨膜亚基包括较短的细胞外结构域和细胞浆结构域,而α亚基主要包括较长的细胞外结构域,α亚基和β亚基之间通过较为疏松的相互作用结合于细胞膜表面。经过蛋白水解作用,SEMA4D、PlexinB1和Met分子三者之间形成一个功能性的复合体存在于内皮细胞的表面,继而发挥作用。相似地,Met分子在胞膜外区也存在1个SEMA结构域,1个PSI结构域,4个IgSF样结构域。胞质区有1个酪氨酸激酶结构,当SEMA4D、PlexinB1及Met形成复合物后,酪氨酸激酶使Met和PlexinB1胞质区以及某些下游信号分子发生磷酸化,
从而参与血管形成、细胞迁移和侵袭等生物学过程。另外,Swiercz等[19]报道PlexinB1和酪氨酸激酶受体ErbB-2关系密切,PlexinB1与SEMA4D结合后诱导ErbB-2发挥内源性活性。在活化的T细胞上也发现了PlexinB1转录子,但其详细的作用机制还有待深入研究。
3 SEMA4D促进血管生成
血管生成是恶性肿瘤侵袭转移的重要环节,SEMA4D能够通过介导内皮细胞迁移、管腔形成从而促进肿瘤血管发生。研究表明SEMA4D的促进肿瘤血管生成作用与其他一些重要的促血管发生的分子相类似,如血管内皮生长因子(vascular epithelial growth factor,VEGF)、HGF、bFGF等[20-21]。
SEMA4D的促血管生成作用是与其受体PlexinB1结合后启动(绘制模式图3)。PlexinB1广泛高表达于内皮细胞胞膜表面,细胞膜上的SEMA4D分子通过水解酶作用之后释放到微环境中,与内皮细胞膜上PlexinB1结合后促使一系列级联式反应发生,从而介导血管生成,但其具体过程仍然存在争议。Basile等[22]认为SEMA4D与其受体PlexinB1羧基端的PDZ结合域结合后,继续结合RhoGEF和LARG分子,从而激活RhoA分子及整合素分子(Intergrins),继而促进肿瘤血管发生,这一过程与细胞内酪氨酸激酶途径的活化密切相关,尤其是Pyk2分子的参与在其中发挥了重要作用。但是,Conrotto等[20]却认为SEM4D的促血管生成作用则是通过Met基因激活,继而酪氨酸磷酸化的过程实现的。虽然上述两种关于机制分析的观点存在分歧,但两人仍然一致认为最终都是导致内皮细胞骨架发生变化及细胞迁移而实现了肿瘤新生血管的发生。

图3 SEMA4D与受体PlexinB1结合促进血管生成模式图Figure 3Model for semaphorin 4D(SEMA4D)/Plexin-B1 promoted angiogenesis.Membrane-bound SEMA4D was released by proteolytic cleavage.Subsequently,soluble SEMA4D bound Plexin-B1 on endothelial cells of the tumor stroma to initiate an angiogenic response
Basile等[23]在头颈鳞癌的研究中发现:头颈鳞癌细胞高表达SEMA4D,SEMA4D以分泌型蛋白的形式从癌细胞中释放出来促进内皮细胞的迁移,从而促进肿瘤新生血管生成介导癌细胞发生远处转移,并且体内实验证实在缺乏SEMA4D的肿瘤微环境中,癌细胞的生长或转移明显受到抑制。Sierra等[24]在裸鼠的乳腺癌成瘤模型中也观察到了相似的结果:沉默肿瘤微环境中SEMA4D的表达后,肿瘤的微血管形成能力和转移能力明显降低。但与前者研究矛盾的是,Chen等[17]认为肿瘤微环境中分泌型的SEMA4D蛋白来自于肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)而不是由肿瘤细胞分泌的,这种不一致结果的原因可能是由不同的肿瘤类型造成的。本研究组也证实:上皮性卵巢癌中SEMA4D高表达,与患者的临床病理特征及预后密切相关,SEMA4D是上皮性卵巢癌患者无疾病进展生存期及总生存期的独立预后因素。
4 SEMA4D调控侵袭转移
侵袭生长是一个多步骤的复杂的形态发生过程,主要包括肿瘤细胞分离、细胞迁移、细胞种植、转移灶形成、细胞增殖和细胞存活6个步骤。侵袭生长可见于正常的生理过程中,如胚胎发育和伤口愈合等。然而,侵袭生长是肿瘤进展过程中的重要环节[25]。研究表明,SEMA4D的重要受体之一PlexinB1在多种实体瘤中高表达,如乳腺癌、结肠癌、肝癌、胰腺癌和胃癌等。SEMA4D与PlexinB1结合后通过Met信号途径促进了上述恶性肿瘤细胞的侵袭转移[26]。但是,Swiercz等[19]研究表明SEMA4D与PlexinB1结合后是否促进癌细胞的侵袭生长取决于癌组织中PlexinB1、Met及ErbB-2的表达量的高低。ErbB-2是一个比较公认的在乳腺癌上提示患者预后较差的指标,SEMA4D与ErbB-2结合促进恶性肿瘤细胞侵袭生长,但与PlexinB1或Met结合后则抑制癌细胞的迁移。恶性肿瘤中,SEMA4D是促进癌细胞迁移还是抑制癌细胞迁移的效应取决于SEMA4D与PlexinB1、Met还是ErbB-2结合,复杂的下游的分子信号通路依赖于Rho分子的活化情况,但详细的分子机制还需要进一步的研究[27]。
另外,研究表明SEMA4D与PlexinB1结合后促进神经轴突的生长。报道提到PlexinB1本身具有与R-Ras蛋白相类似的内在GAP活性。R-Ras失活抑制了细胞间粘附、细胞迁移及生长锥的外生长。与上述激活途径相反,这种抑制作用降低了细胞的迁移。而PlexinB1的R-Ras GAP突变可以减少细胞粘附、迁移和侵袭的发生[28]。
5 SEMA4D在免疫系统的作用
外源性SEMA4D或可溶性重组SEMA4D蛋白均可促进B细胞的活化。体内实验通过分析CD40、
CD80及IL-12的表达,发现SEMA4D促进CD40介导的抗原呈递细胞(DC)细胞的成熟。并且在敲除SEMA4D表达的免疫缺陷小鼠的动物模型研究中观察到:抑制SEMA4D的表达后,小鼠体内抗体的产生及T细胞诱发的特异性抗体的表达均降低。此外,无论是重组可溶性SEMA4D蛋白还是竞争性的SEMA4D单克隆抗体均可介导单核细胞释放IL-6、IL-8等细胞因子促进炎症发生[29]。Delaire等[30]报道无论对于新鲜分离的单核细胞还是单核细胞株,SEMA4D均可抑制自发性或MCP-3介导的细胞迁移。但SEMA4D的受体PlexinB1或CD72是否参与SEMA4D介导的免疫细胞的迁移尚不清楚。
在肿瘤相关巨噬细胞中,虽然缺乏SEMA4D的表达不能改变巨噬细胞本身的分化、激活以及细胞因子的产生,但是敲除肿瘤微环境中SEMA4D的表达后明显可以下调肿瘤相关巨噬细胞的数量[24]。
6 SEMA4D与肿瘤患者预后及治疗
SEMA4D在多种恶性实体瘤中表达明显增高并与患者预后密切相关。在宫颈癌中,SEMA4D高表达提示患者总生存时间明显缩短,这可能与SEMA4D通过自分泌的方式介导肿瘤血管发生从而促进癌细胞发生远处转移有关[31]。此外,在卵巢癌[17]及骨肉瘤[15]中的研究均发现,SEMA4D表达增高预示患者无疾病进展生存期及总生存期均较对照组缩短。SEMA4D的重要作用之一即诱导肿瘤新生血管形成。而新生血管形成是恶性肿瘤侵袭转移的关键环节,SEMA4D作为重要的促血管生成因子,可以诱导内皮细胞的迁移和管腔形成,因此其高亲和力受体PlexinB1可以成为抗肿瘤血管生成药物的重要靶标[32]。丁晓洁等[33]已经证实:在裸鼠直肠癌移植瘤模型中,抑制SEMA4D的表达可以减弱癌细胞诱导内皮细胞迁移的能力,显著减缓移植瘤生长速度并降低瘤体内血管密度,这也为SEMA4D的临床抗血管生成治疗进一步奠定了基础。另外,SEMA4D的新型人源化单克隆抗体(mAb)VX15/2503显示出良好的肿瘤治疗应用前景。在2010年第6届欧洲抗体大会上,Vaccinex公司报告VX15/2503可有效阻断SEMA4D和plexinB1的相互作用,并且在小鼠CT26和EM6肿瘤模型中,已经观察到VX15/2503可有效抑制肿瘤的生长和血管形成。2011年Vaccinex公司被FDA批准进行治疗性VX15/2503的Ⅰ期临床试验,目的在于评估VX15/ 2503的安全性、耐受性、药代动力学及药效学。
7 展望
总的来说,SEMA4D在免疫、神经发育,促进肿瘤进展,尤其是肿瘤血管生成方面均扮演重要角色。在多种实体瘤组织中,SEMA4D高表达提示肿瘤细胞恶性程度较高,并且SEMA4D与受体PlexinB1结合后可以促进TAM迁移及增强TAM促进肿瘤微血管生成效应,但其作用的具体详细机制仍需进一步探索。随着SEMA4D研究的更加深入,SEMA4D作为靶点应用于恶性肿瘤的临床诊断和治疗必将有广阔的前景,并且当抗VEGF治疗效果不佳时,联合或补充给予针对SEMA4D信号途径多靶点抗血管生成治疗也许能产生令人振奋的效果,而其在转化医学的研究和应用中也将扮演越来越重要的角色。
1Takegahara N,Kumanogoh A,Kikutani H.Semaphorins:a new class of immunoregulatory molecules[J].Philos Trans R Soc Lond B Biol Sci,2005,360(1461):1673-1680.
2Gu C,Giraudo E.The role of semaphorins and their receptors in vascular development and cancer[J].Exp Cell Res,2013,319(9): 1306-1316.
3Eissler N,Rolny C.The role of immune semaphorins in cancer progression[J].Exp Cell Res,2013,319(11):1635-1643.
4Gherardi E,Love CA,Esnouf RM,et al.The sema domain[J]. Curr Opin Struct Biol,2004,14(6):669-678.
5Koropouli E,Kolodkin AL.Semaphorins and the dynamic regulation of synapse assembly,refinement,and function[J].Curr Opin Neurobiol,2014,27:1-7.
6Kumanogoh A,Kikutani H.Biological functions and signaling of a transmembrane semaphorin,CD100/Sema4D[J].Cell Mol Life Sci,2004,61(3):292-300.
7Rehman M,Tamagnone L.Semaphorins in cancer:biological mechanisms and therapeutic approaches[J].Semin Cell Dev Biol,2013,24(3):179-189.
8Micucci C,Orciari S,Catalano A.Semaphorins and their receptors in stem and cancer cells[J].Curr Med Chem,2010,17(30):3462-3475.
9Chao KL,Tsai IW,Chen C,et al.Crystal structure of the Sema-PSI extracellular domain of human RON receptor tyrosine kinase[J].PLoS One,2012,7(7):e41912.
10 Suzuki K,Kumanogoh A,Kikutani H.CD100/Sema4D,a lymphocyte semaphorin involved in the regulation of humoral and cellular immune responses[J].Cytokine Growth Factor Rev,2003,14(1): 17-24.
11 Zhang Y,Liu B,Ma Y,et al.Sema 4D/CD100-plexin B is a multifunctional counter-receptor[J].Cell Mol Immunol,2013,10(2):97-98. 12 Nkyimbeng-Takwi E,Chapoval SP.Biology and function of neuroimmune semaphorins 4A and 4D[J].Immunol Res,2011,50(1): 10-21.
13 Ch'Ng ES,Kumanogoh A.Roles of Sema4D and Plexin-B1 in tumor progression[J].Mol Cancer,2010,9:251.
14 Campos M,DE Campos SG,Ribeiro GG,et al.Ki-67 and CD100 immunohistochemical expression is associated with local recurrence and poor prognosis in soft tissue sarcomas,respectively[J].Oncol Lett,2013,5(5):1527-1535.
15 Ch'Ng E,Tomita Y,Zhang B,et al.Prognostic significance of CD100 expression in soft tissue sarcoma[J].Cancer,2007,110(1): 164-172.
16 Chen Y,Zhang L,Lv R,et al.Overexpression of Semaphorin4D in-
dicates poor prognosis and prompts monocyte differentiation toward M2 macrophages in epithelial ovarian cancer[J].Asian Pac J Cancer Prev,2013,14(10):5883-5890.
17 Chen Y,Zhang L,Pan Y,et al.Over-expression of semaphorin4D,hypoxia-inducible factor-1alpha and vascular endothelial growth factor is related to poor prognosis in ovarian epithelial cancer[J].Int J Mol Sci,2012,13(10):13264-13274.
18 Wu HJ,Bondada S.CD72,a coreceptor with both positive and negative effects on B lymphocyte development and function[J].J Clin Immunol,2009,29(1):12-21.
19 Swiercz JM,Worzfeld T,Offermanns S.ErbB-2 and met reciprocally regulate cellular signaling via plexin-B1[J].J Biol Chem,2008,283(4):1893-1901.
20 Conrotto P,Valdembri D,Corso S,et al.Sema4D induces angiogenesis through Met recruitment by Plexin B1[J].Blood,2005,105(11): 4321-4329.
21 Zhou H,Yang YH,Binmadi NO,et al.The hypoxia-inducible factor-responsive proteins semaphorin 4D and vascular endothelial growth factor promote tumor growth and angiogenesis in oral squamous cell carcinoma[J].Exp Cell Res,2012,318(14):1685-1698.
22 Basile JR,Barac A,Zhu T,et al.Class IV semaphorins promote angiogenesis by stimulating Rho-initiated pathways through plexin-B[J].Cancer Res,2004,64(15):5212-5224.
23 Basile JR,Castilho RM,Williams VP,et al.Semaphorin 4D provides a link between axon guidance processes and tumor-induced angiogenesis[J].Proc Natl Acad Sci U S A,2006,103(24):9017-9022.
24 Sierra JR,Corso S,Caione L,et al.Tumor angiogenesis and progression are enhanced by Sema4D produced by tumor-associated macrophages[J].J Exp Med,2008,205(7):1673-1685.
25 Trusolino L,Comoglio PM.Scatter-factor and semaphorin receptors:cell signalling for invasive growth[J].Nat Rev Cancer,2002,2(4):289-300.
26 Soong J,Chen Y,Shustef EM,et al.Sema4D,the ligand for Plexin B1,suppresses c-Met activation and migration and promotes melanocyte survival and growth[J].J Invest Dermatol,2012,132(4): 1230-1238.
27 Swiercz JM,Kuner R,Offermanns S.Plexin-B1/RhoGEF-mediated RhoA activation involves the receptor tyrosine kinase ErbB-2[J].J Cell Biol,2004,165(6):869-880.
28 Wong OG,Nitkunan T,Oinuma I,et al.Plexin-B1 mutations in prostate cancer[J].Proc Natl Acad Sci U S A,2007,104(48): 19040-19045.
29 Suzuki K,Kumanogoh A,Kikutani H.Semaphorins and their receptors in immune cell interactions[J].Nat Immunol,2008,9(1):17-23.
30 Delaire S,Billard C,Tordjman R,et al.Biological activity of soluble CD100.II.Soluble CD100,similarly to H-SemaIII,inhibits immune cell migration[J].J Immunol,2001,166(7):4348-4354.
31 Liu H,Yang Y,Xiao J,et al.Semaphorin 4D expression is associated with a poor clinical outcome in cervical cancer patients[J].Microvasc Res,2014,93:1-8.
32 Malik MF,Ye L,Jiang WG.The Plexin-B family and its role in cancer progression[J].Histol Histopathol,2014,29(2):151-165.
33 Ding XJ,Li D,Huang XW,et al.Sema4D deficiency reduces colorectal carcinoma xenograft growth and vascularityin nude mice[J].Chinese Journal of Clinical Oncology,2014,41(14):885-889.[丁晓洁,李多,黄新伟,等.信号素4D影响直肠癌裸鼠移植瘤的血管新生[J].中国肿瘤临床,2014,41(14):885-889.]
(2014-09-10收稿)
(2015-01-02修回)
(编辑:郑莉)
Functions of semaphorin 4D in tumor progression
Lei ZHANG,Ying CHEN,Ke WANG
Ke WANG;E-mail:lychenying2004@126.com
Semaphorin 4D(SEMA4D),also known as CD100,is a protein that belongs to class IV semaphorin.Its physiologic role in the nervous system has been extensively explored.However,the roles of SEMA4D have extended beyond the traditionally studied territories.Collective data proved that SEMA4D has an important role in the regulation of immune system,angiogenesis,and tumorigenesis,among others.Specifically,SEMA4D enhanced the angiogenesis in malignant diseases.This review summarized the latest progression in the research on SEMA4D,including the structure,receptors,mechanism,and biological functions in tumor angiogenesis and progression.
SEMA4D,axon guidance,tumor,immunoregulation,angiogenesis

10.3969/j.issn.1000-8179.20141558
天津医科大学肿瘤医院妇瘤科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室(天津市300060)
*本文课题受国家自然科学基金项目(编号:81302250)和天津市卫生局科技基金项目(编号:2012KZ073)资助
王珂lychenying2004@126.com
张磊专业方向为妇科肿瘤临床诊治。
E-mail:zhanglei008_008@126.com
