空心莲子草浸提液对海菜花种子萌发及幼苗生长的影响*
2015-11-22钱晓莉吴永贵何天容付天岭李春江
钱晓莉,吴永贵,何天容,付天岭,王 娅,李春江
(1.贵州大学 应用生态研究所,贵州 贵阳 550025;2.贵州大学 资源与环境工程学院,贵州 贵阳 550025)
空心莲子草[Alternanthera philoxeroides Mat.Griseb.]是被人们广泛关注的典型外来入侵恶性杂草,其入侵后可通过对光温及营养的竞争对其他生物产生强烈的种群抑制作用,尤其是根系分泌物、植株枯落物等对其他植物有显著的抑制作用,从而影响生物多样性及生态系统的稳定性[1~4]。海菜花[Ottelia acuminata(Gagnep.)Dandy]为国家II 级保护植物,作为珍稀物种主要分布在特定的湖泊湿地环境中,具有重要的生态价值和环境指示作用[5,6]。贵州高原湿地系统中海菜花分布面积急剧减少,笔者在草海及花溪湿地中发现,凡空心莲子草所到之处海菜花种群均受到严重影响甚至消失殆尽。作为湿地生物多样性中极具特色的珍稀物种的保护,目前有关海菜花研究的相关文献较为缺乏,关于空心莲子草在何种程度上影响海菜花种群的消失及相关机理,目前尚无研究报道。本论文以贵州高原湿地中广泛存在的空心莲子草和受到特殊保护的海菜花为研究对象,拟通过野外实地调查和实验室内开展空心莲子草对海菜花种子萌发的影响研究,相关研究结果可为高原湿地中国家Ⅱ级珍稀物种的保护和培育提供科学依据。
1 试验方法
1.1 预实验
(1)入侵生物植株浸提液的制备:将采集的空心莲子洗净,用滤纸吸干表面附着水分,用电子天平称取一定数量(100 g)植株用碎样器将其破碎后置于1000 mL 的蒸馏水中20 ℃、110 r/min 振荡24 h,过滤得浸提母液(100 mg/mL),放置冰箱4 ℃冷藏备用(储存时间不超过48 h),使用前取出放置至室温待用。
(2)浸种与播种:挑选成熟饱满的海菜花种子,用自来水冲洗3 次,再用蒸馏水冲洗3 次,将种子置于蒸馏水中,浸泡12 h。播种于直径10 cm 并铺有滤纸的培养皿中,每个培养皿中放20 粒。先进行预备试验,以植株质量浓度计,浸提液浓度分别设为0(对照,曝气自来水)、5‰、10‰、5%、10%、30%、50%、70%、100%,每个处理做3 个重复,将培养皿置于实验桌上,每3 天更换一次浸提液,当胚根突破种皮2 mm 视为萌发,根据预备试验结果得出确定正确的试验浓度区间,其结果显示,除了浓度为零时不发芽,其他浓度均有发芽,因此浓度区间为0~100%,为正式试验浓度设置提供依据。
1.2 正式试验
(1)空白对照实验:根据预备试验中确定的浓度区间,以两个浓度端点为最低试验浓度和最高试验浓度值,在两者之间以等对数间距设置6 个实验浓度,分别为0(对照,曝气自来水)、10%、30%、50%、70%、100%,每个处理做3 个重复,按预备试验的步骤和实验条件开展发芽实验。每天记录发芽数,第7 天计算发芽势,14 天后计算发芽率。
(2)幼苗生长实验:选取饱满、大小均一的海菜花种子用自来水浸泡12 h,选取同期发芽的种子均匀放于铺有双层滤纸的培养皿中,每皿20 粒,至于25 ℃光照培养箱,培养条件:黑暗12 h,光照12 h。每天补充适量不同浓度的浸提液和蒸馏水,每个处理3 个重复,第6 天测量幼苗的苗高(SH)和主根长(TL)、鲜重。
1.3 指标测定
根据《国际种子检验规程》要求[7],第7 天计算发芽势,发芽势=已发芽种子数/供试种子数×100%;第14 天计算发芽率,萌发率(GR)=n(已发芽种子数)/N(供试种子数)×100%。
1.4 数据分析
海菜花种子发芽率、发芽势、幼苗鲜重、苗长等数据使用大型DPS 软件进行单因素统计分析,所有数据均为3 次测量平均值±标准误。所有图形均用Origin8.5 绘制。
2 结果与讨论
2.1 不同浓度的空心莲子草浸提液对海菜花种子发芽势的影响
种子萌发是植物生活史的重要阶段,发芽势是反应种子萌发过程的关键性指标。由图1 可知,连续培养七天后,随着空心莲子草浸提液浓度的提高,各组海菜花种子的发芽势整体呈先上升后下降的趋势,发芽势变化范围在0%~27.5%之间,平均为6.63%。当浸提液浓度达到50%时,海菜花种子发芽势显著上升,比对照的0%上升了27.5%。之后随着浸提液浓度增加种子发芽势逐渐降低。由表1 单因素分析可知,浸提液浓度为50%时,该处理与其他处理间存在极显著差异(P <0.0001)。表明50%前空心莲子草浸提液对种子萌发起促进作用,此后促进作用逐渐降低。分析原因是:在低浓度范围内,空心莲子草根茎等中释放的微量元氮磷等给种子萌发提供营养条件促进了种子萌发,而随着浸提液浓度和培养时间的增加,促进了空心莲子草中某些化感物质释放,贾黎明[8,9]等研究发现,化感物质对种子萌发的影响与浓度密切相关,胜红蓟素对萝卜和稗草种子发芽作用表现为低浓度促进作用,高浓度抑制作用,浸提液浓度升高抑制了海菜花种子呼吸作用,改变种子萌发过程的关键性酶,破坏种子萌发过程中各生理代谢的稳态和协调,从而抑制了海菜花种子萌发,以便自身的迅速生长[10],这与前人研究结果相似。对于化感物质的种类对海菜花种子萌发影响将做进一步研究。
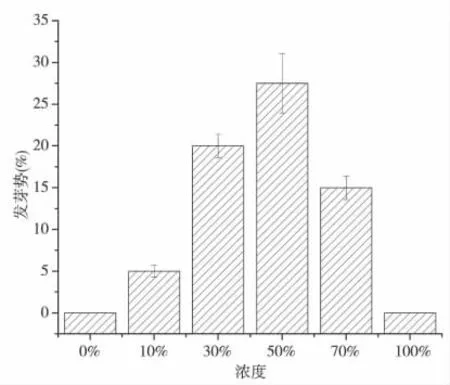
图1 不同浓度空心莲子草浸提液对海菜花种子发芽势的影响
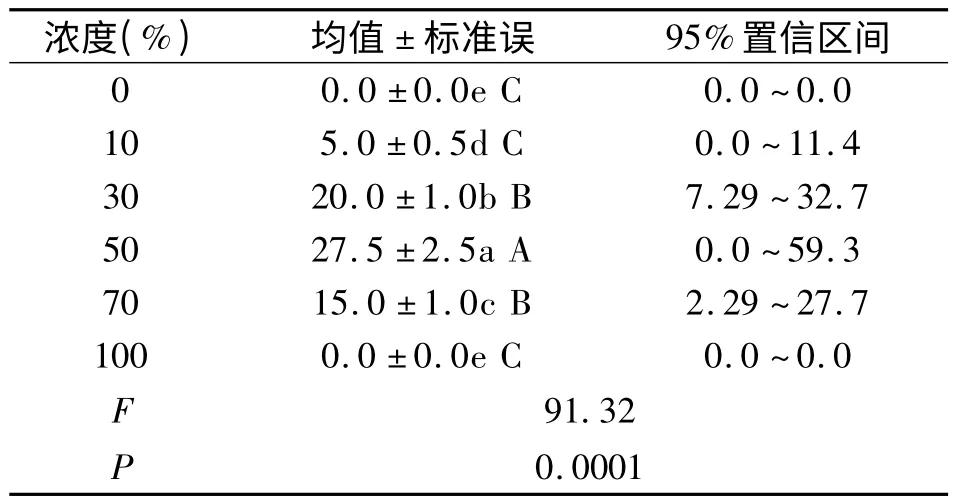
表1 空心莲子草浸提液对海菜花种子发芽势单因素统计分析表
2.2 不同浓度空心莲子草浸提液对海菜花种子发芽率的影响
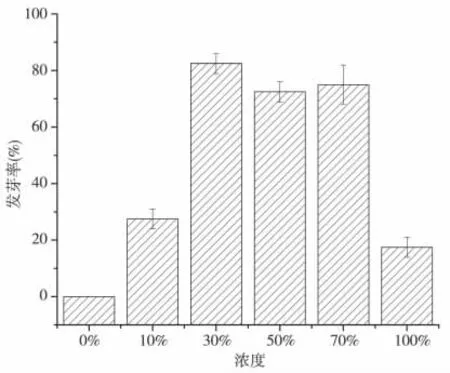
图2 不同浓度空心莲子草浸提液对海菜花种子发芽率的影响
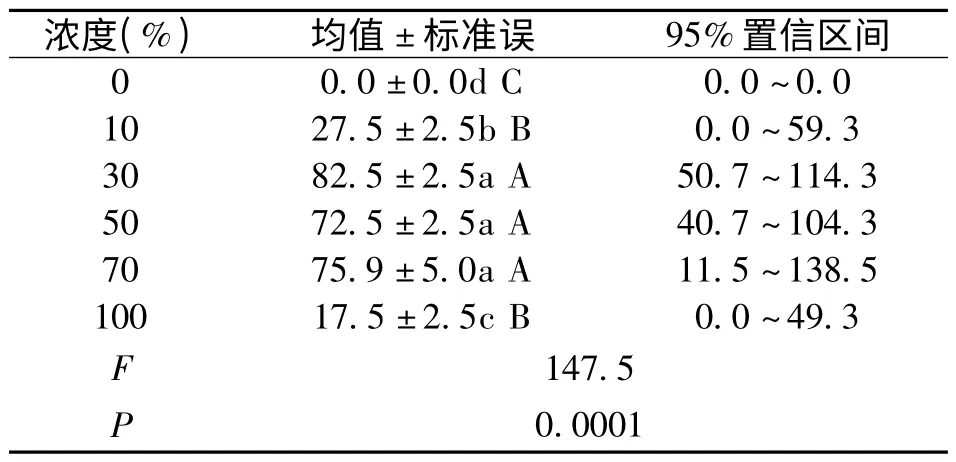
表2 空心莲子草浸提液对海菜花种子发芽率单因素统计分析表
种子萌发是一年生植物生活史的开端,对物种更新作用至关重要,种子发芽率降低可能会降低植物在群落中的多度[11],因而发芽率与植物的种群动态有密切关系。图2 显示,空心莲子草浸提液浓度由0 增至100%,经过培养14 天后,各组海菜花种子的发芽率整体呈先上升后下降的趋势。发芽率变化范围为0%~82.5%,平均为25.1%。表2可知,与对照相比,不同浓度浸提液对海菜花种子萌发影响明显。30%的空心莲子草浸提液浓度处理下海菜花种子发芽率显著提高,该处理与各处理间存在显著差异(P <0.0001)。50%~70%浓度间海菜花种子发芽率无显著变化,当浓度升高到100%时,该处理与其他处理间存在显著差异(P <0.05),明显可见,低浓度与高浓度浸提液对菜花种子发芽率影响显著,低浓度促进作用增加,高浓度促进降低。这与杜照奎等[12]研究空心莲子草对高丹草种子萌发影响结果相似。分析原因可能是,在实验过程为提高种子萌发,加入外源氯化钙,钙作为植物生长发育必需的大量元素之一,可提高溶液中α-淀粉酶的活性,从而促进海菜花种子萌发的效应;而随着浸提液浓度的增加,溶液中同时存在着其他Na 离子等会竞争Ca 在细胞膜上的位点破坏了质膜的完整性以及影响Ca 信号系统的正常发生和传递,从而对种子萌发造成渗透胁迫,种子萌发过程中的关键酶受到抑制,因此对种子萌发的抑制作用增强[13,14]。化感物质几乎存在于植物的所有器官中,影响种子萌发的因素不仅与化感物质种类、受体植物有关,同时与化感物质浓度有关[15]。随着空心莲子草浸提液浓度升高,根茎等释放大量化感物质,改变了种子体内呼吸、激素平衡等,从而降低海菜花种子发芽率。这与前人研究结果相似[8]。
2.3 不同浓度空心莲子草浸提液对海菜花幼苗苗长的影响
图3 所示,随着空心莲子草浸提液浓度的增加,各组海菜花幼苗的苗长整体呈现先上升后下降的趋势,且在浸提液浓度为30%时,幼苗苗长达到最大值,为2.03 cm。如表3,试验组的苗长与对照组存在显著差异(P <0.05)。30%浓度后对幼苗生长促进作用逐渐降低。图4 可见,随着空心莲子草浸提液浓度的增加,各组海菜花幼苗的根长逐渐减小。且在空心莲子草浸提液浓度为10%时,根长达最大值(0%时种子不发芽,根长视为零)0.5 cm。其原因可能是,空心莲子草浸提液中含有对海菜花根长有抑制作用的化感物质,化感物质含量随空心莲子草浸提液浓度的增加而增加,而海菜花幼苗的根对空心莲子草化感物质较为敏感,所以高浓度的空心莲子草浸提液根长较短,而低浓度的较长。

图3 不同浓度空心莲子草浸提液对海菜花幼苗生长的影响
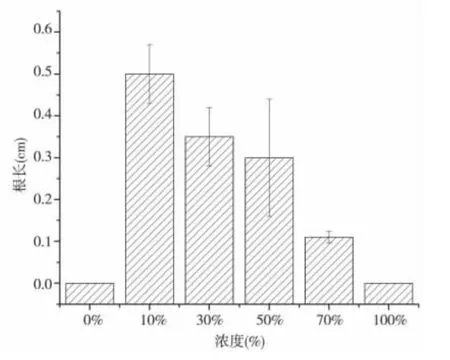
图4 不同浓度空心莲子草浸提液对海菜花根长的影响
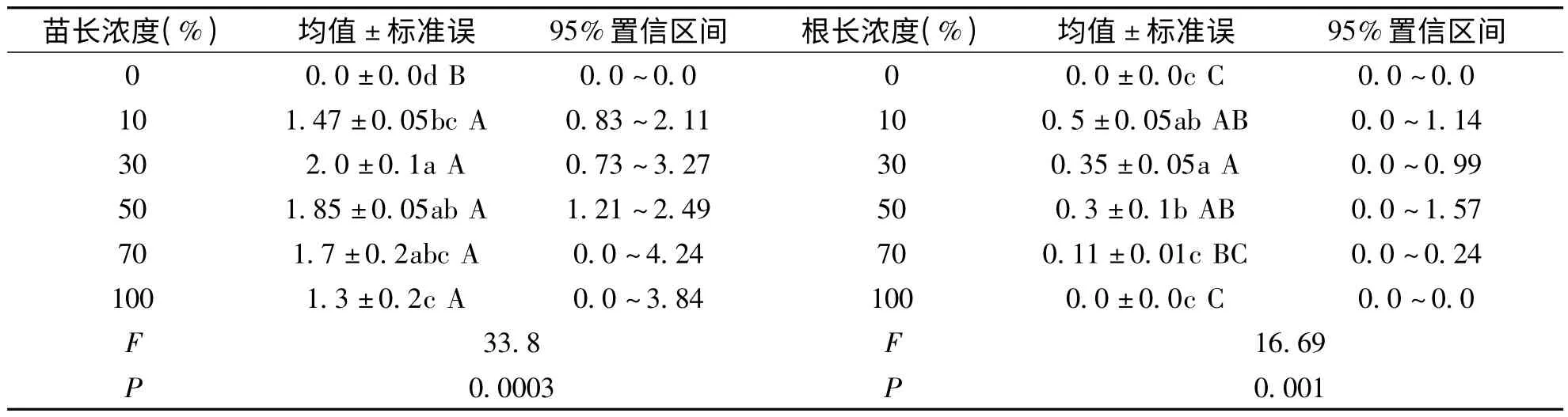
表3 空心莲子草浸提液对海菜花苗长、根长单因素统计分析表
2.4 不同浓度空心莲子草浸提液对海菜花幼苗鲜重的影响
图5 可知,随着空心莲子草浸提液浓度的增加,各组海菜花幼苗的鲜重整体呈先增加后减少的趋势,且在空心莲子草浸提液浓度为30%时,各组海菜花幼苗的鲜重最大,为11.2 mg,不同浓度浸提液对海菜花鲜重影响显著(见表4)。分析原因是种子萌发及其幼苗生长过程中,随着浸提液浓度升高降低了溶液的水势,明显降低种子及幼苗的吸胀速率,造成种子吸水困难,严重影响降低幼苗鲜重,同时也降低种子萌发率,这与喻泽莉等研究结果相似[16~18]。
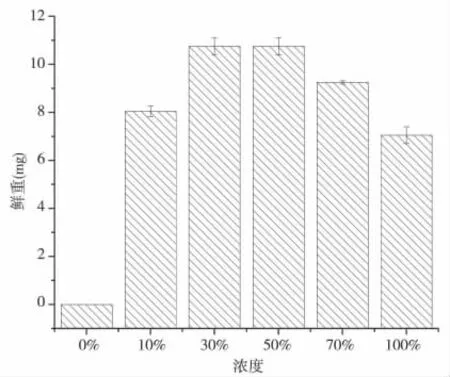
图5 不同空心莲子草浸提液对海菜花幼苗鲜重的影响
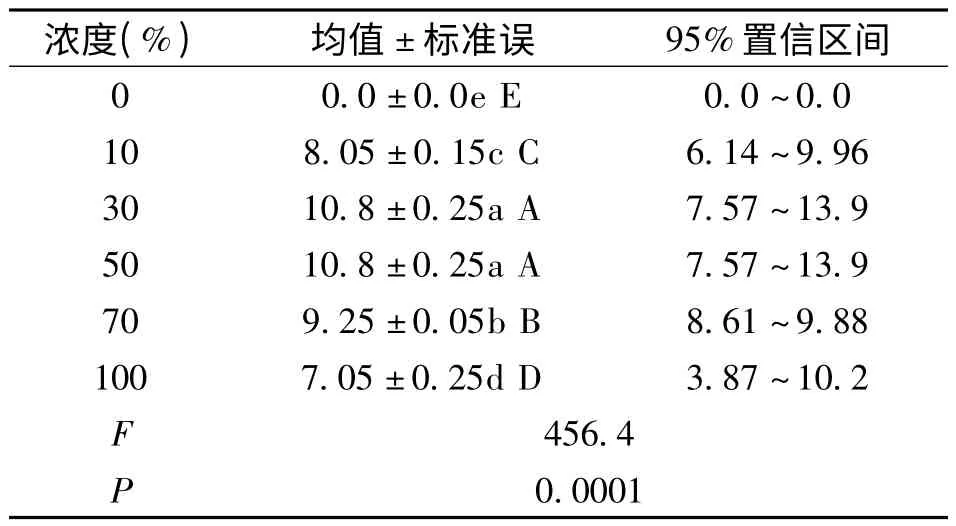
表4 空心莲子草浸提液对海菜花鲜重单因素统计分析表
3 结论
(1)空心莲子草对海菜花种子的发芽势、发芽率影响显著,浸提液浓度为50%时对海菜花种子发芽势促进作用极显著(P <0.0001);浸提液浓度为30%时对海菜花种子发芽率促进作用极显著(P <0.0001)。
(2)空心莲子草浸提液浓度低于30%时,海菜花幼苗苗长、鲜重促进作用增强;空心莲子草浸提液浓度低于10%时对海菜花幼苗的根长促进作用明显。
[1]Meekins JF,McCarthy BC.Competitive ability of AUiaria petiolata(garlic mustard,brassicaceae),an invasive,nonindigenous forestherb[J].Int J Plant Sci,1999,160(4):743-752.
[2]Callaway RW,Aschehoug ET.Invasive plants versus theirnew and old neighbors:a mechanism for exotic invasion[J].Science,2000,290:521-523.
[3]Sandberg C L,Burkhalter A P.Alligatorwecxl control with glyphoc-ateAlter nantheral,hilozeroides,in aquatic environments.Proc.South[J].Weed Sci.SOC,1983,36:336-339.
[4]Grie R J,S.sa A.Cordo H.A new neotmpical species of Clinodiplosis(biptera:cecidomyiidae)injurious to alligatorweed,Alternanthera philoxeroides(amaranthaceae)[J].Proceedings of the Entomological Society of Washington,2004,106:305-311.
[5]淮虎银.外来植物空心莲子草分布的生境多样性及其特征[J].杂草科学,2003(1):18-21.
[6]徐正浩,王一平.外来植物的成灾机理及其防除对策[J].生态学杂志,2004,23(3):124-127.
[7]国际种子检验协会(ISTA).1996 国际种子检验规程[M].北京:中国农业出版社,1999.
[8]贾黎明,翟明普,尹伟伦.辽东栎混交林中生化他感作用的研究[J].林业科学,1995,31(6):491-498.
[9]杨期和,叶万辉,廖富林,等.植物化感物质对种子萌发的影响[J].生态学杂志,24(12):1459-1465.
[10]张远兵,刘爱荣,吴倩.空心莲子草浸液对水稻种子萌发和幼苗生长的化感效应[J].热带作物学报,2009,30(10):1526-1531.
[11]李雪华,蒋德明,刘志民,等.温带半干旱地区一年生植物种子的萌发特性[J].生态学报,2006,26(4):1194-1196.
[12]杜照奎,李均敏,钟章成.空心莲子草水浸提液的化感作用及化感物质分析[J].西南大学学报:自然科学版,2012,34(8):53-60.
[13]Combeau C,Provost J,Lancelin F,et a1.RPRII2378 and RPRl15781:Two representatives of a low family of microtubuleassembly inhibitors[J].Mol Pharmaeol,2000,57(3):553-563.
[14]何池全,赵魁义.植物的生化他感效应及其在湿地研究中的应用[J].生态学杂志,1999,18(4):46-51.
[15]马茂华,于凤兰,孔令韶.油蒿(Artemisia ordosica)的化感作用[J].生态学报,1999,19(5):670-676.
[16]Cramer GR.Displacement of Ca2+and Na+form the plasmalemma of rottcells[J].Plant Physiol,1985,79:207-211.
[17]边才苗.木荷种子萌发及对干旱胁迫的响应[J].福建林业科技,2005,32(3):112-115.
[18]喻泽莉,何平,张春平,等.干旱胁迫对决明种子萌发及幼苗生理特性的影响[J].西南大学学报:自然科学版,2012,34(2):39-44.
