CO2水合物生成的影响因素研究*
2015-11-22贾贞贞杨雪艳常爱香胡鸣鸣
贾贞贞,安 燕*,杨雪艳,常爱香,胡鸣鸣
(1.贵州大学 化学与化工院,贵阳 贵州 550025;2.贵州广播电视大学,贵阳 贵州 550004)
世界气象组织最新发布的《2013 年温室气体公报》指出,2013 年大气中的温室气体浓度继续增加,可长期留存的温室气体浓度创下自工业革命以来的记录新高,其中二氧化碳在大气中的浓度高达396 ppm。二氧化碳等温室气体排放造成的全球变暖[1]受到了人们的广泛关注,因此,二氧化碳的减排和处理已成为日益关注的焦点。
气体水合物是一种或多种气体(客体分子)在高压低温条件下和水作用形成的类似冰的、笼型结晶化合物[2]。在气体水合物中,水分子通过氢键形成笼型框架,客体分子则以范德华力与水分子相互作用包容在笼型框架内[3]。近年来,水合物法捕获二氧化碳因具有储气量高(每体积水合物理论上可以存储180 倍体积气体[4])和稳定性好等优点而受到广泛关注。海底高压低温的天然环境为水合物法捕获和封存二氧化碳提供了有利的条件。作为一种新型的二氧化碳存储方法,水合物法海底封存二氧化碳有着广阔的前景[5-6]。
目前,气体水合物技术在国内外的研究应用还不成熟,如何缩短诱导时间、提高水合物的反应速率和储气量及气体工艺的经济实用价值是实现水合物工艺技术应用的关键所在[7]。气体水合物的生成包括溶解、成核和生长3 个过程,其微观机理非常复杂。为加快水合物的反应速率,Karaaslan[8]使用3 种表面活性剂—直链烷基苯磺酸(阴离子型表面活性剂)、壬基酚乙氧基化物(非离子型表面活性剂)、季铵盐(阳离子型表面活性剂)—进行水合物实验,结果显示:阳离子型表面活性剂的浓度低时起促进作用,浓度高时相反;非离子表面活性剂的促进效果不明显;阴离子表面活性剂的促进效果最好。轩小波[9]在恒容条件下测量了不同温度对二氧化碳的水合反应气体消耗速率的影响,结果表明反应的诱导期都随着反应温度的升高而增加,气体的消耗速率随着温度的升高而降低。刘妮[10]研究了不同搅拌时机对CO2水合物生成特性的影响,研究发现与静态系统相比,合适的搅拌时机可以降低86%的能耗。但对水合物法捕获二氧化碳技术的影响因素进行综合研究并从热力学和动力学角度分析的报道还相对较少。本文通过实验分别研究了搅拌速率、温度和压力对CO2水合物生成过程的影响,并从热力学和动力学角度对实验现象进行解释。
1 实验装置及方法
1.1 实验材料
本实验所用气体为高纯CO2(99.995%),由青岛合利气体有限公司提供。由于纯水中CO2水合物的生成速率非常缓慢[11],本实验选用了6 mmol·L-1的表面活性剂十二烷基硫酸钠[4](SDS,纯度为GR,成都西亚化工股份有限公司提供)作为促进剂。实验用水为实验室自制的超纯水。
1.2 实验装置
水合物生成实验装置如图1 所示,主要由高压反应釜、恒温水浴、供气系统、温度和压力测量系统及数据采集系统组成。反应釜的主体接触物料材质为1Cr18Ni9Ti 不锈钢,有效容积为350 mL,最大工作压力10 MPa,工作温度范围20-50 ℃,反应釜内部配有磁力耦合搅拌装置,转速范围0~1000 rpm。利用夹套循环恒温水浴控制反应釜内的温度,其控温范围为0~20 ℃,精度为±0.1 ℃。反应釜内的温度由铂电阻温度传感器测量,精度为±0.1 ℃。由压力传感器测量反应釜内的气体压力,精度为±0.001 MPa。实验过程中数据由电脑自动采集并储存。
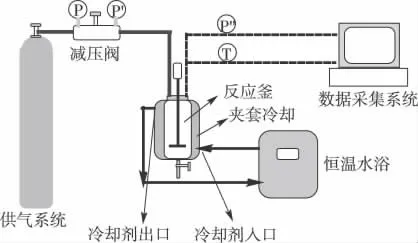
图1 实验系装置示意图
1.3 实验步骤
实验前先用高纯水清洗反应釜3 次,将配好的表面活性剂溶液加入反应釜中,密闭;用少量CO2冲洗反应釜3 次,排出反应釜内的空气;待温度降至设定值后,充CO2至实验压力,将转速调至实验值,开始计时并采集数据。
1.4 数据处理
t 时刻CO2的消耗量按式(1)计算:

式中Pt、Tt和Zt分别为反应器中CO2在t 时刻的压力、温度和压缩因子;P0、V0、T0和Z0分别为反应器中CO2的初始压力、体积、温度和压缩因子。
其中,压缩因子Zt[12]的计算公式为:
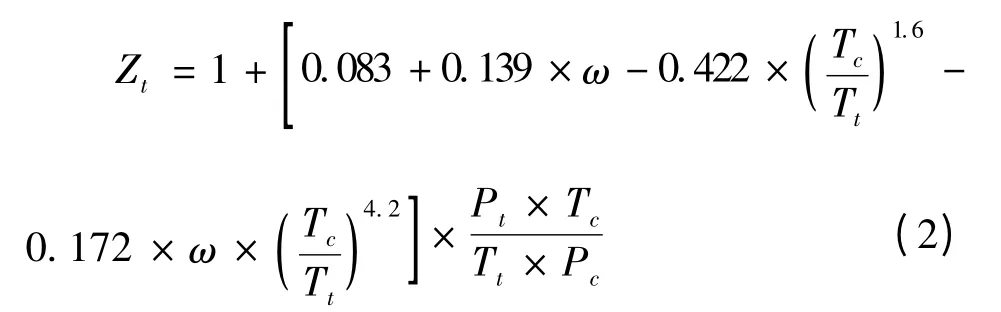
式中Tc、Pc和ω 分别代表CO2的临界温度、临界压力和偏心因子,其值分别为304.2 K、7.383 MPa 和0.224。
水合物的平均反应速率按式(3)计算:

式中Δn'和Δt'分别为反应阶段(诱导期结束至水合物停止生长阶段)的CO2消耗量和反应阶段对应的时间。
2 结果及分析
实验条件及结果如表1 所示

表1 实验条件及结果
2.1 搅拌速率对CO2水合物生成的影响
实验研究了搅拌速率(0 rpm,200 rpm,400 rpm,600 rpm,800 rpm)对CO2水合物生成过程的影响,其中SDS 溶液的体积为50 mL,实验的温度和初始压力分别为275.15 K、3 MPa。实验结果如图2 所示。
水合物的生成过程共包括3 个步骤:1 溶解2成核3 生长。如图2 所示从零时刻到气体消耗量达到约0.045 mol 时为CO2的溶解过程。从图中可以看出,随着搅拌速率的增大,CO2的溶解加快,CO2水合物的诱导期明显减小,CO2水合物的生长速率加快。由图2(a)和表1 可知,4 种不同搅拌速率中最长的诱导期(200 rpm,6.3 h)甚至不到不搅拌时诱导期(15 h)的一半。Hiai[13]认为水合物生成过程中首先在相界面处形成CO2水合物薄膜。由于水合物薄膜两侧存在CO2浓度差,CO2以分子扩散的方式穿过水合物层继续反应,这是CO2水合物反应的控速步骤[14]。本实验通过搅拌增大了CO2和反应液的接触面,并使气液接触面不断更新,从而大幅度提高CO2分子的扩散速率,促进CO2向反应液的溶解,促进CO2水合物成核,缩短诱导期。
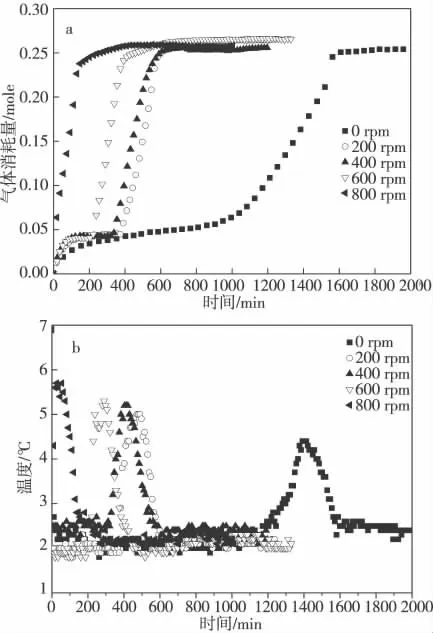
图2 搅拌速率(a 压力,b 温度)对CO2水合物生成的影响
水合物的生成过程为放热反应[15],故水合物的生成情况在一定程度上可由系统温度的峰值表示。由图2(b)水合物反应过程中的温度变化曲线可知,搅拌速率为800 rpm 时反应器内温度的峰值最大,升温滞留时间最短。由表1 可知,800 rpm 下CO2水合物的平均生长速率明显加快,为不搅拌时的4 倍。分析产生这一系列现象的原因可能为:通过搅拌促进传质和传热,使水合物反应速率增大。
2.2 温度对CO2水合物生成的影响
在搅拌速率的实验基础上,本实验采用相同的初始压力(3 MPa)和相同的搅拌速率(800 rpm),通过改变温度(273.65 K,274.15 K,275.15 K,276.15 K)进行了CO2水合物生成实验。图3为CO2水合物生成过程中气体消耗量随时间的变化曲线图。由图3 和表1 可知,几种实验温度下CO2水合物生成过程的诱导期均为6~10 min,且CO2气体消耗量差距不大。由此可见,在实验的温度范围内,温度变化对CO2水合物生成过程的溶解速率、诱导期及反应速率均无明显影响。
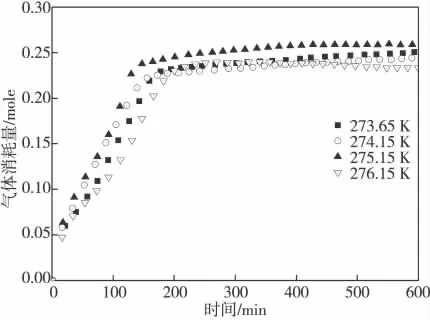
图3 温度对CO2水合物生成的影响
2.3 压力对CO2水合物生成的影响
在275.15 K、800 rpm 转速下,通过改变初始压力(2 MPa,2.5 MPa,3 MPa,3.5 MPa)进行CO2水合物生成实验。CO2水合物生成过程中气体消耗量随时间的变化曲线如图4 所示。由于实验在恒容密闭容器中进行,初始压力较低时(2 MPa,2.5 MPa)反应釜中的气体量相对较少,随着气体的消耗,系统压力降至相平衡值后停止反应,CO2消耗量不再上升。由图4 可以看出,2 MPa 时水合物生成过程的诱导期为497 min,远远大于3 MPa(137 min)和3.5 MPa (24 min)时的诱导期,且2 MPa时CO2水合物的平均生长速率较慢,分别为3 MPa、3.5 MPa 时的1/5 和1/3。2.5 MPa 时反应的诱导期和反应速率均比2 MPa 时明显提高。分析产生这些现象的原因可能为:CO2的溶解度受压力影响明显,实验中CO2水合物生成的差异是由于溶液中客体分子的浓度不同造成的。

图4 压力对CO2水合物生成的影响
本实验中水合物反应的诱导期和反应速率均受搅拌速率和压力影响明显,受温度的影响不大。气体水合物的成核由热力学条件控制,当实验条件达到相平衡条件以上时,成核过程快速发生,为微秒级[16]。而水合物反应过程中诱导期的长短及生长速率的快慢主要受客体分子的浓度的影响,可认为是动力学控制过程。机械搅拌可以使气液相界面不断更新,破坏阻碍客体分子向液相扩散的水合物膜,增大客体分子在溶液中的浓度。增大压力的实质就是提高客体分子在溶液中的浓度。Hiai[17]对CO2与水形成的水合物的微观机理进行了分子动力学模拟,他们认为水分子先形成五元环和六元环,CO2分子之间的相互作用形成的低电位对5 元环和6 元环形成笼形结构有促进作用。Matthew[16]通过经典分子动力学对甲烷气体水合物的成核和生长的机理进行了微观模拟,他们也提出客体分子与水具有协同作用[18-19](水分子间因氢键作用形成的面或笼子可吸附客体分子,被吸附的客体分子能延长水合物笼的寿命),客体分子与晶核的相对空间位置是影响晶核生长的关键因素之一。高浓度客体分子使有利于晶核生长的相对空间位置几率增大,晶核的生长速率加快。即客体分子浓度的增大有利于晶核快速生长,从而缩短诱导期、加快水合物的生长速率。
3 结论
本文研究了恒容时不同搅拌速率及不同温度和压力驱动力条件下CO2水合物生成的特性,结果表明:
(1)通过机械搅拌可促进水合物生成过程中的传质传热,显著缩短反应的诱导期,使系统快速进入水合物反应阶段,加快水合物生成速率,缩短整体反应时间;
(2)水合物生成过程为放热过程,温度对CO2水合物生成过程中的CO2溶解、诱导期和反应速率无明显影响;
(3)压力驱动力的增加会显著提高CO2在水中的浓度,有助于水合物晶核的长大,从而加速水合物生成过程。
[1]Richter F T,Ming Tingzhen,Caillol S.Fighting global warming by photocatalytic reduction of CO2using giant photocatalytic reactors[J].Renewable and Sustainable Energy Reviews,2013(19):82-106.
[2]Sloan E D.Clathrate hydrates of natural gas[M].3rd ed.New York:marcell Dekker,1998:55-92.
[3]Powell,H.M.The structure of molecular compounds[J].Chem Soc,1948(16):61-73.
[4]Zhong Y,Rogers R E.Surfactant effects on gas hydrate formation[J].Chemical Engineering Science,2000,55(19):4175-4187.
[5]Kang S P,Lee H.Recovery of CO2from flue gas using gas hydrate:thermodynamic verication through phase equilibrium measurements[J].Environmental Science & Technology,2000,34(20):4397-4400.
[6]Gabitto J,Tsouris C.Dissolution mechanisms of CO2hydrate droplets in deep seawaters[J].Energy Conversion and Management,2006,47(5):494-508.
[7]徐纯刚,李小森,陈朝阳.水合物法分离二氧化碳的研究现状[J].化工进展,2011,30(4):701-708.
[8]Karaaslan U,Parlaktuna M.Srfactants as Hydrate Promoters?[J].Energy & Fuels,2000,14(5):1103-1107.
[9]轩小波,刘妮,李菊,等.影响二氧化碳水合物生成特性的实验研究[J].天然气化工,2011(36):10-13.
[10]刘妮,李菊,陈伟军,等.机械强化法制备二氧化碳水合物的特性研究[J].中国机电工程学报,2011,31(2):51-54.
[11]刘妮,刘道平,谢应明.水合物法高效存储二氧化碳气体的实验研究[J].中国机电工程学报,2009:36-40.
[12]Smith J M,Van Ness H C,Abbott M M.Introduction to Chemical Engineering Thermodynamics[M].6th ed.New York:McGraw-Hill,2001:112-118.
[13]Hiai S,Okazaki K,Tabe Y.Mass transport phenomena of liquid CO2with hydrate[J].Waste management,1997,17(5-6):3531-360.
[14]Lund P C,Shindo Y.Study of the Pseudo-Steady-State Kinetics of CO2Hydrate Formation and Stability[J].International Journal of Chemical Kinetics,1994(26):289-297.
[15]Praveen L,Rajnish K,Peter E.Gas hydrate formation hydrate/carbon dioxide and nitrogen/carobon dioxide gas mixtures[J].Chemical Engineering Science,2007(62):4268-4276.
[16]Matthew R Walsh,Carolyn A Koh,E Dendy Sloan,Amadeu K Sum,David T Wu.Microsecond Simulations of Spontaneous Methane Hydrate Nucleation and Growth [J].Science,2009,326(20):1094-1098.
[17]Hiai S,Okazaki K,Tabe,Kawamura K.CO2clathrate-hydrate formation and its mechanism by molecular dynamics simulation[J].Energy Conversion and Management,1997(38):301-306.
[18]E.A.Mastny,C.A.Miller,J.J.D.Pablo.The effect of the water/methane interface on methane hydrate cages:The potential of mean force and cage lifetimes[J].Chem Phys,2008,129:1-8.
[19]Guo G J,Zhang Y G,Liu H.Effect of Methane Adsorption on the Lifetime of a Dodecahedral Water Cluster Immersed in Liquid Water:A Molecular Dynamics Study on the Hydrate Nucleation Mechanisms[J].Phys Chem,2007,111(6):2595-2606.
