热灭活牙龈卟啉单胞菌对人间充质干细胞增殖和成骨分化的影响
2015-11-21刘静波张冬梅赵海礁潘亚萍
刘静波, 李 琛, 郭 艳, 张冬梅, 赵海礁, 潘亚萍
(中国医科大学口腔医学院 辽宁省口腔医学研究所: * 牙周科, ** 中心实验室, 辽宁 沈阳 110002)
热灭活牙龈卟啉单胞菌对人间充质干细胞增殖和成骨分化的影响
刘静波*, 李 琛*, 郭 艳**, 张冬梅*, 赵海礁*, 潘亚萍*
(中国医科大学口腔医学院 辽宁省口腔医学研究所:*牙周科,**中心实验室, 辽宁 沈阳 110002)
目前: 探讨热灭活牙龈卟啉单胞菌(Pg)对人间充质干细胞(HMSCs)增殖和成骨分化的影响。方法:①将常规培养24 h后的HMSCs随机分为2组, 实验组加入热灭活Pg,对照组加入等量无菌PBS, 共同培养24 h后,用细胞计数试剂盒-8检测两组细胞的增殖活性; ②将常规培养24 h后的HMSCs随机分为3组,实验组加入热灭活Pg,对照组和基线组加入等量无菌PBS继续培养;待细胞汇合度达90%时,取基线组细胞直接用于ALP活性及成骨相关基因的PCR检测;而实验组和对照组则再进行成骨诱导培养14 d后,采用RT-PCR法检测其RUNX- 2、ALP mRNA的表达水平。结果:热灭活Pg与HMSCs共同培养24 h后,其细胞的增殖虽明显低于对照组(P<0.05),但其细胞形态则与对照组基本一致;成骨诱导14 d后, 实验组细胞中的ALP活性和成骨相关基因RUNX- 2、ALP mRNA的表达水平均低于对照组(P<0.05),高于基线组(P<0.05)。 结论:HMSCs在热灭活Pg刺激下增殖和成骨能力明显降低。
牙龈卟啉单胞菌(Pg); 成骨分化; 细胞增殖; 成骨分化
[DOI] 10.15956/j.cnki.chin.j.conserv.dent.2015.12.002
[Chinese Journal of Conservative Dentistry,2015,25(12): 709]
牙周炎是发生于牙周支持组织的慢性炎症性疾病,是我国成年人失牙的主要原因之一,且与多种系统性疾病的发生发展关系密切[1]。当牙周组织因炎症被破坏后,其结构和功能的重建一直是牙周病学研究领域中的重点和难点。牙龈卟啉单胞菌(Porphyromonasgingivalis,Pg)是与牙周炎密切相关的红色复合体中的重要成员,被认为是毒力最强的牙周致病菌之一。本课题组前期研究表明,牙周基础治疗后6周时,在牙周炎患者的炎症得到控制的龈沟内有Pg开始重新定植[2]。由于这一时期正是牙周组织再生的关键期,因此也说明Pg对牙周组织再生的影响不容忽视。本实验拟采用热灭活Pg刺激人间充质干细胞(HMSCs),并观察其对HMSCs增殖和成骨分化的影响,以期为研究牙周炎患者牙周组织再生提供实验依据。
1 材料和方法
1.1 热灭活Pg菌悬液的制备
首先将PgATCC 33277菌株(中国医科大学附属口腔医院口腔生物学教研室保存)接种于BHI固体培养基(添加氯化血红素、维生素K和无菌脱纤维羊血),置于37 ℃厌氧条件(800 mL/L N2、100 mL/L H2、100 mL/L CO2)下培养7 d后,再转种于BHI液体培养基继续厌氧培养过夜;然后离心(9 000 r/min)10 min并收集细菌,以新鲜配置的磷酸盐缓冲液(PBS)洗涤1次并重悬后,用紫外分光光度计进行活菌计数。计数后的Pg菌悬液经70 ℃孵育1 h,并用0.22 mm无菌滤器过滤[3]后,从中取10 mL接种于BHI固体培养基进行厌氧培养(条件同上);连续培养5 d,并确定无菌落形成后,即可将其用于后续实验。
1.2 HMSCs的培养和传代
取脂肪来源的HMSCs(Lifeline,美国)接种于专用间充质干细胞生长培养液 (StemLife LL-0034)(Lifeline,美国)中,并置于37 °C、50 mL/L CO2的条件下进行培养。隔日换液1次,待细胞汇合度达90%时,进行传代。取第3代细胞进行实验。
1.3 灭活Pg对HMSCs增殖影响的观察
取第3代对数生长期HMSCs,用25 g/L的胰蛋白酶(Gibco,美国)消化后,以1 000 /孔的细胞密度接种于96孔板,并于每孔中各加入100 μL专用间充质干细胞生长培养液,置于37 ℃、50 mL/L CO2条件下进行培养。培养24 h后,将细胞随机分为2组: 实验组按照细菌 ∶细胞=100 ∶1的比例加入热灭活的Pg菌悬液[4]; 对照组加入等体积的无菌PBS。两组继续培养24 h后,用倒置相差显微镜(上海研润光机)观察各组细胞的生长情况;然后分别取各组细胞按照细胞计数试剂盒-8(大连美仑生物)的操作说明,于每孔中各加入10 μL细胞计数试剂并继续培养2 h后,用酶标仪(SmartSpec 300)(Biochrom,日本)分别测定各孔450 nm波长处的吸光度值(OD值)。
1.4 灭活Pg对HMSCs成骨分化影响的观察
1.4.1 分组处理和成骨诱导培养
取第3代对数生长期HMSCs以10 000 /孔的细胞密度接种于24孔板, 每孔中各加入1 mL专用间充质干细胞生长培养液,置于37 ℃、50 mL/L CO2条件下培养24 h后,将细胞随机分为实验组、对照组和基线组, 实验组按照细菌 ∶细胞=100 ∶1比例加入Pg热灭活菌悬液;对照组和基线组加入等体积无菌PBS继续培养。待细胞增殖达90%汇合时,收集基线组细胞直接用于ALP和成骨相关基因的检测;实验组和对照组细胞用无菌PBS洗涤2次后再加入新鲜配置的成骨诱导液[5](含50 μg/mL 维生素C、 10 mmol/L β-甘油磷酸酯的间充质干细胞生长培养液)进行成骨诱导培养,每3 d 换液1次,诱导培养至14 d后用于ALP和成骨相关基因检测。
1.4.2 ALP检测
分别取上述各组细胞用细胞裂解液裂解细胞后加入显色底物和检测缓冲液,并置于37 ℃条件下孵育30 min,然后用酶标仪分别测定其405 nm波长处的吸光度值(OD值)。以上所有操作均严格按照ALP检测试剂盒(上海碧云天)说明书。
1.4.3 成骨相关基因表达的PCR检测
分别取上述各组细胞用TRIzol 法提取细胞总RNA,并用高性能反转录试剂盒(Life technologies,美国)合成cDNA;然后以cDNA为模板,以GAPH作为内参照,用ABI7700real-time PCR仪和SYBR GREEN试剂盒(Qiagen,美国)分别对RUNX-2、ALP基因进行RT-PCR分析。所用引物由宝生物公司合成,具体引物序列参照文献[6]。PCR反应体系共20 μL,分别为:SYBR Premix Ex Taq Ⅱ 10 μL、上下游引物各0.8 μL、cDNA模板2.0 μL、ROX Reference DyeⅡ0.4 μL、dH2O 6.0 μL。PCR反应条件为:95 ℃预变性30 s后,95 ℃、5 s,58 ℃、34 s,40个循环。PCR反应结束后,采用2-ΔΔCt方法计算各基因的mRNA相对浓度。试验重复 3次。
1.5 统计学分析
2 结果
2.1 热灭活Pg对HMSCs增殖的影响
HMSCs与热灭活Pg共同培养24 h后,倒置相差显微镜观察,其细胞形态与对照组基本一致,呈多角形,且贴壁生长;但其细胞汇合度则低于对照组(图1)。细胞计数试剂盒-8检测结果显示,实验组细胞的增殖情况(OD值)显著低于对照组(P<0.05)(图2)。
实验组 对照组

*与对照组相比P < 0.05
2.2 热灭活Pg对HMSCs成骨分化的影响
2.2.1 热灭活Pg对ALP活性的影响
ALP活性检测结果显示:实验组(热灭活Pg刺激后的HMSCs)和对照组(未经热灭活Pg刺激的HMSCs)细胞经成骨诱导14 d后,两组细胞中的ALP活性均较基线组(未经成骨诱导的HMSCs)明显升高(P<0 .05 );其中以对照组的ALP活性升高最明显,与实验组相比差异亦有统计学意义(P<0.05)(图3)。
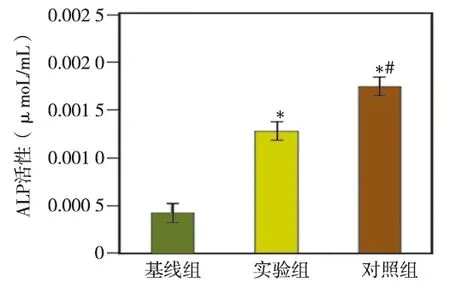
*与基线组相比P<0.05;#与实验组相比P<0.05
2.2.2 热灭活Pg对RUNX-2和ALP基因表达的影响
RT-PCR检测结果显示:实验组(热灭活Pg刺激的HMSCs)和对照组(未经热灭活Pg刺激的HMSCs)细胞经成骨诱导14 d后, 两组细胞中的RUNX-2和ALP基因表达水平均较基线组(未经热灭活Pg刺激和成骨诱导的HMSCs)明显升高(P<0.05 );其中对照组升高最明显,两种基因的表达水平均明显高于实验组(P<0.05 )(图4)。

*与基线组相比P<0.05;#与实验组相比P<0.05
3 讨论
牙周炎是以牙周组织破坏为特征的感染性疾病,当牙周组织因炎症被破坏后,重建牙周组织的正常生理结构和功能一直是牙周治疗追求的最终目标。Pg是目前公认的牙周致病菌之一,可产生多种毒力因子和蛋白,在牙周炎的发生发展过程中发挥着重要的作用。牙周基础治疗是减少或清除Pg的定植,但在治疗后短期内Pg又会在龈下区域重新定植[2, 7]。此时,牙周组织的再生不可避免的会受到龈下微环境中细菌(尤其是Pg)的影响。因此,本研究通过构建热灭活Pg(热灭活Pg能够保留大部分的细菌功能蛋白)刺激HMSCs模型来模拟机体龈下炎症微环境,以探讨Pg蛋白对HMSCs增殖和成骨分化的影响,以期为牙周炎患者牙周组织再生的研究提供参考。
以往研究表明,HMSCs能够重建包括牙周韧带、牙骨质、牙槽骨在内的全部牙周组织,已成为牙周组织再生可以选择的细胞源之一,从而为重建牙周组织的正常结构创造了便利条件[8-9]。目前国内外研究主要使用牙周膜细胞和骨髓间充质干细胞作为牙周再生的种子细胞。本研究选用的脂肪来源的HMSCs与上述两种细胞相比,获取更加方便,且对供体创伤较小,具有更广阔的临床应用前景。
Krebirel等通过构建Pg和HMSCs共培养模型进行研究发现,在培养72 h后仍有40%的细胞存活,其细胞因子IL-8的分泌水平较低[10]。本实验中发现,热灭活Pg与HMSCs共同培养24 h后,虽能明显抑制HMSCs的增殖,但仍有大量细胞存活,其形态与对照组相比亦无明显差异,仅细胞汇合度有所下降。该结果提示,部分HMSCs在Pg刺激条件下仍能够存活并增殖,与Krebirel等的实验结果相似。
ALP是成骨细胞及干细胞成骨分化时的一种细胞表面标志性酶,其表达水平会随着细胞成骨分化程度的增加而增强;RUNX-2是参与调控间充质干细胞向成骨方向分化的特异性转录因子,两者均为骨骼形成和发育的关键性标志基因。有研究发现,Pg脂多糖与牙周膜细胞共同培养后,能够显著抑制牙周膜细胞的ALP活性,及其胶原蛋白1和骨钙素的产生[11]。本研究中发现,对热灭活Pg刺激的HMSCs再进行成骨诱导14 d后,与未经成骨诱导的基线组相比,其细胞中的RUNX-2和ALP基因表达水平均明显上调;但与对照组相比,两基因的表达水平均明显降低。同时还发现,成骨诱导14 d时的ALP活性检测结果与RT-PCR 检测结果的变化趋势一致。以上结果提示,HMSCs在Pg蛋白的刺激下仍能进行成骨分化,但与未经Pg蛋白刺激HMSCs相比,其成骨能力显著降低。
[1]路凯,闫福华. 牙周病与全身健康[J]. 中国实用口腔科杂志,2009,2(4):203-206.
[2]刘静波,林莉,潘亚萍,等. 牙周炎患者基础治疗后牙龈卟啉单胞菌的定植研究[J]. 中华口腔医学杂志,2008, 43(8):478-482.
[3]Khalaf H, Bengtsson T. Altered T-Cell responses by the periodontal pathogenPorphyromonasgingivalis[J].PLoSOne, 2012,7(9):e45192.
[4]Yee M, Kim S, Sethi P,etal.Porphyromonasgingivalisstimulates IL-6 and IL-8 secretion in GMSM-K, HSC-3 and H413 oral epithelial cells [J].Anaerobe, 2014,28(8):62-67.
[5]Uddin SM, Qin YX. Enhancement of osteogenic differentiation and proliferation in human mesenchymal stem cells by a modified low intensity ultrasound stimulation under simulated microgravity [J].PloSOne,2013,8(9):e73914.
[6]Polini A, Pisignano D, Parodi M,etal. Osteoinduction of human mesenchymal stem cells by bioactive composite scaffolds without supplemental osteogenic growth factors [J].PLoSOne,2011,6(10):e26211.
[7]Teles FR, Teles RP, Uzel NG,etal. Early microbial succession in redeveloping dental biofilms in periodontal health and disease [J].JPeriodontalRes, 2012, 47(1):95-104.
[8]Mathur S, Chopra R, Pandit IK,etal. Stem cell research: applicability in dentistry [J].IntJOralMaxillofacImplants,2014, 29(2):e210-e219.
[9]Yan X, Yang F, de Vries R,etal. Cell-based approaches in periodontal regeneration: A systematic review and meta-analysis of periodontal defect models in animal experimental work [J].TissueEngPartBRev, 2015,21(5):411-426.
[10]Kriebel K1, Biedermann A, Kreikemeyer B,etal. Anaerobic co-culture of mesenchymal stem cells and anaerobic pathogens-a new in vitro model system [J].PLoSOne, 2013, 8(11):e78226.
[11]Kato H, Taguchi Y, Tominaga K,etal.PorphyromonasgingivalisLPS inhibits osteoblastic differentiation and promotes pro-inflammatory cytokine production in human periodontal ligament stem cells[J].ArchOralBiol, 2014,59(2):167-175.
The effect of heat-inactivatedPorphyromonasgingivalison the proliferation and osteogenic differentiation of human mesenchymal stem cells
LIU Jing- bo*, LI Chen, GUO Yan, ZHANG Dong- mei, ZHAO Hai- jiao, PAN Ya- ping
(*DepartmentofPeriodontology,SchoolofStomatology,ChinaMedicalUniversity,LiaoningInstituteofDentalResearch,Shenyang110002,China)
AIM: To investigate the effect of heat-inactivatedPorphyromonasgingivalis(HIPg) on the proliferation and osteogenic differentiation of human mesenchymal stem cells (HMSCs). METHODS: Cultured HMSCs were co- incubated with HIPgand PBS respectively for 24 h, then the cell proliferation was examined by a cell counter kit- 8. HMSCs were cultured with HIPgsupernatant (base line group) and sterile PBS(control group) until the cells reached 90% confluence. The cells in baseline group were collected, and the cells in treatment group and control group were incubated in osteogenic medium for 14 days. Then cells were harvested, alkaline phosphatase (ALP) activity was examined by ALP- kit and the mRNA level of ALP and RUNX- 2 was tested by RT- PCR. RESULTS: Heat- inactivatedPgreduced the proliferation of HMSCs (P<0.05) and ALP activity (P<0.05), decreased the mRNA level of RUNX- 2 (P<0.05) and ALP (P<0.05). CONCLUSION: Heat- inactivatedPgmay inhibit the proliferation and osteogenic differentiation of HMSCs.
Porphyromonasgingivalis(pg); osteogenic differentiation; cell proliferation; osteogenic differentiation
2015-07-03;
2015-10-19
国家自然科学基金(81200785)
刘静波(1980-),女,汉族,辽宁沈阳人。博士,讲师,主治医师
潘亚萍,E-mail:yap_nancy@yahoo.comm
R780.2
A
1005-2593(2015)12-0709-04
辽宁省教育厅科学研究一般项目基金(L2013311)
辽宁省自然科学基金(2013021030)
