调节Lnk/SCF-cKit反应轴改善糖尿病大鼠牙槽骨缺损早期愈合的研究
2015-11-21周海伦
李 昊, 周海伦, 王 琪, 李 伟
(1. 广西医科大学附属口腔医院口腔修复科, 广西 南宁 530021;2. 四川大学华西口腔医学院口腔疾病研究国家重点实验室, 四川 成都 610041)
调节Lnk/SCF-cKit反应轴改善糖尿病大鼠牙槽骨缺损早期愈合的研究
李 昊1, 周海伦1, 王 琪2, 李 伟2
(1. 广西医科大学附属口腔医院口腔修复科, 广西 南宁 530021;2. 四川大学华西口腔医学院口腔疾病研究国家重点实验室, 四川 成都 610041)
目的: 探讨调节Lnk/SCF- cKit反应轴对糖尿病大鼠牙槽骨缺损早期愈合的影响。方法:诱导大鼠形成糖尿病并构建牙槽骨缺损模型后,随机分为3组(n=10), 空白对照组不做任何处理, 阴性对照组注射空载体质粒, RNAi组注射靶向Lnk的RNA干扰质粒。28 d后处死各组大鼠,HE染色检测局部骨缺损愈合状况; 免疫印迹实验检测骨缺损部位Lnk、SCF、cKit以及ALP、OCN、ColIa1的表达水平。结果:构建缺损28 d后,RNA干扰组骨组织再生Lane- Sandhu评分高于各组糖尿病大鼠(P<0.05);免疫印迹实验显示,与其他各组糖尿病大鼠相比,RNA干扰组的Lnk蛋白表达水平降低,但SCF、cKit、ALP、OCN、ColIa1蛋白表达水平增加(P<0.05)。 结论:抑制Lnk表达、激活SCF- cKit通路可能改善糖尿病大鼠牙槽骨缺损的早期愈合。
Lnk; SCF- cKit反应轴; 糖尿病; 骨缺损
[DOI] 10.15956/j.cnki.chin.j.conserv.dent.2015.12.003
[Chinese Journal of Conservative Dentistry,2015,25(12): 713]
糖尿病是以高血糖为特征的代谢性疾病,我国的发病率逐年上升。糖尿病患者易发生骨愈合障碍,从而导致拔牙创愈合迟缓等后果,因此对多种口腔疾病治疗的实施产生不利影响。其发病机制复杂,常规疗法效果不佳,如何治疗糖尿病骨疾病是目前口腔医学领域的难点之一。
有研究表明,糖尿病高糖状态可影响细胞的骨向分化,进而影响骨缺损愈合过程,在临床调查和动物实验中均可发现,高血糖状态下骨缺损愈合时间比血糖正常者长[1-3]。某些蛋白对细胞骨向分化有重要调节作用,如改变这些蛋白的激活或表达水平,则可改变骨缺损修复进程,从而改善骨愈合状况[4-5]。近年发现,Lnk蛋白在多种信号转导过程中具有重要的桥梁作用,其能负性调节下游的SCF- cKit反应轴,进而影响细胞的分化等过程[6-7]。有研究显示,在多种病理状态下,Lnk蛋白的表达水平增加;抑制Lnk蛋白的表达可调节Lnk/SCF- cKit反应轴,从而促进实验动物骨折部位的骨形成[7-8],但在糖尿病状态下调节Lnk蛋白的表达,其下游SCF- cKit反应轴是否也发生改变,骨缺损愈合过程是否会受到影响,尚未见报道。
本研究拟用RNA干扰技术靶向抑制糖尿病大鼠牙槽骨缺损部位的Lnk蛋白的表达,观察缺损部位骨愈合情况,并检测SCF- cKit反应轴及成骨相关蛋白表达的变化,探讨改善糖尿病状态骨缺损愈合的方法,为探寻糖尿病骨疾病的治疗措施提供实验依据。
1 材料和方法
1.1 主要试剂和仪器
链脲佐菌素(Sigma,美国);靶向干扰Lnk基因的shRNA(Dharmacon,美国);靶向Lnk的shRNA的AteloGene胶体(广州波柏); Nikon 80i型显微镜(Nikon,日本);鼠抗单克隆抗体Lnk、SCF、ALP(alkaline phosphatase)、OCN(osteocalcin)、ColIa1(collagen type I a1)、GAPDH(glyceraldehyde-3-phosphate dehydrogenase)、通用型二抗(Santa Cruz,美国);兔抗多克隆抗体cKit(Abcam,美国);BIO- RAD Gel Doc XR+凝胶成像系统(BIO- RAD,美国)。
1.2 构建大鼠糖尿病模型
取SPF级4周龄SD雄性(购自成都达硕实验动物有限公司)大鼠40只(体质量60~80 g), 随机选取30只以高糖饲料联合链脲佐菌素法诱导其形成糖尿病(即经过高糖饲料喂养4周),空腹 12 h后腹腔注射链脲佐菌素35 mg/kg,1周后取尾静脉血检测空腹血糖值,超过11.1 mmol/L者为糖尿病模型构建成功[9],形成糖尿病后以常规鼠饲料喂养。30只糖尿病大鼠随机分为空白对照组、阴性对照组和RNA干扰组(n=10)。其余10只大鼠,不进行糖尿病诱导,均以常规鼠饲料喂食,作为正常对照组。处死前测定各组动物空腹血糖值确定是否为糖尿病状态。
1.3 构建大鼠牙槽骨缺损模型及缺损局部的RNA干扰
确定糖尿病模型构建成功后,参考本课题组前期实验方法[10],对所有大鼠构建双侧上颌牙槽骨缺损模型。以100 g/L的水合氯醛按250 mg/kg腹腔注射麻醉大鼠,在上颌第一磨牙腭侧分离牙龈及粘骨膜后,从近中向远中磨除部分骨质,制备长3 mm、宽1.5 mm、深1.5 mm的缺损后,缝合软组织并关闭创口。参考文献[8]方法,RNA干扰组: 在骨缺损立即注射5 μL含有1 μmol/L靶向Lnk的shRNA的AteloGene胶体(正义链5’-CGAGUUACCUCUUUCCUUA-3’);阴性对照组: 在骨缺损处注射5 μL含有1 μmol/L空载体质粒的AteloGene胶体;空白对照组及正常对照组不做注射。
1.4 HE染色检测骨缺损的愈合状况
在构建缺损28 d后,处死各组动物,取其左侧上颌组织于40 g/L多聚甲醛中固定24 h后,100 g/L EDTA溶液中脱钙3个月,每2 d换液1次。脱钙结束后,将组织常规脱水、包埋,所得标本蜡块按4 μm厚度连续切片,常规进行HE染色,在Nikon 80i型显微镜下观察术区,计算各组标本骨组织再生Lane- Sandhu评分。
1.5 免疫印迹实验检测骨缺损区的蛋白表达
处死各组大鼠后,取其右侧上颌组织并分离牙龈及粘骨膜后,取原术区组织在冰上裂解匀浆,12 000 g 离心40 min,取上清提取总蛋白,采用BCA法进行蛋白定量以及SDS- PAGE凝胶电泳,湿转后于50 g/L脱脂牛奶中封闭l h,鼠抗单克隆抗体Lnk、SCF(1 ∶500)、兔抗多克隆抗体cKit(1 ∶600)、鼠抗单克隆抗体ALP、OCN、ColIa1、GAPDH(1 ∶600)作为一抗并孵育2 h,通用型二抗(1 ∶1 000)孵育2 h,ECL显影,BIO-RAD Gel Doc XR+凝胶成像系统观察并比较目的蛋白与内参GAPDH条带平均灰度比值。
1.6 统计学分析
采用SPSS 18.0软件对数据(均数±标准差)进行分析,各组间比较采用成组设计方差分析,两两比较采用t检验,检验水准α=0.05。
2 结果
2.1 各组大鼠空腹血糖值比较
各组大鼠处死当日测其空腹血糖值,正常对照组为(5.752±1.043)mmol/L,低于糖尿病各组(P<0.05);空白对照组、阴性对照组与RNA干扰组的空腹血糖值分别为(17.594±2.125)mmol/L、(18.366±1.738)mmol/L、(17.102±1.465)mmol/L,3组间无统计学差异(P>0.05)。
2.2 各组大鼠骨缺损愈合状况比较
HE染色检测显示,正常对照组骨缺损区骨形成量较多,但纤维组织较少;糖尿病各组纤维组织较多,但骨组织较少;阴性对照组与RNA干扰组骨组织周围可见部分空隙,此空隙由标本处理过程中残余的AteloGene胶体脱落所致(图1)。骨组织再生Lane- Sandhu评分结果显示,正常对照组为6.357±0.912,高于糖尿病各组(P<0.05);RNA干扰组为4.506±0.575,高于空白对照组(3.269±0.423)和阴性对照组(3.144±0.358)(P<0.05);而空白对照组与阴性对照组相比,Lane- Sandhu评分无统计学差异(P>0.05)。

正常对照组 空白对照组 阴性对照组 RNA干扰组
图1 骨缺损构建28 d后大鼠牙槽骨缺损区愈合状况(HE染色, ×200)
2.3 各组大鼠骨缺损区Lnk- SCF/ckit反应轴主要蛋白表达水平比较
免疫印迹实验检测显示,与正常对照组相比,糖尿病各组骨缺损区Lnk蛋白表达水平较高, SCF、cKit蛋白表达水平较低(P<0.05);与空白对照组、阴性对照组相比,RNA干扰组Lnk表达水平降低,而SCF、cKit表达水平升高(P<0.05);空白对照组和阴性对照组的Lnk、SCF、cKit表达水平均无计学差异(P>0.05)(图2,表1)。
2.4 各组大鼠骨缺损区成骨相关蛋白表达水平比较
免疫印迹实验检测显示,糖尿病各组骨缺损区成骨相关蛋白ALP、OCN、ColIa1的表达水平明显低于正常对照组(P<0.05);RNA干扰组ALP、OCN、ColIa1的表达水平明显高于空白对照组和阴性对照组(P<0.05);空白对照组与阴性对照组相比,ALP、OCN、ColIa1蛋白的表达水平无统计学差异(P>0.05)(图2,表1)。
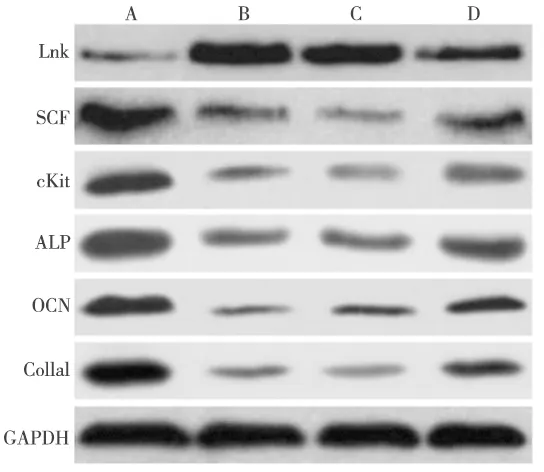
A. 正常对照组; B. 空白对照组; C. 阴性对照组; D. RNA干扰组

相关蛋白正常对照组空白对照组阴性对照组RNA干扰组Lnk0.317±0.045b0.965±0.101ab0.903±0.114ab0.552±0.043aSCF0.946±0.092b0.423±0.061ab0.407±0.042ab0.653±0.054acKit0.851±0.064b0.317±0.052ab0.353±0.026ab0.519±0.047aALP0.893±0.056b0.562±0.038ab0.545±0.043ab0.687±0.036aOCN0.825±0.061b0.435±0.032ab0.398±0.046ab0.605±0.044aColIa10.867±0.058b0.326±0.052ab0.385±0.041ab0.523±0.039a
a与正常对照组相比P<0.05;b与RNA干扰组相比P<0.05
3 讨论
目前,糖尿病已被世界卫生组织列为严重影响人类健康的第三大疾病,其典型特征是血液葡萄糖水平异常增高。既往研究显示,具有分化功能的细胞发生骨向分化时可形成骨组织,在骨缺损愈合的过程中具有重要作用;而糖尿病高糖状态可影响细胞的骨向分化过程,使骨组织缺损愈合延迟[1-2]。提示,改善高糖状态下细胞的骨向分化能力,可能成为探寻糖尿病骨疾病治疗措施的切入点之一。
Lnk蛋白是一种含有多个结构域的连接蛋白,在其介导的细胞信号转导通路中具有重要的桥梁作用,可沟通整条通路的信号转导[6, 11]。近年来发现Lnk蛋白能负性调节多种细胞的分化,如内皮祖细胞、成骨细胞等,并在多种病理状态下高表达[7-8, 12]。另有研究表明,敲除Lnk可促进小鼠成骨细胞骨向分化,并在骨折愈合过程中加速骨形成,但其作用机制尚不清楚[7]。另有研究显示,SCF- cKit反应轴是Lnk蛋白重要的下游信号转导途径之一,参与多种细胞的分化过程,激活SCF- cKit反应轴可促进具有分化功能的细胞分化为内皮细胞等,从而促进组织再生[8, 13]。Lnk蛋白可通过其Src同源区2结构域影响SCF和cKit的特异性结合,可改变cKit的激活水平,进而影响下游通路转导细胞分化等信号[14]。研究显示,调节Lnk/SCF- cKit反应轴可促进成骨细胞形成钙化结节[8]。
本实验诱导大鼠形成糖尿病并构建上颌牙槽骨缺损模型,局部转染靶向Lnk的shRNA,在构建骨缺损28 d后,可观察到正常对照组大鼠的骨组织再生评分高于糖尿病各组,Lnk蛋白表达水平则低于糖尿病各组;与空白对照组和阴性对照组相比,RNA干扰组的骨组织再生评分增高,Lnk蛋白表达水平降低; 提示, 在糖尿病状态下牙槽骨缺损早期愈合障碍与Lnk过表达有关,抑制Lnk蛋白的表达水平可改善该愈合障碍。同时,免疫印迹实验结果显示,与正常对照组相比,糖尿病各组SCF、cKit蛋白的表达水平较低;RNA干扰组的SCF、cKit蛋白表达水平高于空白对照组与阴性对照组,差异具有统计学意义(P<0.05);空白对照组与阴性对照组相比,SCF、cKit的表达未见统计学差异,提示在糖尿病状态下抑制骨缺损部位过表达Lnk,可激活SCF- cKit反应轴。
某些蛋白在骨组织缺损愈合过程中是必需的,是细胞骨向分化的重要特征。既往研究表明,ALP是成骨样细胞的特征性标记[15];OCN是细胞骨向分化、成熟时分泌到胞外成为无定形基质的组成部分,是成骨过程中的特异蛋白之一[16];ColIa1是由骨形成细胞产生的有机成分,其基因突变可引起成骨不全等骨疾病,也是细胞骨向分化的重要标志之一[17]。本实验结果显示,与正常对照组大鼠相比,各组糖尿病大鼠骨缺损区高表达Lnk蛋白的同时,低表达SCF、cKit、ALP、OCN、ColIa1蛋白,提示糖尿病状态下骨缺损区的细胞存在成骨功能障碍,并可能与Lnk/SCF- cKit反应轴的激活异常有关。与空白对照组、阴性对照组相比,RNA干扰组骨缺损区低表达Lnk蛋白,且高表达SCF、cKit、ALP、OCN、ColIa1蛋白,提示靶向抑制Lnk蛋白的表达,激活SCF- cKit反应轴可能改善糖尿病状态牙槽骨缺损区细胞骨向分化,促进骨缺损修复。
综上所述,抑制Lnk蛋白的表达可能促进SCF-cKit反应轴的激活并改善糖尿病状态下牙槽骨缺损的早期愈合,调节Lnk/SCF- cKit反应轴可能为探寻治疗糖尿病骨疾病的方法提供新思路。
[1]Preshaw P, Alba A, Herrera D,etal. Periodontitis and diabetes: a two- way relationship[J].Diabetologia, 2012, 55(1): 21-31.
[2]Chang P, Chung M, Wang Y,etal. Patterns of diabetic periodontal wound repair: a study using micro- computed tomography and immunohistochemistry[J].JPeriodontol, 2012, 83(5): 644-652.
[3]Beam H, Parsons J, Lin S. The effects of blood glucose control upon fracture healing in the BB Wistar rat with diabetes mellitus[J].JOrthopRes, 2002, 20(6): 1210-1216.
[4]Ribeiro FO, Gómez- Benito MJ, Folgado J,etal. In silico mechano- chemical model of bone healing for the regeneration of critical defects: the effect of BMP- 2[J].PLoSOne, 2015, 10(6): e0127722.
[5]Arioka M, Takahashi- Yanaga F, Sasaki M,etal. Acceleration of bone regeneration by local application of lithium: Wnt signal- mediated osteoblastogenesis and wnt signal- independent suppression of osteoclastogenesis[J].BiochemPharmacol, 2014, 90(4): 397-405.
[6]Lee SH, Lee KB, Lee JH,etal. Selective interference targeting of lnk in umbilical cord- derived late endothelial progenitor cells improves vascular repair, following hind limb ischemic injury, via regulation of JAK2/STAT3 signaling[J].StemCells, 2015, 33(5): 1490-1500.
[7]Matsumoto T, Ii M, Nishimura H,etal. Lnk- dependent axis of SCF- cKit signal for osteogenesis in bone fracture healing[J].JExpMed, 2010, 207(10): 2207-2223.
[8]Kawakami Y, Ii M, Matsumoto T,etal. A small interfering RNA targeting Lnk accelerates bone fracture healing with early neovascularization[J].LabInvest, 2013, 93(9): 1036-1053.
[9]Lambertucci AC, Lambertucci RH, Hirabara SM,etal. Glutamine supplementation stimulates protein- synthetic and inhibits protein- degradative signaling pathways in skeletal muscle of diabetic rats[J].PLoSOne, 2012, 7(12): e50390.
[10]Wang Q, Li H, Xiao Y,etal. Locally controlled delivery of TNFα antibody from a novel glucose- sensitive scaffold enhances alveolar bone healing in diabetic conditions[J].JControlRelease, 2015, 206: 232-242
[11]陈艳,伍学强,韩春生,等. LNK基因突变在骨髓增殖性肿瘤中的作用[J]. 中国实验血液学杂志, 2013, 21(5): 1309-1312.
[12]Kwon SM, Suzuki T, Kawamoto A,etal. Pivotal role of lnk adaptor protein in endothelial progenitor cell biology for vascular regeneration[J].CircRes, 2009, 104(8): 969-977.
[13]闵敏,张雪静,马红,等. 人脂肪间充质干细胞体外向黑素细胞分化的研究[J]. 中华皮肤科杂志,2014, 47(2): 85-89.
[14]Simon C, Dondi E, Chaix A,etal. Lnk adaptor protein down- regulates specific Kit- induced signaling pathways in primary mast cells[J].Blood, 2008, 112(10): 4039-4047.
[15]Sato R, Onda K, Kato H,etal. An evaluation of the effect of age and the peri- parturient period on bone metabolism in dairy cows as measured by serum bone- specific alkaline phosphatase activity and urinary deoxypyridinoline concentration[J].VetJ, 2013, 197(2): 358-362.
[16]Shekaran A, Shoemaker JT, Kavanaugh TE,etal. The effect of conditional inactivation of beta 1 integrins using twist 2 cre, osterix cre and osteocalcin cre lines on skeletal phenotype[J].Bone, 2014, 68: 131-141.
[17]李娜,吴秋月,曹翔,等. 1例成骨不全患者Ⅰ型胶原基因突变的检测[J]. 临床检验杂志,32(4): 314-316.
Improvement of early-stage healing of diabetic rat alveolar bone defect by regulation of Lnk/SCF- cKit axis
LI Hao*, ZHOU Hai- lun, WANG Qi, LI Wei
(*DepartmentofProsthodontics,theAffiliatedHospitalofStomatology,GuangxiMedicalUniversity,Nanning530021,China)
AIM: To investigate the changes of early- stage healing of diabetic rat alveolar bone defect by regulation of Lnk/SCF- cKit axis. METHODS: Diabetes was induced and alveolar bone defects were formed in 30 rats. The rats were divided into control group (untransfection), negative control group (control plasmids transfection), and RNAi group (Lnk- targeting RNA interference plasmids transfection). HE staining was used to examine the healing level of alveolar bone defect, and Western blotting was used to examine the expression of Lnk, SCF, and cKit in Lnk/SCF- cKit axis and the osteogenic proteins of ALP, OCN and ColIa1. RESULTS: HE staining showed that Lane-Sandhu scor of RNAi group was higher than that of other diabetic groups (P<0.05). Western blotting analysis demonstrated that the rats in RNAi group had less Lnk expression, and greater expressions of SCF, cKit, ALP, OCN and ColIa1 in bone defect area than the rats in other groups(P<0.05). CONCLUSION: Inhibition of Lnk expression, and activation of SCF- cKit axis may improve early- stage bone defect healing of diabetic rats.
Lnk; SCF- cKit axis; diabetes; bone defect
2015-07-09
国家自然科学基金(81200794); 广西自然科学基金(2015GXNSFBA139140)
李 昊(1984-),女,满族,湖北武汉人。博士, 主治医师
李 昊, E-mail:sherrylee2011@126.com
R782.1
A
1005-2593(2015)12-0713-05
广西高校科学技术研究项目(KY2015YB060); 广西医科大学青年科学基金(GXMUYSF2014017)
大学生创新创业训练计划项目[桂医大教(2015)27号-73]
周海伦为共同第一作者
