模拟失重下大鼠下颌牙槽骨形态改变的初步探讨
2015-11-21申晋斌郭慧慧石莹莹
申晋斌, 郭慧慧, 吕 强, 冯 娟, 石莹莹, 张 蓉
(陕西 西安 710032: 1.军事口腔医学国家重点实验室,陕西省口腔医学重点实验室,第四军医大学口腔医院牙体牙髓病科; 2.第四军医大学航天航空医学院)
模拟失重下大鼠下颌牙槽骨形态改变的初步探讨
申晋斌1, 郭慧慧1, 吕 强2, 冯 娟1, 石莹莹1, 张 蓉1
(陕西 西安 710032: 1.军事口腔医学国家重点实验室,陕西省口腔医学重点实验室,第四军医大学口腔医院牙体牙髓病科; 2.第四军医大学航天航空医学院)
目的: 初步探讨模拟失重下大鼠牙槽骨骨质是否存在骨丧失。方法:将12只SD雄性大鼠,随机分为2组(n=6), 对照组不做任何干预,悬尾组大鼠连续悬吊4周后处死各组大鼠,并取其下颌骨磨牙区标本,分别通过Micro CT扫描重建分析比较两组大鼠牙槽骨的骨体积分数(BV/TV,%)、骨小梁厚度(Tb.Th,μm)、骨小梁数量(Tb.N,mm-1)和平均密度MD值(CT);SEM观察比较两组大鼠牙槽骨骨细胞和骨胶原纤维情况;能谱分析测定各大鼠感兴趣区域的钙、磷含量。结果:Micro CT扫描结果可见,悬尾组大鼠下颌磨牙根分叉下的牙槽骨骨质存在一定程度的骨丧失; 下颌牙槽骨的BV/TV、Tb.N和MD值均较对照组明显下降(P<0.05), Tb.Th与对照组相比无明显差异(P>0.05)。SEM可见,悬尾组大鼠牙槽骨骨细胞皱缩,且排列紊乱;骨胶原纤维结构杂乱,失去正常条索状形态。能谱分析结果显示,悬尾组大鼠的钙、磷含量曲线波动幅度明显减少。结论:模拟失重下大鼠牙槽骨骨质也可存在一定程度的骨丧失。
模拟失重; 牙槽骨; 骨丧失; 骨细胞; 骨胶原纤维
[DOI] 10.15956/j.cnki.chin.j.conserv.dent.2015.12.005
[Chinese Journal of Conservative Dentistry,2015,25(12): 723]
在航天飞行中,宇航员由于受失重、噪声、昼夜节律变化等不良因素的影响,其机体骨骼肌肉系统、心血管系统以及免疫系统等均会发生一系列生理适应性反应[1]。在所发生的一系列适应性改变中,大部分系统的变化具有一定的自限性,可在航天飞行中达到新的平衡状态而不再继续发展,但骨骼系统的变化无自限性,且呈现出进行性的过程[2]。随着航天次数和时间的不断增加,航天员在太空失重环境中的生活时间也不断延长,失重性骨丢失对航天员的影响和危害将非常严重。目前,对于失重性骨丢失的研究主要集中于承重骨,包括脊柱、骨盆和下肢骨,而对于全身骨骼中代谢最活跃的骨组织—牙槽骨的研究则相对较少。牙槽骨具有高度可塑性,是重要的牙周支持组织,其对牙体的发生、发育和萌出以及维持正常的咀嚼功能均起着不可替代的作用。牙周病和生理性退缩等原因都会造成牙槽骨高度的降低、密度的改变和牙周膜附着高度的丧失,从而使牙周支持组织在咬合力作用下的改建过程发生变化。牙槽骨内存在的一些感受器能通过感受外部施加的机械刺激而活化相关骨细胞,并进而引起骨的吸收或形成。有研究表明[3-4],骨质疏松症对牙槽骨的骨矿含量和剩余牙槽骨体积都会产生明显影响。另有研究发现[5], 模拟失重下人口腔咬合力及咬合速率明显下降。那么,失重环境下牙槽骨是否也会像长骨一样出现骨质丧失呢?其骨改建后的形态如何?本研究拟采用大鼠尾部悬吊法这一成熟的模拟失重的方法[6-7],进行分组对照实验研究,并通过Micro CT和扫描电镜(SEM)分别观察实验组和对照组大鼠的牙槽骨改建情况;以期为进一步完善失重性骨丧失发生的可能机制、寻找其对抗或改善措施提供参考。
1 材料和方法
1.1 动物模型的建立及标本的获取
取清洁级雄性SD(Sprague-Dawley)大鼠(第四军医大学实验动物中心提供)12只(体质量230~250 g),置于动物饲养房室内[温度(23±2)℃,相对湿度50%,12 h光照/黑暗交替循环],适应性饲养(保证足量清洁饮水和鼠粮)1周后,将其随机分为对照组(control group,CON组)和悬尾组(tail suspension group,TS组)(n=6)。其中悬尾组各大鼠的尾吊方法参照Morey-Holton等[8]报道的大鼠后肢去负荷建模法进行操作,即大鼠始终保持30°头低位,且后肢呈自由悬垂不荷重状态,连续4周;对照组大鼠不采取任何干预措施,并置于悬尾组相同环境下进行饲养。4周实验期满时分别取两组大鼠,用10 g/L戊巴比妥钠注射液腹腔注射(50 mg/Kg)麻醉后,迅速取出其双侧下颌骨;然后分别制备包括下颌磨牙及其牙槽骨的下颌骨段,置于40 g/L多聚甲醛(PFA)液中固定保存。该实验经第四军医大学口腔医院动物管理伦理委员会批准(批准号:2015伦审字061号)。
1.2 Micro CT扫描重建分析
分别取各大鼠的右侧下颌骨标本,采用Micro CT以360°旋转方式对其进行扫描,扫描参数: 分辨率15 μm, 电压80 kV, 电流500 μA, 扫描时间为45 min, 角度增益0.6°, 曝光时间2 500 ms。扫描结束后,分别对各标本的感兴趣区域(region of interest,ROI)——距下颌第一磨牙(M1)根分叉下0.5 mm处,约2.0 mm×0.8 mm×0.5 mm的长方体骨体(图1a)进行三维重建;并采用系统自带的Inveon Research Workplace 2.2软件对其骨小梁的形态进行定量分析,分析参数(图1b)包括骨体积分数(bone volume fraction,BV/TV,%)、骨小梁厚度(trabecular thickness,Tb.Th,μm)、骨小梁数量(trabecular number,Tb.N,mm-1)等。以上各指标的图像分析均参照Pinto M等[9]报道的方法,并通过图1c所列公式计算各标本感兴趣区域的平均密度CT值(ROI mean density),以用于组间比较。Micro CT扫描、感兴趣区域的三维重建及参数分析均由第四军医大学口腔医学研究所Micro CT室的技师完成。
1.3 SEM及能谱分析
分别取各大鼠的左侧下颌骨标本(不脱钙),经梯度脱水后用树脂(甲基丙烯酸甲酯)进行包埋。待树脂完全固化后,用硬组织切片机(LEICA1600型,德国)分别沿各标本的矢状向将其逐层切削至磨牙的正中,使之形成矢状切面。切好的各树脂标本表面分别经砂纸打磨抛光刀痕、超声清洗1 min、细磨光片打磨抛光、370 g/L磷酸酸蚀15 s 去除玷污层、双蒸水清洗3次(每次3 min)后,用离子溅射仪(型号E-1045)(株式会社,日本)对其表面进行喷金处理;然后用场发射扫描电镜(HIACHI S-4800C)(株式会社,日本)分别观察各标本的牙槽骨骨细胞和骨胶原纤维情况,并用能谱仪(株式会社,日本)分析感兴趣区域牙槽骨中的钙、磷含量。
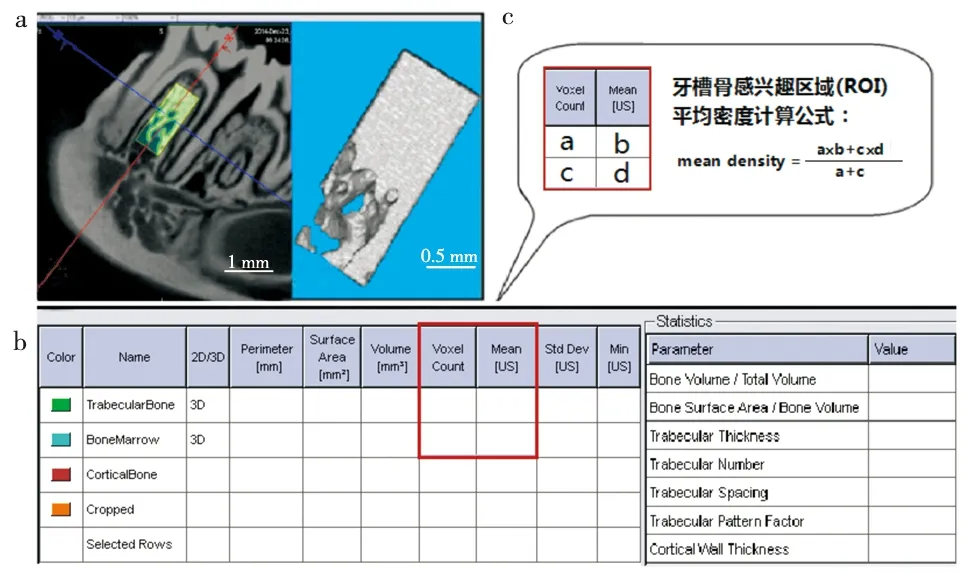
a. 下颌第一磨牙牙槽骨感兴趣区域(ROI)三维重建及骨形态学分析测量; b. 系统自动分析软件所得参数,包括BV/TV、Tb.Th,Tb.N等; c. 牙槽骨感兴趣区域平均密度计算公式
图1 Micro-CT扫描重建及分析
1.4 统计学分析
2 结果
2.1 Micro CT扫描重建分析结果
Micro CT扫描重建分析结果显示,大鼠经悬尾后其第一磨牙和第二磨牙根分叉下的牙槽骨有明显吸收(图2)。对所得参数进行统计分析显示:悬尾组大鼠的骨小梁数目(Tb.N)、平均密度CT值(ROI mean density)及骨体积分数(BV/TV)较对照组明显减少(P< 0.05);其骨小梁厚度(Tb.Th)虽较对照组稍有增加,但两者差异无统计学意义(P>0.05)(图3)。
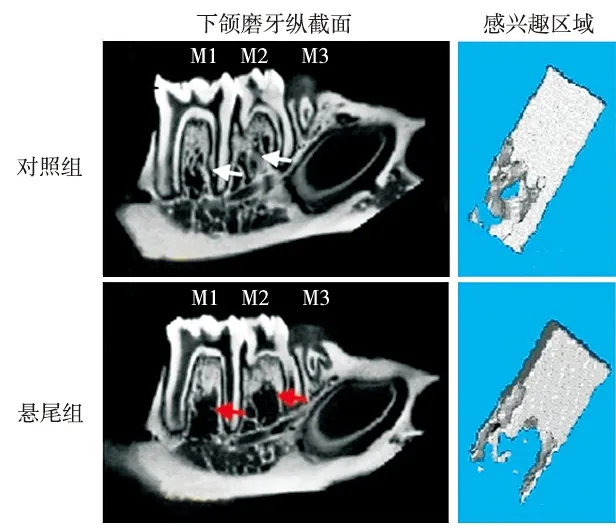
图2 两组Micro CT扫描及感兴趣区域三维重建(箭头示牙槽骨吸收)

图3 Micro CT扫描重建及分析结果(*P<0.05)
2.2 SEM观察结果
SEM观察显示:悬尾组大鼠下颌磨牙根分叉下的牙槽骨存在明显的骨质丢失;对照组牙槽骨骨细胞的形态正常且排列规则,骨基质均匀致密,而悬尾组的牙槽骨骨细胞则排列紊乱,骨陷窝空隙增大甚至空洞,骨基质相对疏松;对单个骨细胞的形态特征进行比较可见,对照组的骨细胞饱满呈梭形,且突起明显,而悬尾组的骨细胞则形态各异,表现为骨细胞收缩、陷窝变大、周围突起断裂(图4)。对照组大鼠的牙槽骨骨胶原纤维排列整齐、紧密且有方向性;悬尾组大鼠的骨胶原纤维则结构杂乱,表现为连续性中断、完整性较差、无正常条索外形且轮廓不清,同时还可见胶原纤维束排列紊乱、走向不一致,且相互间交联杂乱而失去应有的规律,骨胶原纤维也不能聚集成排列有序、形态规整的胶原纤维束(图5)。

图4 观察两组大鼠下颌第一磨牙根分叉下牙槽骨情况(SEM)

图5 两组大鼠下颌第一磨牙根分叉下牙槽骨骨胶原纤维情况(SEM)

对照组 悬尾组
白色横线为谱分析区域; 浅蓝色曲线为磷含量的波动值; 紫色曲线为钙含量的波动值
图6 两组能谱分析结果
2.3 能谱分析结果
对牙槽骨吸收较重的感兴趣区域进行能谱分析显示:对照组的钙、磷含量处于一个较为规则的波动曲线;悬尾组的钙、磷含量曲线在中间部分波动特别小,几乎呈一直线,提示该处的牙槽骨骨质有明显丧失(图6)。
3 讨论
空间飞行中最重要的环境特征之一就是微重力(失重),在失重环境下由于骨骼不再承受人体的重量,加之肢体运动量减少,从而减轻了对骨骼的刺激并最终导致骨质丢失现象,主要表现为骨密度降低、骨骼矿物质丧失[10-12]。关于全身性骨质疏松与牙槽骨骨质疏松的一致性目前虽尚无定论,但大多数学者认为颌骨是全身骨骼的一部分,影响全身骨质疏松的因素同样可作用于颌骨。 Genco RJ 等[13]认为,骨质疏松症也是牙周病的危险因素之一。牙槽骨与长骨相比,两者的基本构成一致,均由细胞(成骨细胞、破骨细胞和骨细胞)和基质组成; 但两者的形态和结构不同。牙槽骨由最内侧的固有牙槽骨、中间的松质骨及外侧的密质骨组成;其中,松质骨由骨小梁和骨髓组成,位于密质骨和固有牙槽骨之间,占牙槽骨总体积的80%以上。有研究发现,失重状态下骨质的丧失以松质骨为重[14],模拟失重下人的口腔咬合力及咬合速率均会明显下降[5]。那么,富含松质骨的牙槽骨在失重时是否也会像长骨一样出现骨质丧失呢?本实验结果初步证实,当大鼠处于模拟失重下时,其下颌磨牙区的牙槽骨骨质也存在一定程度的骨质丧失;虽然该实验样本量较少,其结论还需大样本数据进一步验证,但足以提醒我们应该对航天员这一特殊人群的口腔健康状况引起重视,并进一步探究模拟失重下牙槽骨丧失的原因。
骨细胞是骨组织中数量最多的细胞,作为骨机械应力的直接感受器,其不仅可以将力学信号转化为生化信号,还可将信号传递给骨组织的其他细胞,调控后者的功能[15]。近年来,随着多种骨细胞系和骨细胞特异性转基因小鼠模型的建立,对骨细胞生物学功能的研究也不断深入,骨细胞已经成为骨生物力学研究的最大热点和进展最迅速的领域。最新研究发现:骨细胞在某些特殊状态[16](如哺乳期)或给予糖皮质激素治疗[17]后可发生自体吞噬(autophage),从而使其自身微环境中的骨陷窝-泪小管系统发生降解和重塑。自吞现象的存在,不仅是细胞清除自体垃圾的保护性行为,同时也是细胞为针对不同应力产生的适应性改变以提供营养和能量[18-19]。鉴于骨细胞的数量及活性对骨量的维持起着重要作用,我们推测骨细胞的自吞现象可能是模拟失重下大鼠牙槽骨骨质丢失的原因之一。为了明确模拟失重下大鼠下颌牙槽骨骨量的减少是否由于骨细胞减少所致,我们通过SEM及其图像对单位骨面上的骨细胞数和骨细胞面进行了分析; 结果显示,悬尾组大鼠下颌牙槽骨的骨细胞形态各异,且破坏明显,严重者骨细胞已不可见,呈现空洞形。
骨骼是人体的重要组织,起着支撑身体、保护器官和调节钙、磷代谢的作用。骨基质中所含的主要有机物为I型胶原纤维,主要无机物是由钙、磷所构成的羟基磷灰石晶体。骨基质中的有机物除为其提供韧性特征[20]外,还能为骨基质中羟基磷灰石晶体提供沉积位点,并在骨质矿物质沉积中起着矿化支架的作用[21]。本结果显示,悬尾组大鼠牙槽骨骨基质中的I型胶原纤维存在异常改变,其I型胶原纤维束在排列结构上与对照组相比,失去了其规律、周期的排列结构,取而代之的是排列迂曲紊乱的结构。胶原纤维及胶原纤维束的异常,可导致骨骼中的无机物(羟基磷灰石晶体)不能在有机物中正常沉积,从而使骨骼发生矿化不全或矿化缺失,最终将导致骨骼的机械强度下降。能谱分析结果显示,悬尾组大鼠第一磨牙根分叉区的钙、磷含量几乎呈一直线,无明显的上下波动;提示,模拟失重可能通过某些信号通道使骨细胞发生自吞,从而使骨细胞的数量减少并导致牙槽骨的骨质丧失。但其具体机制尚需进一步的研究。
本实验中还发现,悬尾组大鼠牙槽骨骨质丧失的部位在磨牙根分叉下及牙根之间的区域(P<0.05),而非牙槽嵴和牙槽中隔部分(P>0.05),这有别于牙周慢性炎症和咬合创伤等局部因素而引起牙槽骨吸收的特点[22]。分析其原因可能是此区域牙槽骨日常受力较小,其骨密度较内侧固有牙槽骨和外侧密质骨低,相对疏松的骨质可能是其在模拟失重下较早出现骨质丧失的原因。Johnston BD等[23]对“切除大鼠卵巢模拟绝经后女性牙槽骨丧失”进行综述时,将感兴趣区域(ROI)设定为下颌磨牙牙根间隔(interradicular septum)牙槽骨,并认为该区域是大鼠卵巢切除后牙槽骨较早和容易出现骨质丢失的区域;与本实验所选的感兴趣区域一致。然而,骨质丧失的机制是复杂的,其中可能涉及多个介质,且具体分子机制仍未完全明确,尚需进一步深入研究,以期为临床调控骨改建过程、预防和治疗骨疾病提供实验依据。
[1]Mortazavi SM,Cameron JR,Niroomand- rad A.Adaptive response studies may help choose astronauts for long- term space travel[J].AdvSpaceRes, 2003,31(6):1543-1551.
[2]孙喜庆,姜世忠.空间医学与生物学研究[M]. 西安: 第四军医大学出版社,2010:103.
[3]Jiang GZ,Matsumoto H,Hori M,etal.Correlation among geometric,densitometric, and mechanical properties in mandible and femur of osteoporotic rats [J].JBoneMinerMetab, 2008,26(2): 130-137.
[4]Brennan- Calanan RM,Genco RJ,Wilding GE,etal.Osteoporosis and oral infection:independent risk factors for oral bone loss[J].JDentRes,2008,87(4):323-327.
[5]史亮,牛忠英,王林杰,等.15d-6°头低位卧床对女性最大咬合力及咬合速度的影响[J]. 航天医学与医学工程,2011,24(4):280-282.
[6]董丽,王琼,刘新民,等.地面模拟失重实验方法概况[J]. 中国实验动物学报,2013,21(5):90-94.
[7]Morey- Holton ER,Globus RK.Hindlimb unloading rodent model: technical aspects[J].JApplPhysiol, 2002,92(4):1367-l377.
[8]Morey- Holton E,Globus RK,Kaplansky A,etal.The hindlimb unloading rat model:literature overview,technique update and comparison with space flight data[J].AdvSpaceBiolMed,2005,10:7-40.
[9]Pinto M, Jepsen KJ,Terranova CJ,etal.Lack of sexual dimorphism in femora of the eusocial and hypogonadic naked mole-rat: a novel animal model for the study of delayed puberty on the skeletal system[J].Bone, 2010,46(1):112-120.
[10]Smith SM, Heer M .Calcium and bone metabolism during space flight[J].Nutrition, 2002,18(10):849-852.
[11]LeBlanc A,Schneider V,Shackelford L,etal.Bone mineral and lean tissue loss after long duration space flight[J].JMusculoskeletNeuronalInteract,2000,1(2):157-160.
[12]McCarthy ID.Fluid shifts due to microgravity and their effects on bone: a review of current knowledge[J].AnnBiomedEng, 2005,33(1):95-103.
[13]Genco RJ,Borgnakke WS.Risk factors for periodontal disease[J].Periodontology2000, 2013,62(1):59-94.
[14]Cervinka T,Siev nen H,Hyttinen J,etal.Bone loss patterns in cortical, subcortical, and trabecular compartments during simulated microgravity[J].JApplPhysiol,2014,117(1):80-88.
[15]Ken W,Kyoji I.Osteocytes in normal physiology and osteoporosis[J].ClinicRevBoneMinerMetab, 2010,8:224-232.
[16]Qing H,Ardeshirpour L,Pajevic PD,etal. Demonstration of osteocytic perilacunar/canalicular remodeling in mice during lactation[J].JBoneMinerRes, 2012,27(5):1018-1029.
[17]Piemontese M,Onal M,Xiong J,etal.Suppression of autophagy in osteocytes does not modify the adverse effects of glucocorticoids on cortical bone[J].Bone,2015,75:18-26.
[18]Nollet M,Santucci- Darmanin S, Breuil V,etal.Autophagy in osteoblasts is involved in mineralization and bone homeostasis[J].Autophagy,2014,10(11):1965-1977.
[19]Yang Z,Klionsky DJ.Eaten alive: a history of macroautophagy[J].NatCellBiol, 2010,12(9):814-822.
[20]Viguet- Carrin S,Garnero P,Delmas PD.The role of collagen in bone strength[J].OsteoporosInt, 2006,17(3):319-336.
[21]Pace JM,Atkinson M,Willing MC,etal.Deletions and duplications of Gly- Xaa- Yaa triplet repeats in the triple helical domains of type I collagen chains disrupt helix formation and result in several types of osteogenesis imperfecta [J].HumMutat, 2001,18(4):319-326.
[22]孟焕新.牙周病学[M]. 4版 . 北京:人民卫生出版社,2012: 119-123.
[23]Johnston BD,Ward WE.The ovariectomized rat as a model for studying alveolar bone loss in postmenopausal women[J].BiomedResInt, 2015 , 2015:635023. Epub 2015:1-12.
The morphological changes of mandibular alveolar bone in rats under the conditions of simulated weightlessness- a pilot study
SHEN Jin- bin*, GUO Hui- hui, LYU Qiang, FENG Juan, SHI Ying- ying, ZHANG Rong
(*StateKeyLaboratoryofMilitaryStomatology,DepartmentofOperativeDensityandEndodotics,SchoolofStomatology,TheFourthMilitaryMedicalUniversity,Xi'an710032,China)
AIM: To investigate the alveolar bone loss in rats under simulated weightlessness condition. METHODS: 12 male SD rats were divided randomly into the control group and the tail suspension group(TS group) (n=6). After 4 w tail- suspension, all rats were sacrificed and the alveolar bone of the mandibular molar region were removed. The bone volume fraction wersus total volume(BV/TV,%), trabecular bone thickness(Tb.Th,μm),trabecular bone number(Tb.N,mm-1) and average density (mean density, MD) of the 2 groups were compared by MicroCT analysis. Bone cells and bone collagen fibers were observed by SEM. The relative contents of calcium and phosphorus in alveolar bone were measured with energy spectrum system. RESULTS: Bone loss was observed by MicroCT in the interradicular septum of the mandibular teeth in the TS group. Significant decrease was observed in BV/TV, Tb.N and MD in the TS group(P<0.05). The Tb.Th didn't show a significant change between the two groups (P>0.05). SEM study showed that osteocytes of TS group shrinked and lined in a disorder way, bone collagen was in disorder, discontinuity, poor integrity and lost the normal cord- like shape. The relative content of calcium and phosphorus declined in TS group. CONCLUSION:Weightlessness may lead to a certain degree of alveolar bone loss.
simulated weightlessness; alveolar bone; bone loss; osteocyte; bone collagen fibers
2015-09-21
国家自然科学基金(31170898)
申晋斌(1980-),男,汉族,山西晋中人。硕士生(导师:张蓉)
张 蓉,E-mail:zhangrong@fmmu.edu.cn
R780.2
A
1005-2593(2015)12-0723-06
郭慧慧为共同第一作者
