伽马氨基丁酸抑制高脂诱导肥胖小鼠肝脏氧化应激及肝脂肪变性
2015-11-20谢振兴李秀耿旭夏淑芳乐国伟施用晖1
谢振兴,李秀,耿旭,夏淑芳,乐国伟*1,,施用晖1,
(1.食品科学与技术国家重点实验室,江南大学,江苏无锡 214122;2.江南大学食品学院,江苏无锡 214122;3.河南大学医学院,河南开封 475001)
伽马氨基丁酸抑制高脂诱导肥胖小鼠肝脏氧化应激及肝脂肪变性
谢振兴1,3,李秀2,耿旭3,夏淑芳2,乐国伟*1,2,施用晖1,2
(1.食品科学与技术国家重点实验室,江南大学,江苏无锡 214122;2.江南大学食品学院,江苏无锡 214122;3.河南大学医学院,河南开封 475001)
研究伽马氨基丁酸(GABA)对高脂日粮小鼠肝脏氧化应激、脂肪变性及脂代谢相关基因表达的影响。采用50只C57BL/6雄性小鼠,随机分为5组:正常组(正常日粮),高脂组(高脂日粮),3个GABA处理组(饮水中分别添加质量分数0.2%、0.12%和0.06%GABA)。实验18周后,测定小鼠肝脏组织自由基水平、抗氧化酶活性、脂肪和糖原含量以及血浆谷丙转氨酶、谷草转氨酶活性,同时对肝组织形态进行观察,并用RT-PCR检测肝脏SREBP-1c、FAS、ACC1、PPARα、Cpt1a和PGC-1α的表达。结果显示,高脂日粮显著升高小鼠肝脏质量、肝指数、肝脏甘油三酯和胆固醇含量,降低肝脏功能(P<0.05);添加质量分数0.2%、0.12%和0.06%GABA可显著降低肝脏质量和肝指数,质量分数0.2%、0.12%GABA显著抑制肝脏脂肪变性和改善肝功能(P<0.05)。相比正常组,高脂组动物肝组织中抗氧化酶活性显著降低,自由基和丙二醛含量显著升高(P<0.05);质量分数0.2%、0.12%GABA可显著缓解氧化应激。高脂日粮小鼠肝脏PPARα、Cpt1a和PGC-1α表达显著下调,SREBP-1c、FAS和ACC1表达显著上调(P<0.05),而添加质量分数0.2%、0.12%GABA可显著缓解高脂造成的上述基因表达的变化。因此,高脂日粮导致小鼠肝脏氧化应激、脂肪变性及肝功能损伤,一定剂量GABA可改善肝脏氧化还原状态和脂肪变性,从而预防脂肪肝发生。
高脂;氧化应激;脂肪肝;肝脂肪变性;伽马氨基丁酸
代谢综合症和肥胖作为一种世界性的流行病,增加了许多其他疾病的风险,如糖尿病、心脏病和非酒精性脂肪肝等。其中非酒精性脂肪肝是一种常见的脂肪疾病,表现为肝脏中脂肪代谢发生紊乱和脂肪的异常积累,称为肝脂肪变性,逐渐引发更严重的肝脏疾病[1]。因此,代谢综合症和肥胖被认为是诱发非酒精性脂肪肝风险的重要因素[2]。脂类代谢涉及脂肪合成和分解代谢过程,固醇调节元件结合蛋白质(Sterol regulatory element binding protein 1c,SREBP-1c)被证明能转录激活脂肪合成相关酶,如脂质合成的关键酶乙酰辅酶A羧化酶(acetylcoa carboxylase,ACC)和脂肪酸合成酶(fatty acid synthetase,FAS)[3-4]。过氧化物酶增殖物激活受体α(peroxisome proliferator-activated receptor α,PARP α)则能通过激活脂肪氧化基因的表达促进脂肪的降解,在脂类代谢中起着重要作用[5]。同时,肉碱棕榈酰转移酶(carnitine palmitoyltransferaseIa,Cpt1a)能与长链脂酰辅酶A合成脂酰肉碱,并将其转运至线粒体而被氧化分解[6]。另外,过氧化物酶体激活受体1α(peroxisomeproliferator-activatedreceptor coactivator 1α,PGC-1α)作为一种转录因子,能激活线粒体的生成和呼吸链的氧化磷酸化,促进脂肪降解,保护组织耐受脂肪负荷[7]。
最近研究显示,伽马氨基丁酸(GABA)作为一种功能成分,能对抗高脂诱导的氧化应激和肥胖[8],目前关于GABA对非酒精性肝脏病和肝脏脂肪代谢的影响未见报道。而探讨GABA作为抗氧化剂对高脂诱导的脂肪肝的改善及其机制(对基因表达的影响),则能为认识氧化应激在肝脂肪变性发生中的作用和阐明GABA的保健作用提供依据。
1 材料与方法
1.1 试剂和仪器
纯度99%以上GABA,Sigma公司产品;总抗氧化能力(T-AOC)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-px)和丙二醛(MDA)试剂盒,谷丙转氨酶和谷草转氨酶试剂盒,总胆固醇(TC)、甘油三酯(TG)和糖原测定试剂盒,均为南京建成生物工程研究所产品;Trizol试剂,SYBR green试剂,均为Invitrogen公司产品。5415 D型冷冻高速离心机,Eppendurgh公司制造;ABI-7000型荧光定量PCR仪,ABI公司制造。
1.2 实验动物
清洁级雄性C57BL/6小鼠50只,预饲1周后,根据体质量随机分为5组:对照组(正常日粮),高脂组(高脂日粮),高脂日粮+3个水平GABA处理组(饮水中分别添加质量分数0.2%、0.12%和0.06% GABA)。正常日粮和高脂日粮配方见表1。小鼠同室分笼饲养,光暗周期12 h/12 h,自由采食和饮水。饲养温度为(23±2)℃,湿度50%~60%,饲养18周后处死。
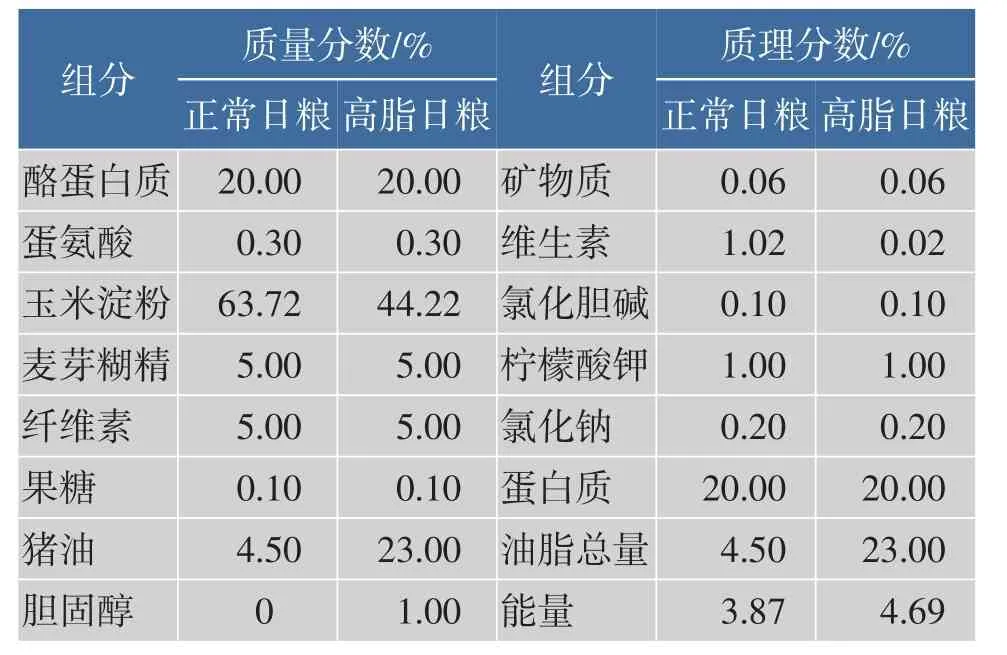
表1 正常日粮和高脂日粮配方Table 1Compositions of normal and high fat diet
1.3 组织样品采集
小鼠饲喂18周后,称体质量并眼球取血于抗凝管离心(4℃、4 000 r/min离心10 min),取血浆于-20℃保存备用。小鼠处死后,取肝脏在预冷的生理盐水中冲洗去血,滤纸拭干,精确称质量并计算肝脏指数

式中,mg为肝脏质量,mt为体质量。
用预冷的生理盐水匀浆制得10 g/dL肝脏组织匀浆液,用于测定自由基ROS水平、氧化还原指标及蛋白质含量(lowry法[9])。另取0.1 g肝脏组织放入1mL trizol中,-80℃保存以备提取RNA。
1.4 指标的检测
1.4.1 肝脏组织自由基水平的测定取上述肝脏匀浆液,根据luminol化学发光测定法[10],使用MPIB型化学发光检测仪系统检测,以单位蛋白质浓度下相对发光强度(RLU/mg)表示自由基水平。
1.4.2 血浆转氨酶和肝脏组织匀浆中酶活测定血浆中谷丙和谷草转氨酶活性测定,遵从于南京建成生物有限公司研制的检测盒指南进行检测。肝脏中过氧化氢酶(CAT)、过氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-px)、丙二醛(MDA)和总抗氧化能力(T-AOC)指标均严格按照试剂盒说明书进行操作,以单位蛋白质浓度进行校正。
1.4.3 肝脏组织中甘油三酯和胆固醇含量以及糖原含量的测定为了测定小鼠肝脏中脂质含量,准确称取250 mg肝脏组织于2.5 mL氯仿-甲醇(体积比2:1)液中匀浆制成质量浓度10 g/dL匀浆液,室温下抽提24 h后,取有机溶剂层,根据测定试剂盒对甘油三酯和胆固醇含量进行测定[11]。肝脏匀浆后用乙醇脱蛋白质后,根据试剂盒提供的蒽酮法进行测定。
1.4.4 肝脏的形态学观察切取3 mm×5 mm×5 mm小鼠新鲜肝脏组织在质量分数4%多聚甲醛磷酸缓冲液固定48 h,经脱水后包埋在石蜡中,用切片机制成5 μm厚的切片,并进行HE染色,采用Olympus光学显微镜观察各组小鼠肝脏组织形态的变化。
1.4.5 肝脏组织的RT-PCR检测通过NCBI中查出小鼠mRNA的序列,由上海生工生物工程技术服务有限公司设计、合成引物(见表2)。用ABI-7000定量PCR仪,进行Real-time RT-PCR扩增。PCR反应体系(25 μL):10×PCR缓冲液(含1.5 mmol/L Mg2+)2.5 μL,10 mmol/L dNTP 0.5 μL,10 μmol/L上下游引物各1 μL,cDNA模板2 μL,Taq酶(5 U/μL)0.25 μL,无菌水16.5 μL,SYBR green(20×)1.25 μL。PCR扩增条件:95℃变性3 min,55℃退火3 min,72℃延伸1 min为第一个循环;95℃变性30 s,60℃退火75 s,72℃延伸30 s为第二个循环;共35个循环,终末72℃延伸5 min。检测Ct值,通过Ct值进行相对定量。
1.5 数据处理和统计
采用SPSS 17.0软件进行方差分析和多重比较,结果以均数±标准差(x±s)表示,差异显著水平为P<0.05。
2 结果与分析
2.1 GABA对高脂日粮小鼠体质量、肝脏质量和肝指数的影响
高脂组小鼠18周后,体质量、肝脏质量及肝指数显著(P<0.05)高于正常组。添加质量分数0.2%和0.12%GABA小鼠的体质量、肝质量和肝指数显著降低(P<0.05);在高脂日粮中添加质量分数0.06%GABA,显著降低肝质量和肝指数(P<0.05),但体质量和高脂组的差异不显著,表明高、中剂量GABA减肥作用优于低剂量的,结果见表3。

表2 引物序列Table 2Sequence of the primers for(F:Forward;R:Reverse)
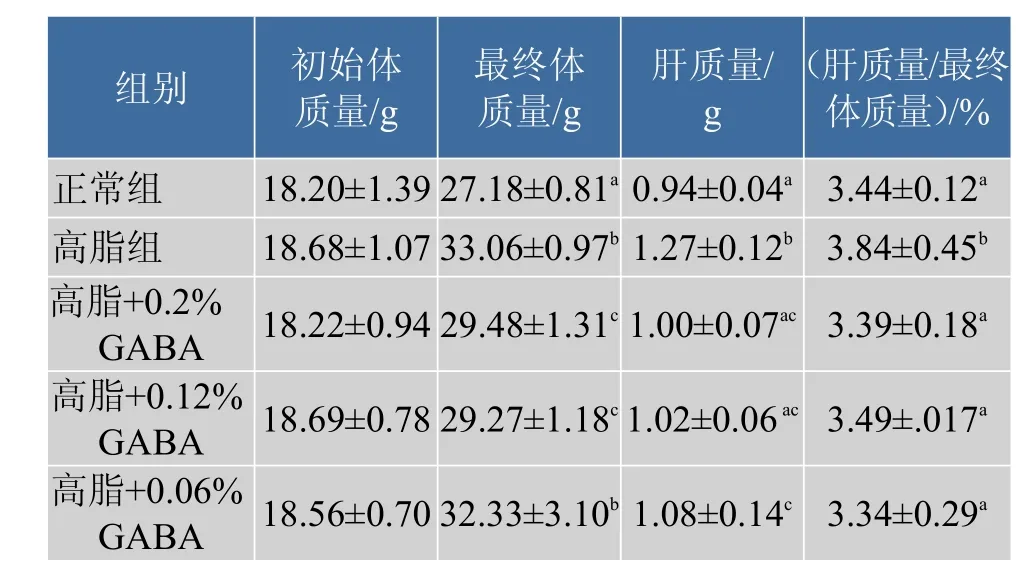
表3 小鼠体质量和肝脏质量(n=10,x±s)Table 3Body weight and liver weight(n=10,x±s)
2.2 GABA对高脂日粮小鼠肝脏氧化应激的影响
实验各组氧化还原指标见表4、5。与正常组相比,高脂组动物肝脏ROS和MDA含量显著升高,抗氧化指标CAT、GSH-Px、SOD和T-AOC水平显著下降(P<0.05)。添加质量分数0.2%和0.12% GABA可显著降低肝脏ROS和丙二醛MDA含量,升高CAT、GSH-Px、SOD和T-AOC水平(P<0.05);而添加质量分数0.06%GABA仅部分改善肝脏氧化还原状态,即显著降低肝脏MDA含量,升高CAT水平(P<0.05),说明GABA在肝脏的抗氧化作用呈现剂量依赖效应。
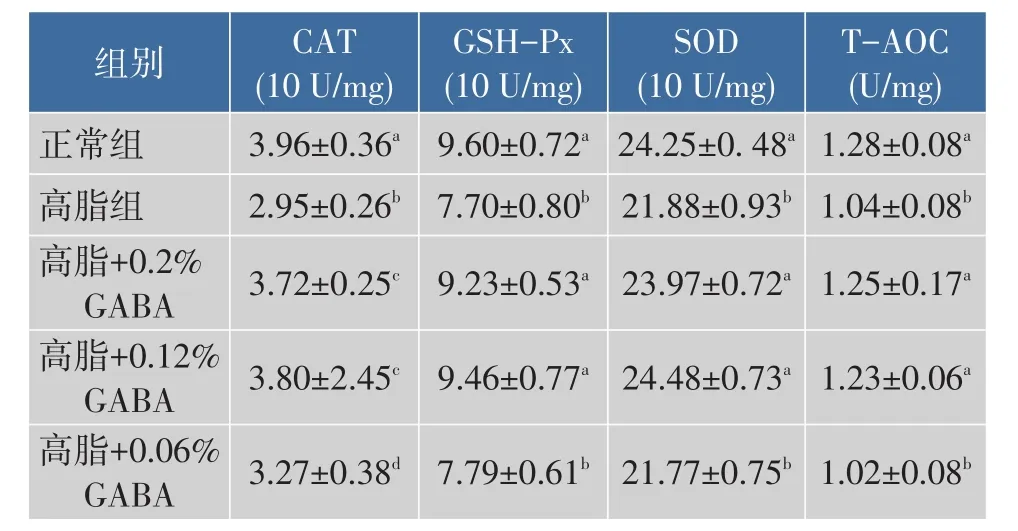
表4 GABA对高脂日粮小鼠肝脏抗氧化指标影响(n=10,x±s)Table 4Effect of GABA on liver antioxidant index of high-fat fed mice(n=10,x±s)
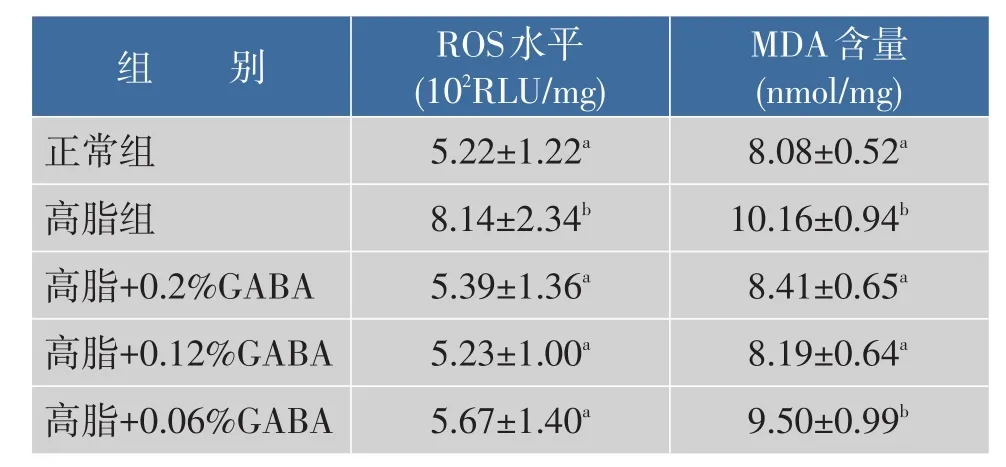
表5 GABA对高脂日粮小鼠肝脏ROS和MDA含量的影响(n=10,x±s)Table 5Effect of GABA on liver ROS and MDA of highfat fed mice(n=10,x±s)
2.3 GABA对高脂日粮小鼠肝脏脂肪含量和组织形态的影响
由图1可知,与正常组相比,高脂组肝脏中TG、TC含量均显著增高(P<0.05)。形态学观察也显示高脂饲喂后肝组织出现脂肪变性。添加质量分数0.2%和0.12%GABA可显著降低高脂引起的肝脏中TG、TC积累(P<0.05),而质量分数0.06%GABA只能降低肝脏TG含量,程度比质量分数0.2%和0.12%GABA的差。HE染色显示(图2),尽管3种剂量GABA均能减少肝脏组织脂肪颗粒数量和大小,但质量分数0.2%和0.12%GABA显示出优于质量分数0.06%GABA的效果。
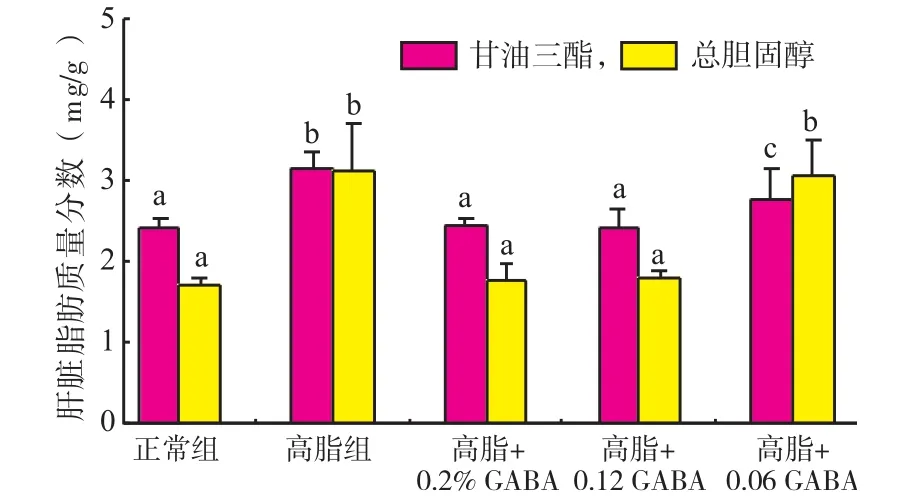
图1 GABA对高脂日粮小鼠肝脏脂肪含量的影响Figure 1Effect of GABA on lipid content of liver in high-fat fed mice
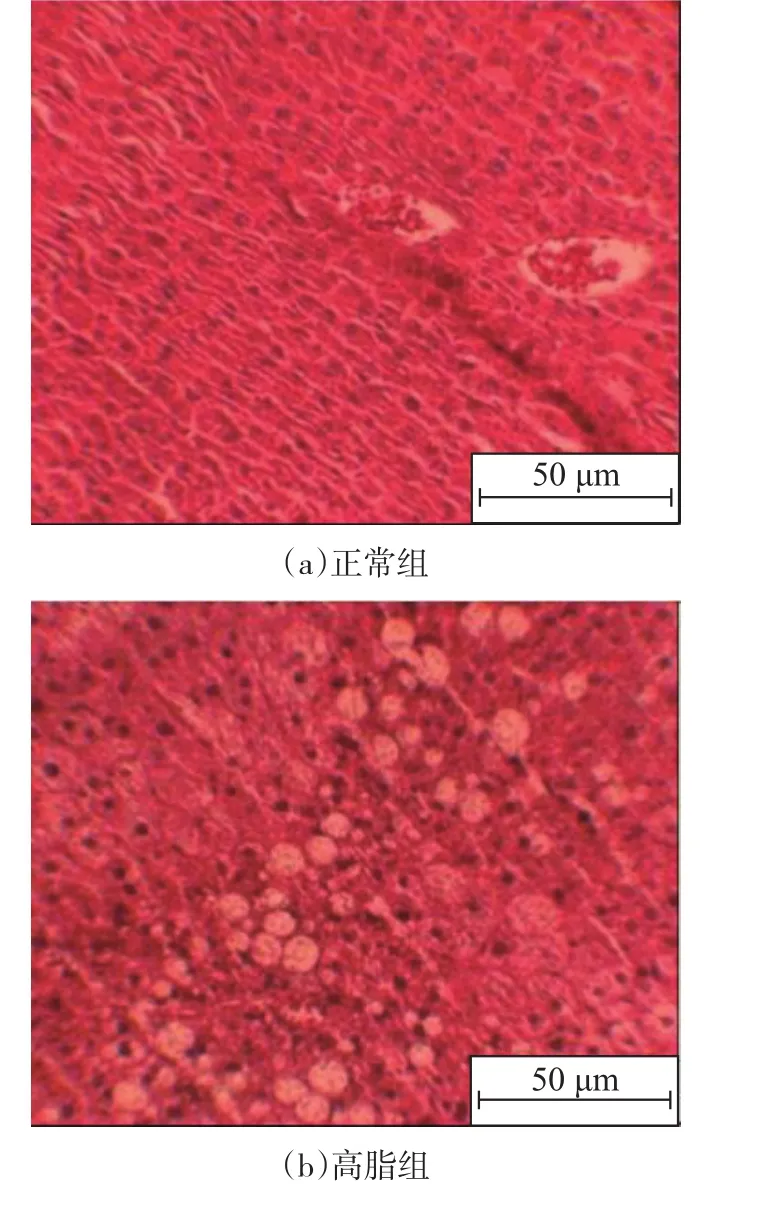

图2 GABA对高脂日粮小鼠肝脏组织形态的影响Figure 2Effect of GABA on liver histomorphology in high-fat fed mice
2.4 GABA对高脂日粮小鼠血浆转氨酶活性和肝脏糖原含量的影响
用血浆转氨酶活性和肝脏糖原含量来表示肝脏的功能(图3)。高脂组小鼠血浆谷丙转氨酶和谷草转氨酶活性相比正常组小鼠显著升高,肝脏糖原含量显著下降(P<0.05),提示肝脏功能下降。添加质量分数0.2%和0.12%GABA后,血浆谷丙转氨酶和谷草转氨酶活性均恢复到正常水平;而添加质量分数0.06%GABA仅降低谷草转氨酶活性(P<0.05)。3种剂量GABA处理后,肝脏糖原含量均恢复到正常水平(P<0.05)。所以GABA用来改善肝脏功能,需要一定的给予剂量。
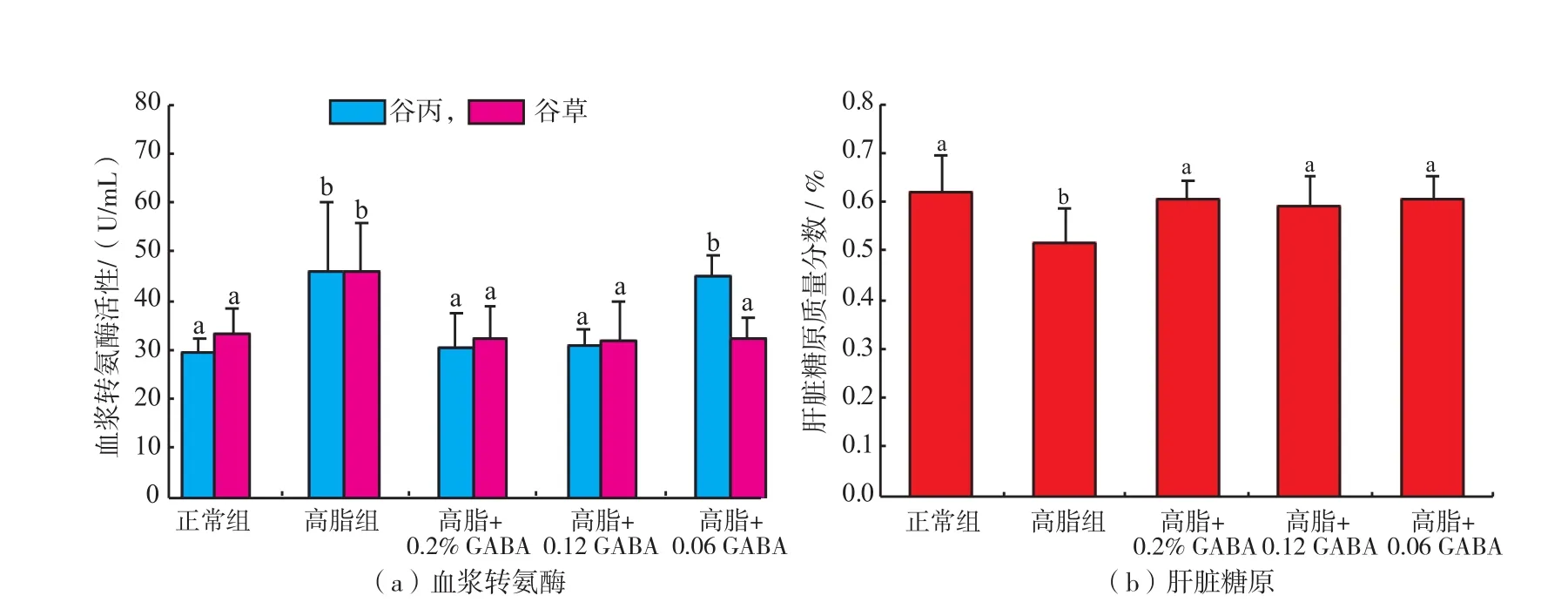
图3 GABA对高脂日粮小鼠血浆转氨酶活性和肝脏糖原浓度的影响Figure 3Effect of GABA on plasma transaminase activities and liver glycogen content in high-fat fed mice
2.5 GABA对高脂日粮小鼠肝脏脂肪代谢相关基因表达的影响
与脂肪代谢相关的基因表达水平见图4。
长期高脂日粮显著上调与脂肪合成相关的基因SREBP-1c、FAS和ACC1,下调与脂肪分解代谢相关的基因的表达水平PPARα、Cpt1a和PGC-1α(P<0.05),提示肝脏脂肪代谢在高脂日粮下出现紊乱。
在高脂日粮基础上,添加质量分数0.2%和0.12%GABA能显著下调SREBP-1c表达,上调FAS和ACC1表达(P<0.05),从而改善肝脏脂肪代谢的异常。但是添加质量分数0.06%GABA只能部分地恢复与脂肪代谢相关的基因表达(下调FAS和ACC1表达,上调PPARα和PGC-1α表达)。

图4 GABA对高脂日粮小鼠肝脏脂肪代谢相关基因表达的影响Figure 4Effect of GABA on expressions of lipid-associated genes in liver of high-fat fed mice
3 讨论
近年来,越来越多的肥胖病患显示与脂肪肝的发生密切相关[12],引起肝脏功能损伤,因此脂肪肝被认为是代谢综合症的表现之一[13]。本研究结果显示,高脂日粮饲喂相比正常日粮能显著增加肝脏质量、肝指数,同时肝脏中较高的甘油三酯和胆固醇含量增加了脂肪肝风险,肝脏组织形态学观察也进一步证实肝脏中有脂肪球的形成,提示肝脏中脂质异常积累。而高脂组动物肝血浆转氨酶显著升高和肝糖原水平显著下降,证实肝功能发生损伤。这些结果与以前高脂日粮导致脂肪肝、肝功能损伤的报道一致[14]。GABA作为一种食品功能成分,能对抗高脂诱导的肥胖发生[15],但其对脂肪肝的作用尚未见报道。本实验结果显示,相比高脂组,添加了质量分数0.2%、0.12%和质量分数0.06%GABA并饮水后显著降低了小鼠的肝脏质量和肝指数,但只有添加质量分数0.2%和0.12%GABA能显著降低肝脏中甘油三酯和胆固醇含量,改善肝组织中脂肪沉积,恢复转氨酶水平和肝糖原含量。质量分数0.06%GABA则只能部分改善肝脂肪变性(降低肝脏甘油三酯含量)和肝功能(恢复谷草转氨酶)。提示GABA预防脂肪肝发生需要一定的剂量。
尽管非酒精性脂肪肝与代谢综合症密切相关,但其具体机制仍然不很清楚。高能饮食诱发机体产生较多的ROS,氧化损伤蛋白质等大分子,引起脂类代谢紊乱[16]及脂肪肝发生,最终影响肝细胞正常功能。Takaki报道肝脏氧化应激与脂肪肝严重化发展密切相关[17]。所以氧化应激被认为脂肪肝发生、发展的重要病因之一[18]。因此通过改善肝脏的氧化应激可能是预防脂肪肝发生的途径之一。本实验结果显示,长期高脂日粮后,肝脏ROS显著升高,抗氧化能力(SOD、CAT、T-AOC)较正常组显著下降,脂质过氧化产物MDA显著升高。添加质量分数0.2%和0.12%GABA能显著缓解肝脏氧化应激,降低ROS和MDA含量,恢复抗氧化能力。提示GABA改善氧化应激可能是其预防脂肪肝和改善肝脏功能的途径之一。据Gardner报道,GABA受体激动剂能显著改善肝脏的氧化应激[19]。因此,GABA在肝脏的抗氧化作用可能通过其受体实施,但具体机制需要进一步研究。
本实验中还对GABA抑制脂肪肝形成的可能机制进行了研究。脂肪合成转录因子SREBP-1c由于激活促进脂肪合成通路,被认为与脂肪肝形成密切相关[20]。研究结果显示,相比正常组,高脂组动物肝脏SREBP-1c表达显著升高,脂肪酸合成关键酶表达显著升高,提示肝脏脂肪合成加快,对应的脂肪分解代谢相关基因PPARα和Cpt1a表达下降,分别提示脂肪酸转运入线粒体效率减慢和脂肪β-氧化分解减慢,使肝细胞内的脂肪酸及脂酰辅酶A大量沉积,促成脂肪在肝脏积累。此外,由于PGC-1α激活能通过增强线粒体功能加快脂肪氧化,也对脂肪肝形成起着关键作用。在本研究中,高脂日粮使表达显著下调,表明线粒体功能受损,进一步减弱了脂肪分解功能。添加质量分数0.2%和0.12% GABA显著降低SREBP-1c、ACC1和FAS表达,升高PPARα、Cpt1a和PGC-1α表达,表明一定剂量的GABA摄入能降低肝脏脂肪合成速度,加快脂肪酸转运进入线粒体,而且显著上调PGC-1α的表达,提示通过恢复线粒体功能而促进脂肪酸氧化,提供了GABA减弱脂肪肝的另一种可能机制,但GABA作用于PGC-1α的具体通路有待于进一步研究。相比质量分数0.06%GABA仅能下调ACC1和FAS,上调PPARα和PGC-1α,这与前述的部分恢复肝功能、降低肝脏脂肪变性相一致。
4 结语
综上所述,本研究表明一定剂量的GABA能显著改善小鼠肝脏氧化应激、脂肪肝发生及肝脏功能,这种作用可能是通过降低小鼠肝脏脂肪合成基因SREBP-1c、ACC1和FAS表达,并增加脂肪降解相关基因PPARα、Cpt1a的表达实现的,而GABA上调PGC-1α表达则表明,GABA部分通过增强线粒体功能来增加肝脂肪降解,实现预防脂肪肝发生。
[1]Powell E E,Cooksley W G,Hanson R,et al.The natural history of nonalcoholic steatohepatitis:a follow-up study of forty-two patients for up to 21 years[J].Hepatology,1990,11(1):74-80.
[2]Sharabi Y,Eldad A.Nonalcoholic fatty liver disease is associated with hyperlipidemia and obesity[J].Am J Med,2000,109(2):171.
[3]Sekiya M,Yahagi N,Matsuzaka T,et al.Polyunsaturated fatty acids ameliorate hepatic steatosis in obese mice by SREBP-1 suppression[J].Hepatology,2003,38(6):1529-1539.
[4]Shimano H,Horton J D,Shimomura I,et al.Goldstein,Isoform 1c of sterol regulatory element binding protein is less active than isoform 1a in livers of transgenic mice and in cultured cells[J].J Clin Invest,1997,99(5):846-854.
[5]Takahashi N,Senda M,Lin S,et al.Auraptene regulates gene expression involved in lipid metabolism through PPARalpha activation in diabetic obese mice[J].Mol Nutr Food Res,2011,55(12):1791-7197.
[6]Zammit V A.Carnitine palmitoyltransferase 1:Central to cell function[J].IUBMB Life,2008,60(5):347-354.
[7]St-Pierre J,Drori S,Uldry M,et al.Suppression of reactive oxygen species and neurodegeneration by the PGC-1 transcriptional coactivators[J].Cell,2006,127(2):397-408.
[8]XIE Zhenxing,XIA Shufang,LE Guowei.Gamma-aminobutyric acid improves oxidative stress and function of the thyroid in highfat diet fed mice[J].J Funct Foods,2014(8):76-86.
[9]Lowry O H,Rosebrough N J,Farr A L,et al.Protein measurement with the Folin phenol reagent[J].J Biol Chem,1951,193:265-275.
[10]Kobayashi H,Gil-Guzman E,Mahran A M,et al.Quality control of reactive oxygen species measurement by luminol-dependent chemiluminescence assay[J].J Androl,2001,22(4):568-574.
[11]Song Y,Lee S J,Jang S H,et al.Sasa borealis stem extract attenuates hepatic steatosis in high-fat diet-induced obese rats[J]. Nutrients,2014,6(6):2179-2195.
[12]Torun E,Gökçe S,Ozgen L T,et al.Serum paraoxonase activity and oxidative stress and their relationship with obesity-related metabolic syndrome and non-alcoholic fatty liver disease in obese children and adolescents[J].J Pediatr Endocrinol Metab,2014,27(7-8):667-675.
[13]Paredes A H,Torres D M,Harrison S A.Nonalcoholic fatty liver disease[J].Clin Liver Dis,2012,16(2):397-419.
[14]Li S,Liao X,Meng F,et al.Therapeutic role of ursolic acid on ameliorating hepatic steatosis and improving metabolic disorders in high-fat diet-induced non-alcoholic fatty liver disease rats[J].PLoS One,2014,9(1):e86724.
[15]Tian J,Dang H N,Yong J,et al.Oral treatment with gamma-aminobutyric acid improves glucose tolerance and insulin sensitivity by inhibiting inflammation in high fat diet-fed mice[J].PLoS One,2011,6(9):e25338.
[16]鲁军,任迪锋.钝顶螺旋藻的体内抗氧化和护肝作用[J].食品与生物技术学报,2009,28(6):777-780.
LU Jun,REN Difeng.Anti-oxidant and hepato-protective effeet of Spirulina platensis in VIVO[J].Journal of Food Science and Biotechnology,2009,28(6):777-780.(in Chinese)
[17]Takaki A,Kawai D,Yamamoto K.Molecular mechanisms and new treatment strategies for non-alcoholic steatohepatitis(NASH)[J].Int J Mol Sci,2014,15(5):7352-7379.
[18]Mantena S K,King A L,Andringa K K,et al.Mitochondrial dysfunction and oxidative stress in the pathogenesis of alcohol and obesity induced fatty liver diseases[J].Free Radic Biol Med,2008,44(7):1259-1272.
[19]Gardner L B,Hori T,Chen F,et al.Effect of specific activation of gamma-aminobutyric acid receptor in vivo on oxidative stressinduced damage after extended hepatectomy[J].Hepatol Res,2012,42(11):1131-1140.
[20]Yang Z X,Shen W,Sun H.Effects of nuclear receptor FXR on the regulation of liver lipid metabolism in patients with nonalcoholic fatty liver disease[J].Hepatol Int,2010,4(4):741-748.
GABA Inhibits the Liver Oxidative Stress and Hepatic Steatosis in High-Fat Diet-Fed Obese Mice
XIE Zhenxing1,3,LI Xiu2,GENG Xu3,XIA Shufang2,LE Guowei*1,2,SHI Yonghui1,2
(1.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China;3.Medical College,Henan University,Kaifeng 475001,China)
The effects of gamma-aminobutyric acid(γ-aminobutyric acid,GABA)on oxidative stress,liver function,hepatic steatosis and lipid metabolism-related gene expression were studied in the liver of high-fat diet fed mice.50 C57BL/6 male mice were randomly divided into five groups:normal group(normal diet),high fat diet group(high fat diet),and three GABA groups(0.2%,0.12%and 0.06%GABA in drinking water,respectively).After 18 weeks,reactive oxygen species(ROS)levels,antioxidant enzyme activities,contents of lipid and glycogen in liver and plasma activities of alanine aminotransferase and aspartate aminotransferase were measured.In addition,the morphological features of liver tissue were observed and the expressions of SREBP-1c,FAS,ACC1,PPARα,Cpt1a and the PGC-1α in liver were measured by using of RT-PCR.The results showed that in high-fat diet fed mice,liver weight,liver index,triglyceride and cholesterol contents in liver increased significantly with damaged liver function;0.2%,0.12%and 0.06%GABA treatments can significantly reduce liver weight and liver index;0.2%,0.12%GABA treatments significantly inhibited hepatic steatosis and improved liver function.Compared with that of in normal group,high fat diet treatment significantly reduced antioxidant enzyme activities and increased ROS and malondialdehyde(MDA)contents;0.2%and 0.12%GABA treatments significantly alleviated oxidative stress.In liver of highfat diet fed mice,expressions of PPARα,Cpt1a PGC-1α were significantly reduced,while,expressions of SREBP-1c,FAS and ACC1 were remarkably increased,but both 0.2%and 0.12% GABA supplements can significantly alleviate the gene expression changes that high fat caused.Thus,high-fat diet treatment led to oxidative stress in liver,steatosis and damaged liver function. Meanwhile,a certain dose of GABA can improve redox status and fat metabolisms,thereby preventing the occurrence of fatty liver.
high fat,oxidative stress,fatty liver,hepatic steatosis,GABA
R 151.2
A
1673—1689(2015)06—0613—08
2014-07-17
国家“十二五”科技支撑计划项目(2012BAK17B09 2013BAD19B09)。
*通信作者:乐国伟(1956-),男,浙江宁波人,农学博士,教授,博士研究生导师,主要从事营养代谢与调控方面的研究。E-mail:lgw@jiangnan.edu.cn
