双重抗炎功能超分子水凝胶的构建及其形貌、性质和性能
2015-11-20徐佳施瑜陈荆晓陈敬华
徐佳,施瑜,陈荆晓,陈敬华*
(1.江南大学直属附属医院(无锡市第四人民医院)药学部,江苏无锡 214062;2.江南大学药学院,江苏无锡 214122)
双重抗炎功能超分子水凝胶的构建及其形貌、性质和性能
徐佳1,2,施瑜2,陈荆晓2,陈敬华*2
(1.江南大学直属附属医院(无锡市第四人民医院)药学部,江苏无锡 214062;2.江南大学药学院,江苏无锡 214122)
用经β-环糊精修饰的壳聚糖为主体大分子、抗炎药物布洛芬修饰的葡聚糖为客体大分子,制备得到具有双重抗炎功能的超分子水凝胶。扫描电子显微镜观测表明,水凝胶具有均一的孔洞结构。药物布洛芬可在酯酶的作用下快速释放,而在无酯酶存在时稳定保存于水凝胶中。并且,这一水凝胶具有良好的抗菌及抗炎作用,对于临床外伤修复具有潜在的应用价值。
水凝胶;抗炎;抑菌;布洛芬;壳聚糖
水凝胶是一种软湿性材料,在生物医学领域具有重要作用[1]。在近年的组织工程研究及临床治疗当中,水凝胶不仅可以作为支架材料,提供组织修复所需的支撑作用,还能够利用水凝胶内部多孔的性质,实现气体、液体、营养物质的交换以及药物的缓释作用[2]。这类材料在对皮肤组织的修复治疗中展示出了良好的性能,不仅能保护伤口,还能保持创面湿润,促进修复[3]。不过,目前绝大部分水凝胶材料本身尚难以解决皮肤组织修复过程中的炎症反应。这是皮肤组织修复当中常见的病理过程,一般由炎症细胞分泌多种炎性因子而引发。炎症反应可在一定程度上促进组织的更新修复,但过度的炎症反应又会造成组织的红肿、疼痛,甚至坏死[4]。尤其是烧伤等大面积皮肤损伤的病人,对炎症反应程度的控制更为重要[5]。为解决这些问题,目前有研究通过在水凝胶材料中加入抗炎药物以缓解炎症,但药物易流失导致效果不持久。此外,临床治疗中还需要避免由细菌等病原体造成的感染,以及进而产生的炎症反应。近年来,超分子水凝胶由于其制备容易、机械强度可调控、易于实现、可注射化等优点,而吸引了众多研究人员的关注[6]。一方面,超分子水凝胶主要依赖于凝胶因子通过分子间的亲疏水、静电、主客体作用等非共价作用力形成。这些凝胶化过程避免了化学反应,不会改变凝胶因子的特殊生物化学及物理化学性质,对于材料活性的保持具有较好的作用。另一方面,可选择制备超分子水凝胶的材料种类多,蛋白质、多糖等具有良好生物活性的材料也逐渐作为凝胶因子制备水凝胶,更进一步扩展了水凝胶材料在临床治疗中的应用范围[7]。
为解决皮肤损伤修复中重度炎症的问题,本研究中设计制备了一种具有双重抗炎功能的超分子水凝胶。将主体分子β-环糊精(β-CD)与具有抗菌性能的壳聚糖(Chitosan,CS)连接制备得到主体大分子(CS-CD),将具有抗炎作用的药物布洛芬(Ibuprofen,Ibu)与具有良好稳定性且能促进细胞生长的葡聚糖(Dextran,Dex)连接制备得到客体大分子,之后利用β-CD与布洛芬之间的主客体识别作用制备超分子水凝胶。期望这一水凝胶既可以抑制因细菌生长造成的炎症,又可以抑制由大量炎症因子产生的过度炎症。对水凝胶的形成、微观形貌和流变学性质进行了考察,并且对水凝胶的抑菌性能、抗炎性能进行了评价。
1 材料与方法
1.1 材料与试剂
葡聚糖(Mw20 000)、β-环糊精、对甲苯磺酰氯、乙基[3-(二甲胺基)丙基]碳二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS),购自国药集团化学试剂有限公司;壳聚糖(Mw40 000)、胆碱酯酶、脂多糖(LPS),购自生工生物工程(上海)有限公司;布洛芬、N,N'-二环己基碳二亚胺(DCC)、4-二甲氨基吡啶(DMAP),购自阿拉丁试剂(中国)有限公司;大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus),由江南大学药学院提供;TNF-α酶联免疫试剂盒,购于北京GenStar公司。
1.2 主要仪器
FreeZone 2.5型冷冻干燥机,美国Labconco公司制造;S-4800型扫描电子显微镜,日本日立仪器有限公司制造;Avance III型核磁共振波谱仪,德国Bruker公司制造;AR-G2型流变仪,美国TA公司制造;Nexus470型傅里叶红外光谱仪,美国Nicolet公司制造;UV-2550型紫外可见分光光度计,日本岛津公司制造;DAWN-HELEOS-II型凝胶渗透液相色谱-光散射联用仪,美国Waytt公司制造。
1.3 实验方法
1.3.1 单(6-对甲苯磺酰基)-β-环糊精(β-CDOTs)的制备β-CD-OTs参照文献报道方法制备[8],将5 g(4.4 mmol)β-CD溶于120 mL去离子水中,之后加入20 mL NaOH溶液(2.5 mol/L),反应30 min。将1.3 g(6.9 mmol)对甲苯磺酰氯溶于20 mL乙腈中,缓慢滴入上述反应液,室温下剧烈搅拌2~3 h。反应结束后将得到的悬浮液过滤,并用适量的NH4Cl调节pH至8,得到的溶液冷却至4℃,真空抽滤收集沉淀。之后粗产品用去离子水重结晶3次,得到产品1.14 g,产率22.8%。
1.3.2 氨基化β-环糊精(β-CD-NH2)的制备β-CD-NH2参照文献报道方法制备[9],称取2 g(1.55 mmol)β-CD-OTs和1.2 g(7.75 mmol)1,8-二氨基-3,6-二氧杂辛烷,溶于5 mL新蒸NMP中,加入25 mg(0.15 mmol)KI,于氮气保护下70℃反应过夜。反应结束后冷却至室温,用乙醇沉淀产物,并用乙醇与乙醚反复洗涤。产物用阳离子交换树脂进一步纯化,并于50℃真空干燥箱过夜,得到产品1.53 g,产率78.1%。
1.3.3 环糊精功能化壳聚糖(CS-CD)的制备称取1 g(6.2 mmol单糖单元)壳聚糖,溶于10 mL去离子水,加入0.3 mL(4 mmol)新蒸的丙烯酸,于50℃下搅拌反应2 d。反应结束后,用截留相对分子质量3 500的透析袋透析3 d,冷冻干燥得到羧基化壳聚糖。之后称取羧基化壳聚糖0.5 g,溶于10 mL去离子水中,室温搅拌下加入0.34 g(1.8 mmol)EDC及0.21 g(1.8 mmol)NHS活化羧基,并调节pH至5.5。反应2 h后加入1.13 g β-CD-NH2,继续反应24 h,之后将溶液倒入14 kDa透析袋中对水透析3 d,冷冻干燥得CS-CD产品。环糊精的取代度通过酚酞法于552 nm处的吸光度值测定,CS-CD的相对分子质量通过GPC-MALS测定。
1.3.4 葡聚糖-布洛芬(Dex-Ibu)的制备称取1.62 g(10 mmol单糖单元)葡聚糖溶于15 mL新蒸DMSO中,搅拌下缓慢加入1.92 g(9.3 mmol)DCC、1.13 g(9.3 mmol)DMAP及1.28 g(6.2 mmol)布洛芬,室温下通氮气反应24 h,滤除不溶物,产物用乙醇沉淀,并用乙醇、乙醚反复洗涤,将产物溶于去离子水,用3.5 kDa透析袋对水透析3 d,冷冻干燥得产品Dex-Ibu。布洛芬的接枝量通过Dex-Ibu的DMSO溶液在272 nm处的吸光度值测定,Dex-Ibu的相对分子质量通过GPC-MALS测定。
1.3.5 超分子水凝胶的制备及形貌观测将一定质量的CS-CD与Dex-Ibu分别按表1配制为不同质量分数的溶液,之后各取0.5 mL于室温下混合均匀,观察凝胶化现象。之后将形成的水凝胶冷冻干燥,冻干样品通过S-4800型扫描电子显微镜观测水凝胶孔洞的微观形貌。
1.3.6 水凝胶的流变学性能实验超分子水凝胶的流变性能采用AR-G2型流变仪于25℃条件下测定。采用20 mm平行板夹具,首先测定应变从0.01%至100%的变化过程中水凝胶的流变学行为。之后,确定应变,对水凝胶的形成进行时间的动态扫描,混合两种凝胶因子溶液时开始扫描,扫描时间持续10 min。
1.3.7 水凝胶的体外药物释放实验分别测定水凝胶Gel-3在PBS(pH 7.4)及在含有20 U胆碱酯酶溶液中的药物释放行为。首先将胆碱酯酶溶于PBS(pH 7.4)中,配成20 U/mL的酶溶液。将水凝胶分别装入两个3 500 Da的透析袋中,一组加入5 mL PBS(pH 7.4),一组加入1 mL酶溶液及4 mL PBS(pH 7.4),然后分别放入50 mL的离心管中,加10 mL PBS(pH 7.4),再将离心管置于37℃、100 r/min的摇床上进行药物释放实验,在设定的间隔时间将溶液吸出,同时补充等量新鲜PBS,药物释放行为通过缓冲液在264 nm的吸光度值测定,实验平行3次。
1.3.8 水凝胶的抑菌性能测试将大肠杆菌、金黄色葡萄球菌接种到LB液体培养基中,一组作空白对照,另外3组分别加入经过Co60射线照射灭菌的壳聚糖、葡聚糖及冻干水凝胶,至质量分数为10%。之后将试样置于37℃、220 r/min恒温摇床上培养,以培养基为空白对照,分别测量不同时间段菌液的光密度(OD600)值。浓度较大的菌液测定时须将其用培养基稀释一定倍数,使其OD值在0.1~0.3范围内。参照文献[10]方法,利用光密度值估算菌体浓度,通过菌体浓度间接得到不同物质对菌体的抑制生长曲线,实验重复平行3次。
1.3.9 水凝胶的抗炎性能测试以TNF-α为细胞炎症因子模型,表征材料的抗炎性能。将RAW 264.7细胞培养至对数生长期,用胰酶消化,重悬并调整细胞浓度至5×105个/mL,于96孔培养板中接种细胞悬液100 μL/孔,在含质量分数5%CO2的培养箱中37℃孵育过夜,小心移去培养基,每孔加入200 μL含LPS(5 μg/mL)的培养基,以只加入LPS为炎症因子刺激对照,壳聚糖和葡聚糖为阳性对照,测试组加入20 μg冻干水凝胶样品,继续在培养箱中孵育48 h,TNF-α的含量通过ELISA法进行测定。
2 结果与分析
2.1 CS-CD的结构表征
主体大分子CS-CD的化学结构通过核磁共振氢谱进行确认,如图1所示。从谱图中看出,δ5.5处出现了比较明显的峰,这是糖环C1位上质子氢的峰,由于连接环糊精,这个峰的峰面积增大。此外,在δ3附近出现了1,8-二氨基-3,6-二氧杂辛烷上亚甲基的氢的峰。此外,通过GPC-MALS测定CS-CD的重均分子量为74.9 kDa。这说明环糊精分子已经连接到壳聚糖侧链上,大分子主体CS-CD成功得以制备。另外,通过紫外-可见分光光度计,利用酚酞法测定环糊精在CS-CD中的取代度约为9.8%,计算得到的相对分子质量也与测定得到的相对分子质量相吻合。
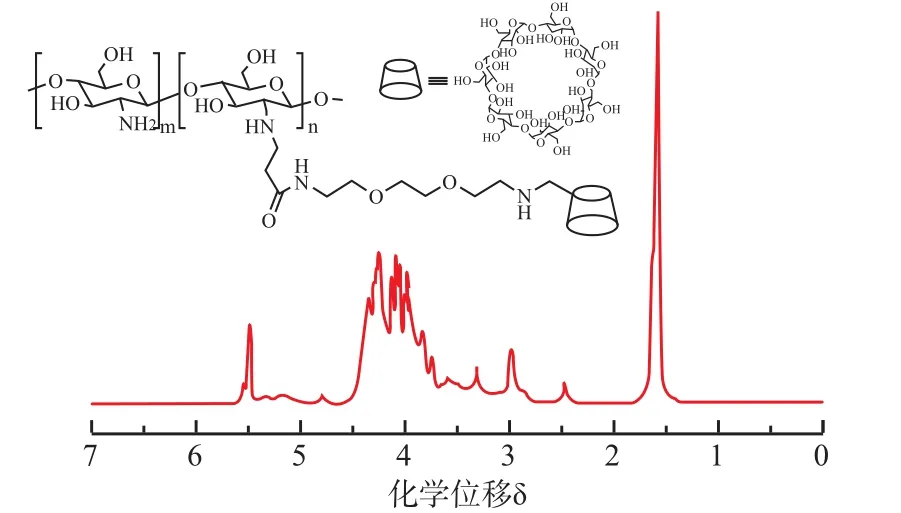
图1 CS-CD在D2O中的1H NMR谱图Fig.11H NMR spectrum of CS-CD in D2O
2.2 Dex-Ibu的结构表征
大分子客体Dex-Ibu通过连接抗炎药物布洛芬和葡聚糖制备得到,其化学结构通过核磁共振氢谱进行确认,如图2所示。从图中可以看出,在δ7.2处出现了布洛芬苯环的特征峰,在δ0.7处出现了布洛芬分子上异丙基上氢的峰,说明布洛芬已经成功与葡聚糖分子连接。通过峰面积计算可得布洛芬分子的取代度约为9.8%。采用GPC-MALS测定产品Dex-Ibu的重均分子量为23.2 kDa。另外,通过紫外光谱测定得到Dex-Ibu中布洛芬的取代度约为10.2%。这与核磁计算结果相吻合,计算得到的相对分子质量也与测定得到的相对分子质量相吻合,说明客体大分子Dex-Ibu已成功制备。
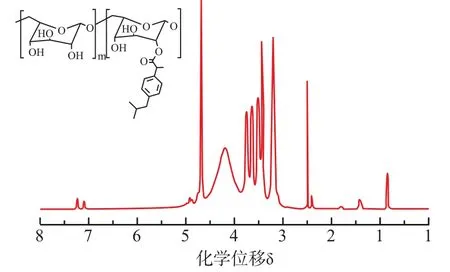
图2 Dex-Ibu在d6-DMSO中的1H NMR谱图Fig.21H NMR spectrum of Dex-Ibu in d6-DMSO
2.3 凝胶化调控及水凝胶的形貌分析
所设计的超分子水凝胶主要通过β-CD和Ibu之间形成主客体包合物以固定两种大分子,进而形成水凝胶。因此超分子水凝胶的凝胶化过程通过调节主体大分子CS-CD和客体大分子Dex-Ibu的浓度及量来进行,结果如表1所示。
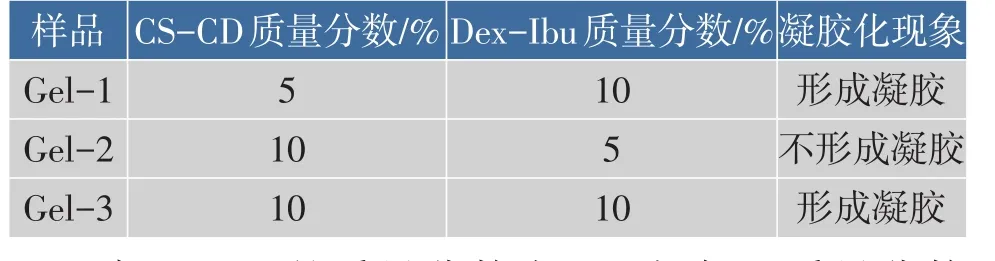
表1 凝胶因子CS-CD和Dex-Ibu的配比Table 1Contents of gelators CS-CD and Dex-Ibu
当CS-CD的质量分数为5%时,加入质量分数为10%的Dex-Ibu,可观测到从溶液向凝胶转变的过程,但形成的水凝胶强度较低。这说明Ibu可与β-CD形成包合物,但形成包合物数量有限,因此水凝胶强度不高。而当Dex-Ibu的质量分数为5%时,加入CS-CD无法有效凝胶化。这主要是由于Ibu水溶性不佳,在溶液中易被Dex分子包裹在内部,导致体系中客体分子数量有限,无法有效形成包合物进而凝胶化。当提高两种凝胶因子的质量分数至10%,可快速形成稳定的超分子水凝胶Gel-3。因此,后续形貌测试采用Gel-3为样品进行测试。
水凝胶的内部孔洞的微观结构通过扫描电镜进行观测,如图3所示。可以看出,通过CS-CD和Dex-Ibu形成的超分子水凝胶具有孔隙结构完整、大小均匀的特点,孔径约为20 μm。这一规整的多孔结构有利于液体及营养物质在水凝胶材料内的交换和传输,可保持伤口湿润,利于组织修复。

图3 超分子水凝胶(Gel-3)的SEM照片Fig.3SEM image of the supramolecular hydrogel(Gel-3)
2.4 水凝胶流变学性能分析
超分子水凝胶Gel-3的流变学性能通过流变仪进行测定,结果如图4所示。首先对其进行动态应变扫描以确定其线性粘弹范围,见图4(a)。从图中可以看出,CS-CD与Dex-Ibu通过主客体相互作用形成的超分子水凝胶具有典型的动态应变曲线,应变从0.01%至100%逐渐变化增加。在初始阶段,水凝胶的储存模量(G′)和损耗模量(G″)基本保持不变,且储存模量较高,此时水凝胶表现为半固体性质。而当应变超过3%时,水凝胶的弹性模量下降,当应变超过10%时,G′<G″,水凝胶表现为溶液性质。这主要是由于应变的增加导致水凝胶的网络结构遭到破坏。此后,确定应变为1%,继续对水凝胶的形成过程及随时间变化的流变学性能进行研究,见图4(b)。当主体大分子和客体大分子混合之后,水凝胶迅速形成,从图中可以看出,G′>G″,说明当两种凝胶因子混合以后,CD和Ibu之间通过主客体识别立即形成包合物,水凝胶表现出半固体性质。并且随时间的延长,两者均有所增加,说明包合物含量随时间增加而逐渐增加,水凝胶强度增加。
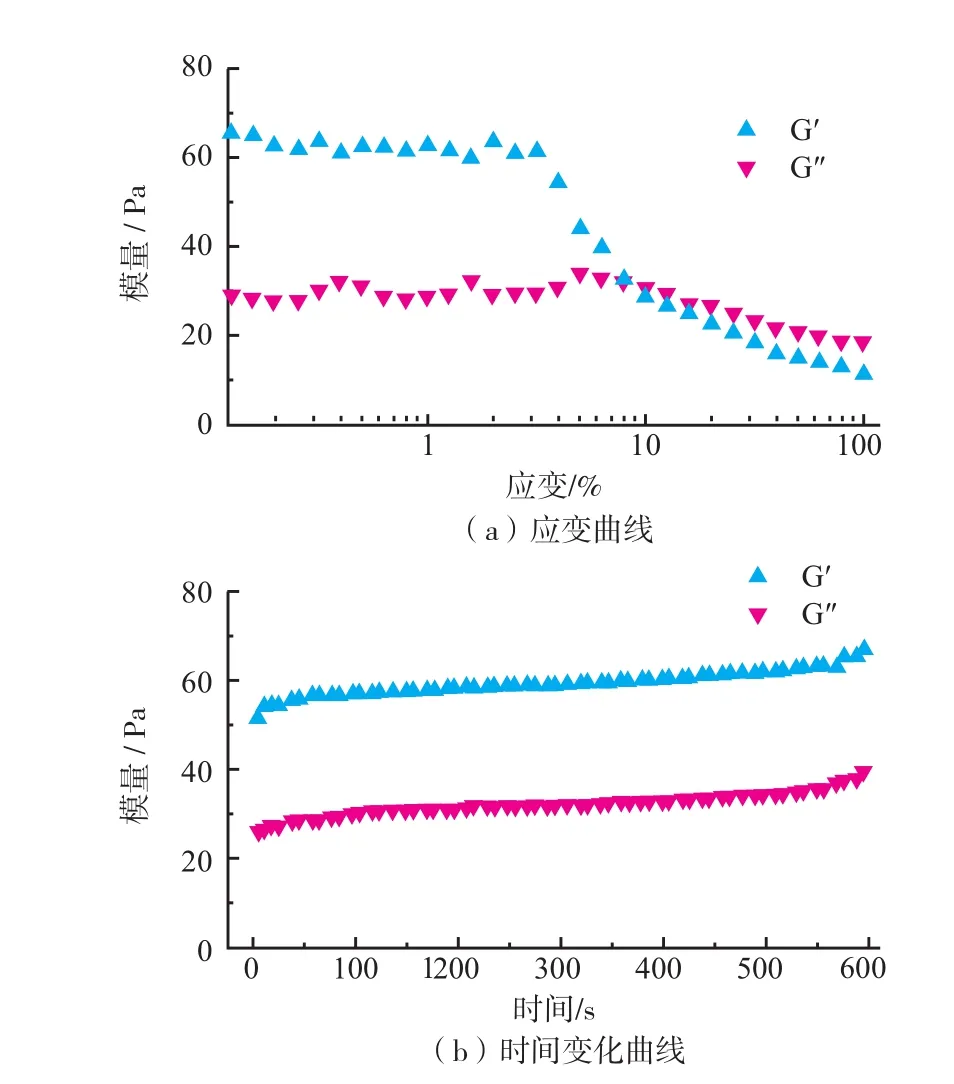
图4 超分子水凝胶的流变学研究结果Fig.4Oscillatory rheology of the supramolecular hydrogel
2.5 体外药物释放行为
水凝胶的体外药物释放行为分别在PBS及含有酯酶的环境下测试,结果如图5所示。

图5 水凝胶体外药物释放曲线Fig.5In vitro drug release profiles of the hydrogel
可见在PBS(pH 7.4)溶液中,布洛芬几乎无释放,而水凝胶也稳定存在于体系当中,说明水凝胶在不含有酶的环境下可稳定存在,由布洛芬产生的药效能保持稳定。而在含有酯酶的溶液中,布洛芬快速释放,水凝胶逐渐解体。这主要是由布洛芬与葡聚糖之间通过酯键连接,当体系含有酯酶时,酯酶能快速断裂酯键,进而释放出布洛芬。达到约3 h释放接近平衡,布洛芬的累计释放率约为88.3%。另外约10%的布洛芬并未从体系中释放,这是由于布洛芬与环糊精形成了较为稳定的包合物,这也说明凝胶化的原因确实是由β-CD和Ibu之间形成包合物所致。同时,这一性质也有利于调控药物的释放行为,可延长布洛芬在应用中的作用时间和效果,避免因药物流失而造成抗炎作用降低或消失。
2.6 水凝胶的抑菌性能
为验证超分子水凝胶的抑菌性能,分别测试大肠杆菌和金黄色葡萄球菌在水凝胶中的存活能力,结果如图6所示。可见,与菌溶液对照相比,水凝胶对两种细菌的生长均具有良好的抑制作用,这主要是由于壳聚糖上含有大量的自由氨基,其质子化之后产生的阳离子具有良好的抑菌性能。相比较两种多糖,壳聚糖同样表现出良好的菌体抑制能力,而葡聚糖则会促进细菌生长。这主要是因为葡聚糖的化学结构中不含有氨基,而其被菌降解后产生的单糖还可能给细菌的生长提供一定的条件,这也是水凝胶的抑菌性略低于壳聚糖水溶液的原因。不过,由于葡聚糖与疏水性的布洛芬连接,其在形成水凝胶后容易受到亲水性壳聚糖分子的包裹,使得水凝胶表面仍然能够保持较好的抑菌性能。这一良好的抑菌性能也为水凝胶在创面修复的应用提供了条件。而葡聚糖分子同样可促进细胞生长,为伤口修复提供条件。
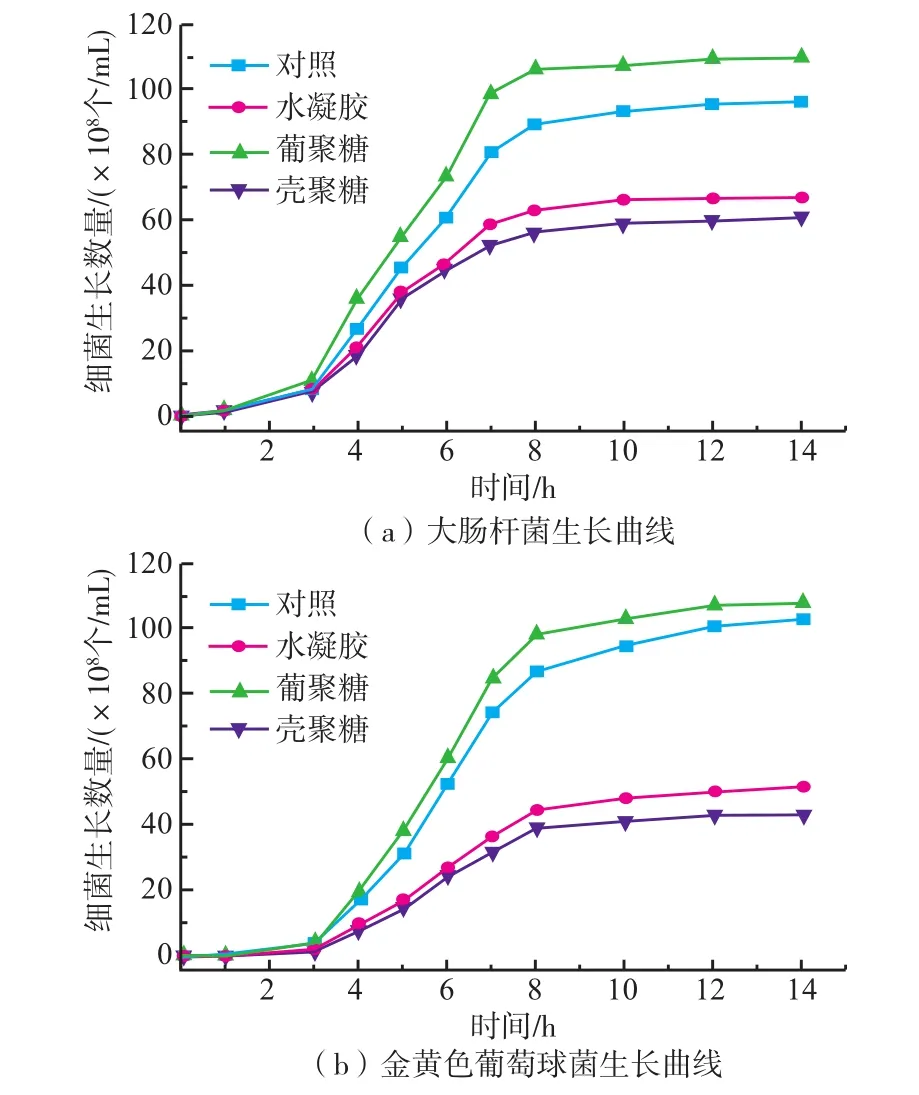
图6 两种细菌的生长曲线Fig.6Growth curves of Escherichia coli and Growth curves of Staphylococcus aureus
2.7 水凝胶的抗炎性能
水凝胶的抗炎性能以TNF-α为模型进行测定,结果如图7所示。可以看出,水凝胶内部因为含有抗炎药物布洛芬,可以明显抑制由LPS刺激产生的炎症因子TNF-α,说明水凝胶具有良好的抗炎作用。而壳聚糖虽能从一定程度上抑制炎症因子,但与水凝胶相比抑制率较低,葡聚糖则难以抑制炎症因子的产生。这说明所制备水凝胶材料不仅能够有效抑制细菌生长,进而避免产生炎症,还能抑制因巨噬细胞刺激活化而产生的炎症因子。说明该水凝胶材料对于炎症能从不同方面抑制。
3 结语
通过化学修饰成功制备得到了主体大分子CSCD和客体大分子Dex-Ibu,通过1H NMR验证了其结构,两种凝胶因子的取代度分别为9.8%和10.2%。之后,通过环糊精和布洛芬之间的主客体识别作用成功制备得到了超分子水凝胶,通过SEM观测其具有孔径大小均匀、分布规则的微观孔洞结构,孔径大小约20 μm。
流变学测试表明,两种凝胶因子混合会快速形成水凝胶,并且其储能模量(G′)大于损耗模量(G″),表现出凝胶的半固体性质。
包裹于水凝胶内部的布洛芬药物可在酯酶的促进下快速释放,而在不含有酯酶的环境中稳定包裹于凝胶内部,可起到稳定的抗炎作用。
同时,水凝胶还能够有效抑制大肠杆菌和金黄色葡萄球菌的生长,对于伤口的修复具有潜在的应用价值。
[1]Peppas N A,Hilt J Z,Khademhosseini A,et al.Hydrogels in biology and medicine:From molecular principles to bionanotechnology[J].Advanced Materials,2006,18(11):1345-1360.
[2]Slaughter B V,Khurshid S S,Fisher O Z,et al.Hydrogels in regenerative medicine[J].Advanced Materials,2009,21(32-33):3307-3329.
[3]Tibbitt M W,Anseth K S.Hydrogels as extracellular matrix mimics for 3D cell culture[J].Biotechnology and Bioenginnering,2009,103(4):655-663.
[4]缪明远,牛轶雯,陆树良.巨噬细胞活化与创面愈合[J].上海交通大学学报:医学版,2011,31(8):1189-1193.
MIAO Mingyuan,NIU Yiwen,LU Shuliang.Macrophage activation and wound healing[J].Journal of Shanghai Jiaotong University:Medical Science,2011,31(8):1189-1193.(in Chinese)
[5]郭敏,徐祥,黄宏.巨噬细胞在创面愈合中的作用研究进展[J].成都医学院学报,2010,5(3):223-227.
GUO Min,XU Xiang,HUANG Hong.To overview the contribution of macrophage during the wound healing[J].Journal of Chengdu Medical College,2010,5(3):223-227.(in Chinese)
[6]Sangeetha N M,Maitra U.Supramolecular gels:Functions and uses[J].Chemical Society Reviews,2005,34(10):821-836.
[7]Coviello T,Matricardi P,Marianecci C,et al.Polysaccharide hydrogels for modified release formulations[J].Journal of Controlled Release,2007,119(1):5-24.
[8]Wang J,Zhang J,Yu S,et al.Synthesis and self-assembly of a nanoscaled multiarm polymer terminated by beta-cyclodextrin[J]. ACS Macro Letters,2012,2(1):82-85.
[9]Skorik Y A,Pestov A V,Kodess M I,et al.Carboxyalkylation of chitosan in the gel state[J].Carbohydrate Polymers,2012,90(2):1176-1181.
[10]张汝钢,杨云生.OD450值与金黄色葡萄球菌活菌数目的相关性研究[J].军医进修学院学报,2011,32(4):343-344.
ZHANG Rugang,YANG Yunsheng.Correlation between OD450value and viable number of Staphylococcus aureus[J].Journal of Chinese PLA Postgraduate Medical School,2011,32(4):343-344.(in Chinese)
Construction of Supramolecular Hydrogel with Dual-Function Anti-Inflammation Activities:Morphology,Properties and Performance
XU Jia1,2,SHI Yu2,CHEN Jingxiao2,CHEN Jinghua*2
(1.Department of Pharmacy,Affiliated Hospital of Jiangnan University(Wuxi 4th People's Hospital),Wuxi 214062,China;2.School of Pharmaceutical Science,Jiangnan University,Wuxi 214122,China)
A supramolecular hydrogel with dual function of anti-inflammation activities was prepared from chitosan-β-cyclodextrin and dextranmodified with a nonsteroidal anti-inflammatory drug(ibuprofen)self-assembled via a guest-host inclusion interaction.The hydrogel with uniform porous structure was observed under scanning electron microscope.Ibuprofen could be quickly released with esterase added and stays stable without esterase.In addition,the hydrogel has great potential of clinical application in wound healing since it possesses efficient anti-microbial and antiinflammation activities.
hydrogel,anti-inflammation,antimicrobial,ibuprofen,chitosan
R 944.9
A
1673—1689(2015)06—0640—06
2014-06-30
教育部高等学校博士学科点专项科研基金项目(20110093110008)
徐佳(1981-),女,江苏无锡人,主管药师,主要从事药物制剂研究.E-mail:xujiajswx@126.com
