pH敏感型K5多糖-阿霉素前体药物的制备及其性能
2015-11-20刘文张苗陈荆晓陈敬华
刘文,张苗,陈荆晓,陈敬华
(江南大学药学院,江苏无锡 214122)
pH敏感型K5多糖-阿霉素前体药物的制备及其性能
刘文,张苗,陈荆晓,陈敬华*
(江南大学药学院,江苏无锡 214122)
利用肝素前体K5多糖,通过腙键(Hydrazone bond)连接抗肿瘤药物阿霉素(DOX),制备具有pH敏感性的K5-hydrazone-DOX(KHD)前体药物。对其载药量、形貌和体外药物释放等性质进行了研究,并通过HeLa细胞对其体外细胞毒性和细胞摄取进行了评价。结果表明,所制备的KHD前体药物中,DOX质量分数为18.0%。药物释放结果显示,KHD前体药物在pH 5.0条件下对DOX的释放率远高于pH 7.4条件下的释放率,具有明显的pH响应性。细胞实验表明,KHD前体药物可迅速被细胞摄取,并且具有肿瘤细胞抑制作用。本研究结果表明,KHD是一种有潜在应用价值的抗肿瘤前体药物。
K5多糖;前体药物;pH敏感;药物传递
抗肿瘤前体药物由聚合物和抗肿瘤化合物通过可断裂化学键连接获得,可以在分子水平提高化疗药物的溶解度、稳定性和半衰期[1-3]。制备前体药物的材料包括合成高分子材料和天然高分子材料。多糖作为一种可生物降解的天然高分子材料,具有良好的生物相容性、水溶性等优点,近年来在药物载体研制领域受到广泛关注[4-5]。
K5多糖作为肝素合成的前体化合物,具有生物相容性高、无免疫原性、在体内可被降解代谢等优点[6-9]。与肝素相比,未硫酸化的K5多糖不具有抗凝血活性,可避免产生出血等副作用[10]。K5多糖易被细胞摄取,用作药物载体可将药物迅速转运至细胞内[11-12]。带负电荷的K5多糖在血液中可避免因血浆蛋白质的吸附而被清除。K5多糖易被细胞摄取的特性以及其负电性,使其有望成为将药物有效输送至靶细胞内的新型药物载体。
本文作者以K5多糖为聚合物载体,通过pH敏感腙键与阿霉素连接,设计并制备了pH敏感的KHD前体药物,对该前体药物的理化性质、不同pH条件下的药物释放行为、体外抗肿瘤活性和细胞摄取等性能进行了研究。
1 材料与方法
1.1 材料
1.1.1 试剂盐酸阿霉素(DOX·HCl),购自浙江海正制药有限公司;己二酸二酰肼(ADH),购自阿拉丁试剂有限公司;二甲亚砜(DMSO),噻唑蓝(MTT),1-乙基-3-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC·HCl),购自上海生工生物工程公司;透析袋(截留分子量:3 500 Da),胰酶,购自Sigma-Aldrich公司;双抗(100 U/mL青霉素、100 μg/ mL链霉素),RPMI 1640细胞培养基,购自Gibco Invitrogen公司;胎牛血清(FBS),购自Hyclone公司;其它试剂均为国产分析纯。
1.1.2 仪器U-008OD紫外分光光度计,日本Hitachi公司制造;AVANCE III全数字化核磁共振谱仪,德国Bruker公司制造;JEM-2100型透射电镜,日本JEOL公司制造;Zetasizer Nano ZS纳米粒度与Zeta电位分析仪,英国Malvern公司制造;CO2细胞培养箱,美国Thermo公司制造;DMIL LED倒置荧光显微镜,德国Leica公司制造;MULTISKAN GO酶标仪,美国Thermo公司制造。
1.1.3 菌株与细胞株大肠杆菌K5菌株,购自ATCC;人类宫颈癌细胞(HeLa),购自中国科学院保藏中心(上海)。
1.2 KHD的合成
1.2.1 K5-ADH的合成K5多糖通过发酵大肠杆菌K5菌株,经提取纯化获得,相对分子质量约为10 000。称取200 mg K5多糖,溶于20 mL去离子水,加入220 mg己二酸二酰肼(ADH),搅拌溶解,用0.1 mol/L HCl溶液调pH至4.5左右,加入24 mg EDC·HCl,室温下搅拌反应4 h。反应结束用0.1 mol/L NaOH溶液调pH至7.0,去离子水充分透析,冻干得K5-ADH。
1.2.2 KHD的合成及表征将DOX·HCl溶于DMSO后加入无水三乙胺脱盐酸,得DOX。称取150 mg K5-ADH溶于50 mL甲酰胺,加入DOX溶液,避光条件下室温搅拌反应48 h,去离子水透析,冻干得KHD。产物KHD通过核磁共振氢谱(1H NMR)确认其结构,根据阿霉素标准曲线测定并计算KHD中DOX的含量。DOX摩尔分数

1.3 KHD纳米粒子的制备及表征
制备KHD水溶液(1 mg/mL),静置1 h后滴在铜网上,自然干燥后,用磷钨酸负染,再自然干燥。将样品置于透射电镜下观察。
将KHD溶于超纯水(1 mg/mL),于25℃条件下测定KHD纳米粒子的粒径分布和Zeta电位。
1.4 体外药物释放
采用透析法测定DOX在体外的释放情况,称量一定量KHD用PBS(pH 7.4)溶解,分别置于截留相对分子质量为3 500的透析袋中,之后放入分别装有10 mL pH 5.0、pH 7.4 PBS的棕色瓶中。避光放入37℃摇床中,转速100 r/min,并于设定时间点取样。所取样品在480 nm处测其紫外吸收,根据阿霉素标准曲线计算各个时间点的累积药物释放率。
1.5 体外细胞毒性
细胞培养:细胞培养条件采用含体积分数10% FBS、质量分数1%双抗的RPMI 1640细胞培养基,在37℃、质量分数5%CO2及饱和湿度的条件下连续培养及传代。
将细胞接种至96孔培养板,细胞密度7 000个/孔,在37℃、质量分数5%CO2、饱和湿度的培养箱中培养24 h。加药组加入各受试药物(K5多糖、阿霉素、KHD分别以不同浓度溶于含体积分数10%FBS的细胞培养基中),空白组只加含体积分数10%FBS的细胞培养基。分别继续培养24 h和48 h后每孔加入0.5 mg/mL MTT溶液100 μL,37℃培养4 h,吸出上清液,用100 μL DMSO溶解沉淀物,使用酶标仪在570 nm处检测OD值。细胞存活率
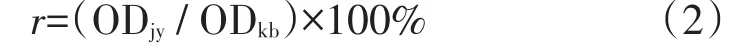
1.6 体外细胞摄取
将HeLa细胞以25 000个/孔的密度接种于24孔板中,培养24 h,吸去培养基,分别加入500 μL游离DOX和KHD培养基溶液(其中DOX的浓度为5 μmol/L),培养1 h后,于倒置荧光显微镜下观察药物的细胞内摄化。
2 结果与分析
2.1 KHD前体药物的合成
K5多糖糖链上含大量羧基,在EDC的催化下与ADH一端的氨基发生反应,生成K5-ADH中间体,K5-ADH中ADH另一端联氨基与阿霉素的13位羰基在常温下可直接发生反应,形成pH敏感的腙键,得到KHD前体药物(图1)。
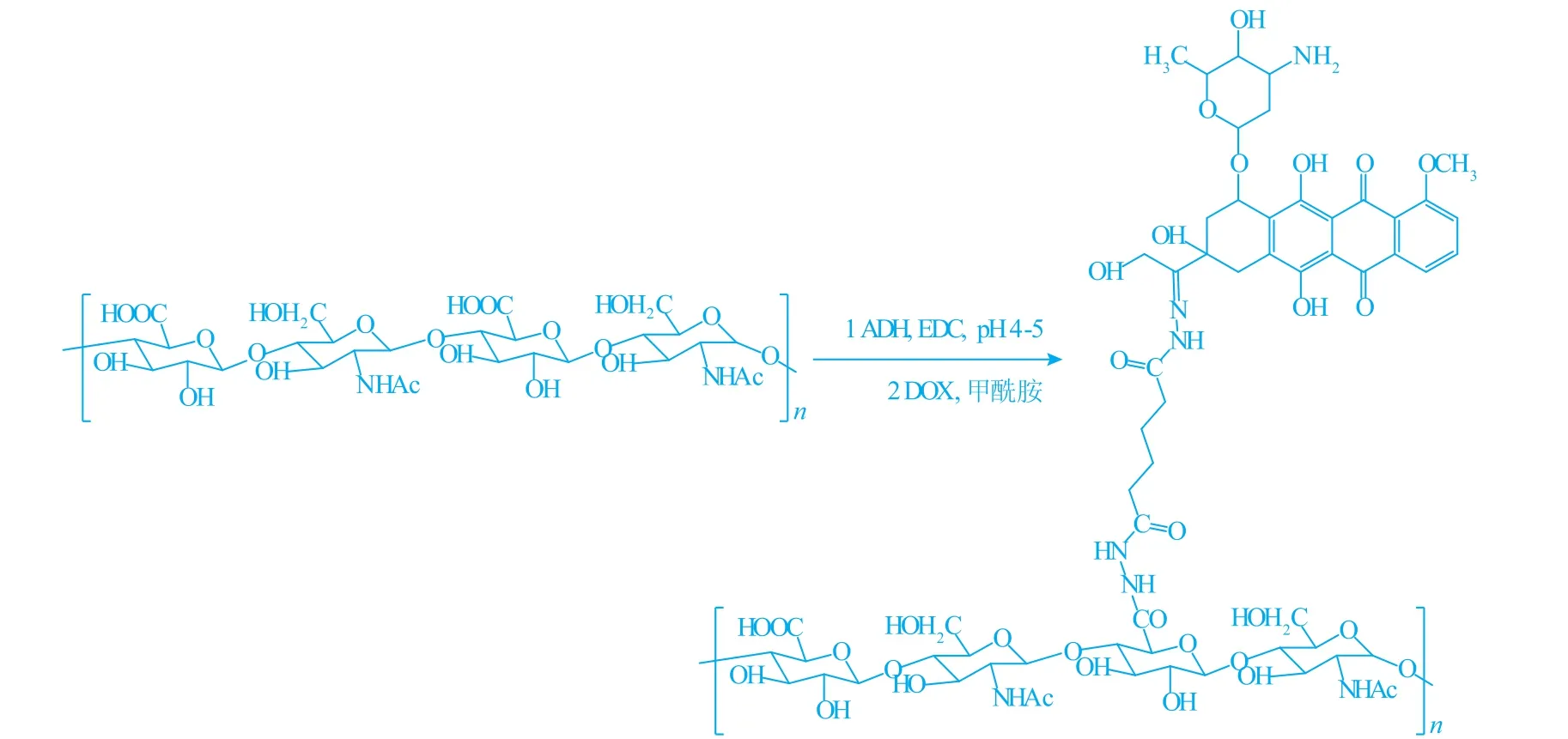
图1 KHD的合成路线Fig.1Synthetic route of KHD
如图2所示,KHD前体药物的核磁氢谱图与K5多糖相比,K5多糖的特征峰仍存在,出现在δ 1.5和δ 2.2处的共振峰为ADH中质子氢的峰,在δ 8处的共振峰为DOX蒽环上质子氢的峰,表明已成功制备了KH
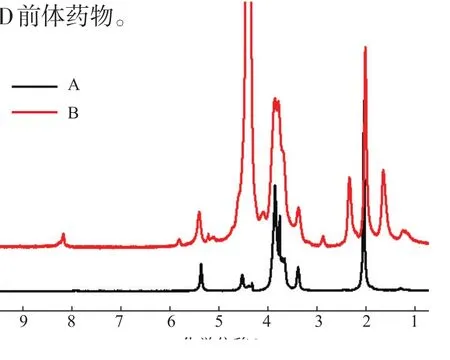
图2 K5多糖(A)与KHD(B)核磁氢谱Fig.21H NMR of K5 polysaccharide(A)and KHD(B)
利用阿霉素在480 nm处较强紫外吸收,通过阿霉素在480 nm处的标准曲线计算得KHD中DOX摩尔分数为18.0%。
2.2 KHD的形貌
由于K5多糖和ADH具有良好的水溶性,而连接至K5多糖的DOX分子结构中的蒽环在pH 7.4条件下具有疏水性,因此KHD表现出两亲性,在水溶液中能够通过疏水作用力自组装形成纳米粒子。透射电镜结果表明,形成的纳米粒子为边缘模糊的球状纳米粒子,并且具有良好的分散性、尺度均一,平均粒径约为36 nm,如图3(a)所示。
纳米粒子的粒径大小影响其微粒的分散稳定性以及在体内的分布,KHD纳米粒子的粒径通过动态光散射(DLS)进行测定,结果如图3(b)所示。
可以看出,KHD在水溶液中组装得到的纳米粒子的平均粒径为64 nm,PDI=0.178,表明其具有较窄的粒径分布。粒径仪所测纳米粒子在水溶液中的粒径大于透射电镜测得的粒径,是因为透射电镜所测纳米粒子为干态。KHD纳米粒子Zeta电位为(-20±1.5)mV,这是因为纳米粒子表面为亲水性的K5多糖,而其分子中含有大量羧基,导致纳米粒子表面为负电性质。由Zeta电位值可知,KHD纳米粒子具有较好的稳定性,不易聚集,这一结果也与TEM观测结果一致。
图3 KHD纳米粒子的透射电镜图及其粒径分布Fig.3TEM image and size distribution of KHD nanoparticles
2.3 体外药物释放
KHD的体外药物释放实验在不同pH值条件下进行。如图4所示,KHD纳米粒子在不同pH条件下DOX的释放有明显区别,50 h后,pH 7.4时的累积释放率约30%;pH 5.0时,DOX的累积释放率达65%。在pH 5.0酸性条件下,DOX具有较快的释放速率。这是因为KHD分子中的腙键在酸性条件下会断裂,释放出自由的DOX分子。DOX在低pH条件下的溶解性增强,有利于其从透析袋中游离出来。pH依赖的DOX释放有利于增强靶向抗肿瘤的效果,在生理pH条件下的缓慢释放确保了KHD纳米粒子在血液循环系统中的完整性,降低了对正常组织的毒性;在低pH的肿瘤组织和内涵体/溶酶体中可快速释放,发挥其抗肿瘤活性。
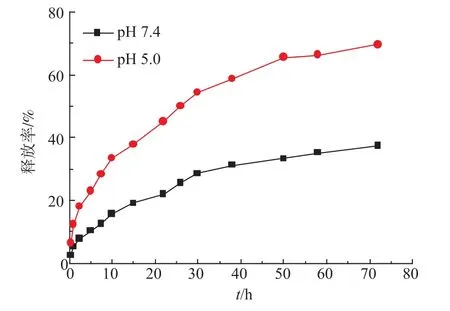
图4 37℃时KHD在pH 7.4和pH 5.0环境下的体外药物释放(n=3)Fig.4In vitro drug release from KHD nanoparticles at 37℃under pH 7.4 and pH 5.0(n=3)
2.4 KHD的体外细胞毒性
如图5所示,K5多糖与HeLa细胞共孵育48 h后未表现出明显毒性,细胞存活率均大于85%,即使在400 mg/L较高质量浓度下细胞仍可保持较高的存活率。这一结果说明K5多糖具有良好的生物相容性,是安全的药物载体。
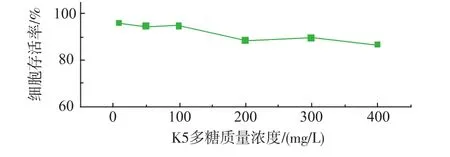
图5 K5多糖对HeLa细胞的体外细胞毒性(n=4)Fig.5In vitro cytotoxicity of K5 polysaccharides against HeLa cells with increasing concentrations(n=4)
采用MTT法检测KHD纳米粒子的细胞毒性,结果如图6所示。可以看出,共培养24 h后,KHD纳米粒子对HeLa细胞的半数抑制质量浓度(IC50)为2.2 mg/L,游离阿霉素对细胞的抑制作用较弱。共培养48 h后,KHD纳米粒子对HeLa细胞的IC50为1.3 mg/L,游离阿霉素对HeLa细胞的IC50为2.7 mg/ L,KHD纳米粒子对细胞增殖的抑制作用仍明显高于阿霉素。
由图5和图6可知,K5多糖对细胞增殖无抑制作用,KHD纳米粒子的细胞毒性是由其所载的DOX决定的。KHD纳米粒子在短时间内的高细胞毒性表明,有较多的DOX在短时间内被运载至细胞内。以K5多糖为载体的KHD前体药物可在较短时间内明显抑制细胞增殖,此结果与作者在文献[12]中所报道的结论相吻合。
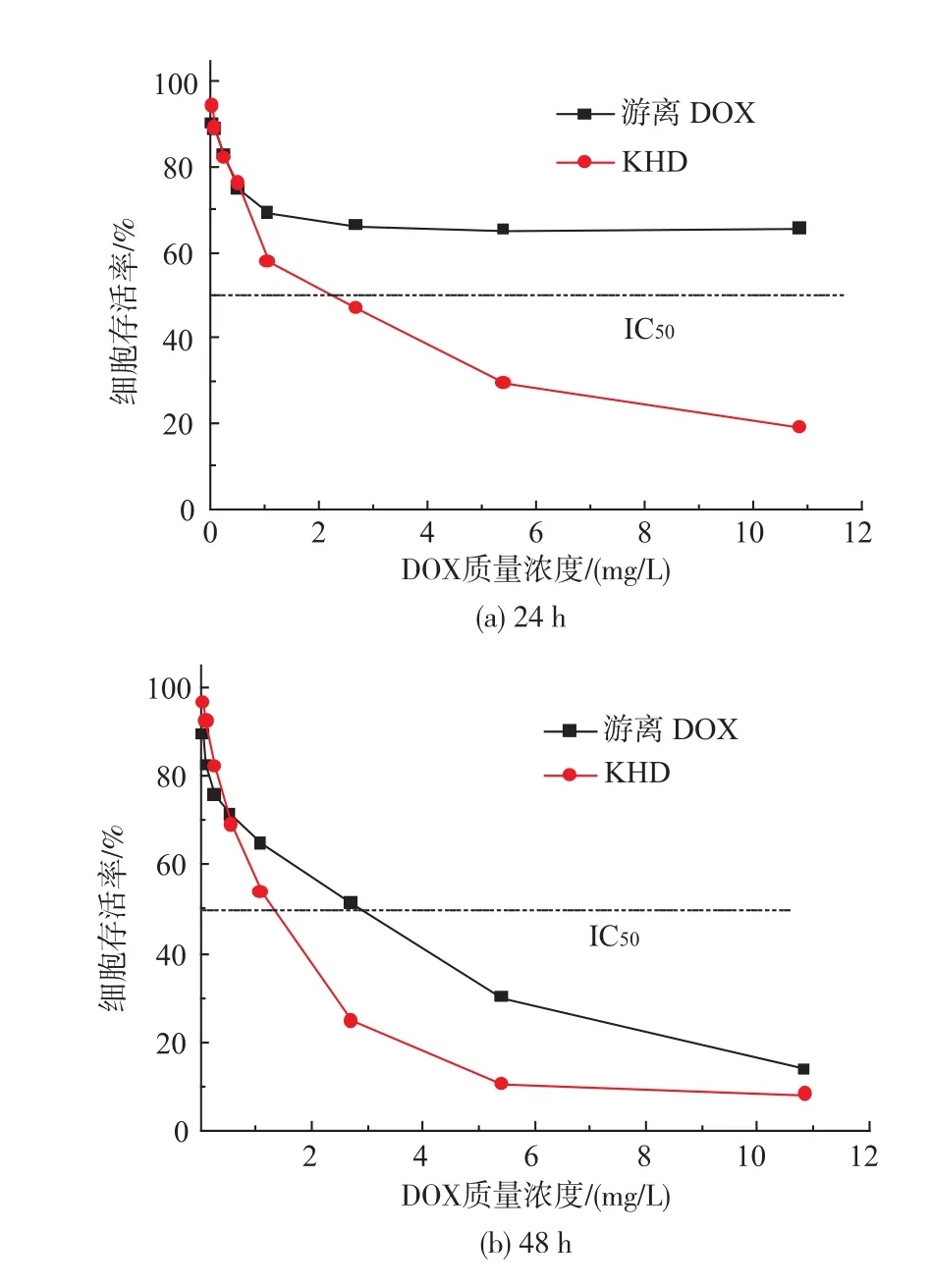
图6 游离阿霉素与KHD纳米粒子对HeLa细胞24 h和48 h的体外细胞毒性(n=4)Fig.6In vitro cytotoxicity of free DOX and KHD nanoparticles against HeLa cells with increasing DOX concentrations after 24 h and 48 h(n=4)
2.5 KHD体外细胞摄取
如图7(a)所示,KHD纳米粒子与细胞在37℃条件下孵育1 h后,可以看到在细胞内有明显的红色荧光,且其荧光强度明显高于相同含量的游离阿霉素对照组的荧光强度(图7(b)),说明KHD纳米粒子能快速被细胞摄取并在细胞内累积。KHD纳米粒子快速有效地将所载阿霉素运载至细胞内,使所载药物迅速达到有效浓度,抑制细胞增殖,与KHD纳米粒子可在短时间内达到较高的细胞毒性结果相吻合。
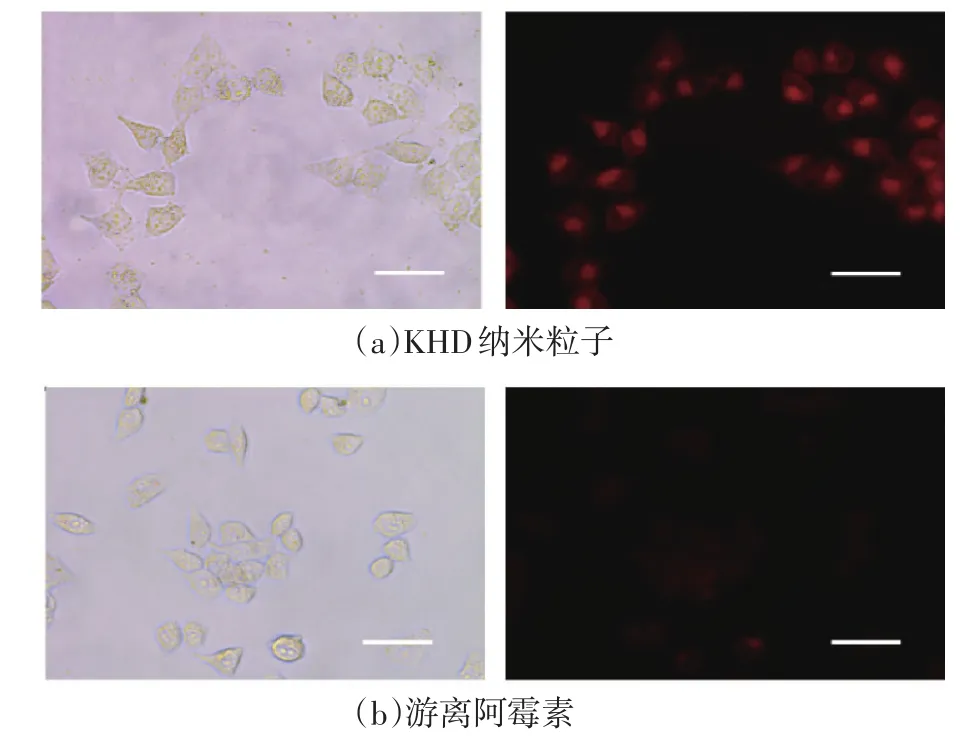
图7 HeLa细胞对游离阿霉素和KHD纳米粒子的摄取(比例尺:50 μm)Fig.7Cellular uptake of free DOX and KHD nanoparticles(Scale bar:50 μm)
3 结语
本课题研究中采用易被细胞摄取的K5多糖为载体,成功制备了pH敏感的KHD前体药物,在水溶液中可自组装形成形态大小均一且分散性良好的纳米粒子。KHD纳米粒子在低pH条件下DOX的释放率明显高于pH 7.4条件下DOX的释放率,表现出pH敏感特性。细胞摄取结果表明,KHD纳米粒子可快速有效地被细胞摄取,从而表现出较强的细胞毒性,为抗肿瘤前体药物的研究提供了全新的思路。
[1]Stella V J,Nti-Addae K W.Prodrug strategies to overcome poor water solubility[J].Advanced Drug Delivery Reviews,2007,59(7):677-694.
[2]Rautio J,Kumpulainen H,Heimbach T,et al.Prodrugs:Design and clinical applications[J].Nature Reviews Drug Discovery,2008,7(3):255-270.
[3]Duncan R.The dawning era of polymer therapeutics[J].Nature Reviews Drug Discovery,2003,2(5):347-360.
[4]Mizrahy S,Peer D.Polysaccharides as building blocks for nanotherapeutics[J].Chemical Society Reviews,2012,41(7):2623-2640.
[5]Raemdonck K,Martens T F,Braeckmans K,et al.Polysaccharide-based nucleic acid nanoformulations[J].Advanced Drug Delivery Reviews,2013,65(9):1123-1147.
[6]Vann W F,Schmidt M A,Jann B,et al.The structure of the capsular polysaccharide(K5 antigen)of urinary-tract-infective Escherichia coli O10∶K5∶H4 A polymer similar to desulfo-heparin[J].European Journal of Biochemistry,1981,116(2):359-364.
[7]Ly M,Wang Z,Laremore T N,et al.Analysis of E.coli K5 capsular polysaccharide heparosan[J].Analytical and Bioanalytical Chemistry,2011,399(2):737-745.
[8]De Angelis P L.Microbial glycosaminoglycan glycosyltransferases[J].Glycobiology,2002,12(1):9R-16R.
[9]DeAngelis P L.HEPtune:A process of conjugating a naturally occurring sugar molecule,heparosan,to a drug for enhanced drug delivery[J].Drug Development&Delivery,2013,13:34-38.
[10]Li P,Sheng J,Liu Y,et al.Heparosan-derived heparan sulfate/heparin-like compounds:One kind of potential therapeutic agents[J].Medicinal Research Reviews,2013,33(3):665-692.
[11]Raman K,Mencio C,Desai U R,et al.Sulfation patterns determine cellular internalization of heparin-like polysaccharides[J]. Molecular Pharmaceutics,2013,10(4):1442-1449.
[12]Chen J X,Zhang M,Liu W,et al.Construction of serum resistant micelles based on heparosan for targeted cancer therapy[J]. Carbohydrate Polymers,2014,110:135-141.
Preparation and Property Study of the pH-Sensitive K5 Polysaccharide-Doxorubicin Prodrug
LIU Wen,ZHANG Miao,CHEN Jingxiao,CHEN Jinghua*
(School of Pharmaceutical Science,Jiangnan University,Wuxi 214122,China)
In this study,K5 polysaccharide(heparosan)was conjugated with anticancer drug DOX via hydrazone bond to obtain pH-sensitive K5-hydrazone-DOX(KHD)prodrug.The drug loaded capacity,morphology,and in vitro drug release were investigated.Its in vitro cytotoxicity and cellular uptake against HeLa cells were also evaluated.The results showed that the DOX content of KHD is 18.0%.The release rate of DOX at pH 5.0 was much faster than that at pH 7.4,revealing a pH-triggered release manner.The KHD prodrug could achieve intracellular delivery and showed effective cytotoxicity in vitro.This study indicates that the KHD prodrug may be a potential candidate for cancer therapy.
K5 polysaccharide,prodrug,pH-sensitive,drug delivery
R 944.9
A
1673—1689(2015)06—0634—06
2014-05-06
教育部高等学校博士学科点专项科研基金项目(20110093110008);江苏省自然科学基金项目(BK2012557);武汉大学生物医用高分子材料教育部重点实验室开放基金项目(20110401)。
*通信作者:陈敬华(1971—),男,湖北黄石人,理学博士,教授,博士研究生导师,主要从事生物大分子和生物功能材料的研究。E-mail:jhchenwhut@126.com
