骆驼瘤胃乳酸菌对吡啶的降解研究
2015-11-20郑李娟安登第费莹莹唐琴曾献春
郑李娟,安登第,费莹莹,唐琴,曾献春
(新疆师范大学生命科学学院/新疆特殊环境物种保护与调控生物学实验室,新疆乌鲁木齐,830054)
骆驼瘤胃乳酸菌对吡啶的降解研究
郑李娟,安登第,费莹莹,唐琴,曾献春*
(新疆师范大学生命科学学院/新疆特殊环境物种保护与调控生物学实验室,新疆乌鲁木齐,830054)
将来源于骆驼瘤胃中的8株乳酸菌接种到以吡啶(300 μg/mL)为唯一碳源、氮源的无机盐培养基中进行培养,通过紫外分光光度计定期检测乳酸菌的的吸光度值(600 nm),了解其生长情况;利用气相色谱-质谱联用仪(GC-MS)动态检测的乳酸菌降解吡啶的残留量,确定骆驼瘤胃中的乳酸菌对吡啶的降解能力。实验结果显示:8株乳酸菌对吡啶都具有较强的降解能力,其中2株乳酸菌(GU366027、GU366021)培养84 h后,可以将吡啶完全降解;3株菌(GU366034、GU366019、GU366030)96 h后可以100%利用吡啶;3株(GU366037、GU366038、GU366028)108h能够将培养基中的吡啶完全转化。研究提示骆驼瘤胃中的乳酸菌具有高效降解吡啶的作用。
骆驼瘤胃;乳酸菌;吡啶;降解
吡啶是一个氮原子取代了苯上的一个碳原子而形成的杂环化合物[1],又称氮苯,无色或微黄色液体,结构稳定,可溶于水,有毒性,对眼及上呼吸道有刺激作用,能麻醉中枢神经系统,吡啶还具有潜在的致癌作用。由于其高水溶性导致它在污染环境中非常容易迁移,扩大污染范围,对人类健康带来危害。因此在工业生产中产生的吡啶需要第一时间进行处理,避免污染环境,危害生物健康[2-4]。目前对吡啶降解最有效的方法是微生物降解,但降解微生物大都来源于被污染的土壤和污水中,这些微生物本身具有一定的不安全性,在污染治理中存在潜在的风险。乳酸菌是指一群通过发酵糖类,产生大量乳酸的无芽孢的革兰氏阳性细菌的总称[5]。乳酸菌代谢产物中除了乳酸等有机酸外,还产生少量细菌素、过氧化氢、双乙酞等抑菌性物质,对致病菌具有较强的抑制作用[6],其中相当多的乳酸菌对人、畜的健康起着有益的作用。
骆驼(Camelus bactrianus)是新疆沙漠地带特有的动物种群,常年以食用骆驼刺、假木贼、狼毒等含有毒物质的植物为生,而自身仍然能够健康生长[7-9]。从骆驼瘤胃中分离纯化获得到8株乳酸菌,经生理生化和分子生物学鉴定,其主要归属为:乳酸杆菌属(Lactobacillus sp.)。鉴于骆驼可以降解和消化有害物质的特殊功能主要依赖于瘤胃中的乳酸菌,选择有机污染物吡啶为唯一碳源、氮源的无机盐培养基培养来源于骆驼瘤胃的8株乳酸菌,通过紫外分光光度计检测乳酸菌的的吸光度值和气相色谱-质谱联用仪(GC-MS)检测8株乳酸菌降解吡啶的残留量,绘制降解曲线和生长曲线。初步探讨其降解效率,为进一步将乳酸菌应用于有机污染物的处理提供研究依据[10-12]。
1 材料与方法
1.1 材料
1.1.1 菌种来源新疆师范大学微生物实验室提供8株乳酸菌,登录号为GU366019,GU366021,GU366027,GU366028,GU366030,GU366034,GU366037,GU366038。
1.1.2 培养基与试剂
1)无机盐培养基磷酸氢二钠4.26 g,磷酸二氢钾2.65 g,二水氯化钙0.02 g,七水硫酸镁0.2 g,七水硫酸锰0.002 g,七水硫酸亚铁0.01 g,蒸馏水1 000 mL,pH7.0,121℃灭菌20 min。
2)固体分离培养基上述无机盐培养基加琼脂粉,15~20 g/L。
3)牛肉膏蛋白胨培养基牛肉膏3 g,蛋白胨10 g,琼脂15~20 g,蒸馏水1 000 mL,pH 7.0~7.2,121℃灭菌20 min。
4)LB液体培养基蛋白胨10 g,酵母浸出粉5 g,氯化钠10g,蒸馏水1000mL,pH7.0,121℃灭菌20min。
5)试剂吡啶标准品(Aladdin,色谱纯);二氯甲烷(色谱纯)。
1.1.3 仪器设备紫外可见分光光度计:UV-2800H,尤尼柯仪器有限公司产品;气相色谱-质谱联用仪:Agilent 7890A-5975C,Agilent公司产品。
1.1.4 降解吡啶微生物降解率检测将来源于新疆师范大学微生物重点实验室的8株乳酸菌接种到含以300 μg/mL吡啶为唯一碳源、氮源的无机盐培养基中培养7 d,选用加吡啶不接种菌株的培养基作为空白对照。每4 h检测菌的浓度,了解菌株在以吡啶为唯一碳源、氮源的无机盐培养基中的生长情况,并绘制生长曲线[13];利用GC-MS每12 h检测培养基中吡啶的残留量,监测降解菌株对吡啶的降解情况,绘制降解曲线[14-15]。
1.1.5 吡啶的萃取取5 mL菌液,加入5 mL二氯甲烷[16],振荡摇匀后,用超声波超声混匀,静置过夜,收集下层二氯甲烷萃取液。
1.1.6 色谱条件色谱柱:HP-5MS(30 m×0.25 μm× 0.25 mm);载气:氦气(99.999%);流量:1.0 mL/min;进样口温度:250℃;进样量:1 μL;进样方式:分流进样;分流比:50:1;程序升温:初始温度40℃,保持0.5 min,再以20℃/min的速度升温到110℃。后运行240℃,保持1 min。
1.1.7 质谱条件接口温度:280℃,离子源温度:230℃,四级杆:150℃,电子轰击能量:70 eV;溶剂延迟:2.1 min;扫描方式:全扫描模式,扫描范围为20~550。质谱库:NIST2011。
1.1.8 标准曲线的制定配置吡啶质量浓度为400 μg/mL的标准储备液,用二氯甲烷将标准储配液稀释成浓度为25、50、100、200、400 μg/mL5个不同质量浓度,分别进样后,以定量离子(m/z,79.1)的峰面积为纵坐标,其质量浓度为横坐标,求出标准曲线方程,以此计算被测样品中吡啶的残留量。
1.2 实验方法
已经得到的菌种活化(即将斜面的休眠菌种使用涂布法接种至牛肉膏培养基平板进行活化)。将活化的菌体接入100 mL的LB培养基(加入200 μg/mL吡啶,目的是为了防止杂菌生长)进行菌体繁殖,摇床37℃,180 r/min条件下培养24 h。将培养的菌液在4 000 r/min,5 min条件下离心,收集菌体,用不含吡啶的无机盐培养基洗涤3次,弃上清,收集菌体,加入无菌无机盐培养基制成乳酸菌的的吸光度值(600 nm)为2的菌悬液。将菌悬液以体积分数5%的接种量接种到以吡啶为唯一碳源氮源的无机盐培养基中(摇床37℃,180 r/min条件下培养),每个菌株做3个重复。每隔4 h取样测乳酸菌的的吸光度值(600 nm)及吡啶残留量。萃取参照1.1.5进行萃取,将萃取的菌液取1 μL二氯甲烷萃取液注入GC-MS,测定吡啶残留量,了解菌株对吡啶的降解能力。
2 结果与分析
2.1 萃取溶剂选择
由于吡啶是添加在无机盐培养基中,所以在选萃取试剂时首先要考虑①萃取溶剂不能溶于水,②由于有机试剂易挥发,且在超声萃取后需静置过夜,所以选取的有机试剂密度必须大于水,以保证实验准确性。二氯甲烷密度大,且不溶于水,萃取过程简便快速,一次萃取就可以满足回收率的要求;吡啶在二氯甲烷中响应值较大,灵敏度较高[16]。而其他的有机试剂(如甲醇、乙酸乙酯、丙酮、正己烷等)不满足上述条件,且在气象色谱图中与吡啶的目标峰不易分开,所以选择二氯甲烷作为萃取试剂。
2.2 待测物吡啶的定性
色谱法:采用保留时间对照法,比较标准样品和待测样品色谱图中的相对保留时间。吡啶的出峰时间为:2.629 min,结果见图1。

图1 吡啶标准样品色谱Fig.1Chromatograms of pyridine standard sample
质谱法:采用全扫描方式,排除有杂峰干扰的可能性,在质量范围为20~550之间进行定性,吡啶的定型离子(m/z)为79.1、52.1、26.1,结果见图2。
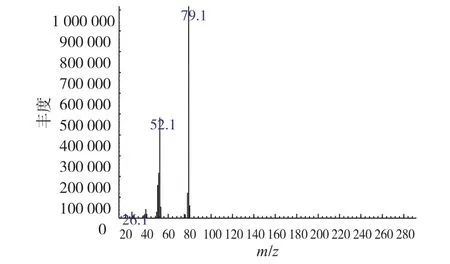
图2 吡啶标准样品质谱图Fig.2Mass spectra of pyridine standard sample
2.3 标准曲线制定
参照1.1.8的方法制定标准曲线,以面积为纵轴,质量浓度为横轴,求出标准曲线方程,曲线方程:y=36 293x+13 954,结果见图3。
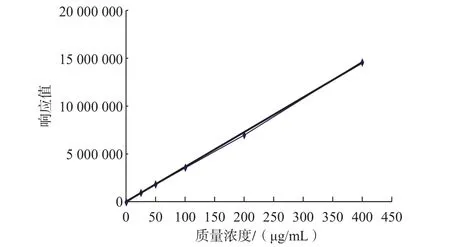
图3 吡啶的标准曲线Fig.3Standard curve of pyridine
2.4 测定方法回收率
采用标样加入法测定方法的回收率,即将300 μg/mL吡啶标品加入到每个菌株的对照(只添加300 μg/mL吡啶的无机盐培养基)中,用1.1.5的方法进行萃取,将吡啶标品测定量与吡啶标品加入量的比值作为回收率,结果见表1回收率在76.63%~86.66%。

表1 吡啶的回收率Table 1Recovery rate of pyridine
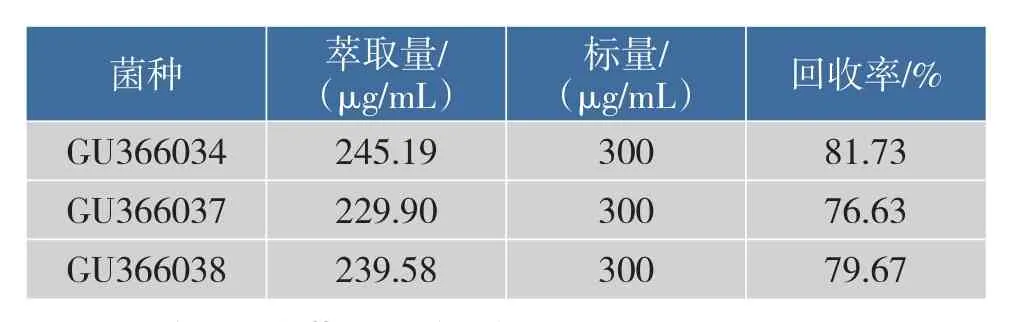
菌种萃取量/(μg/mL)标量/(μg/mL)回收率/%GU366034 GU366037 GU366038 245.19 229.90 239.58 300 300 300 81.73 76.63 79.67
2.5 降解吡啶菌株降解能力
得到菌株的降解率,通过GC-MS测定吡啶的残留量,并通过标准曲线计算吡啶的降解率(每隔12 h测定)及生长曲线(每4 h进行的测定),见图4~11。
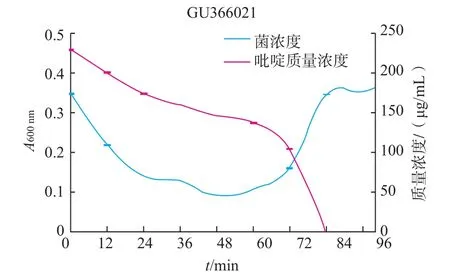
图4 GU366021的生长曲线和吡啶降解率曲线Fig.4Growth curve and pyridine degradation curve of strain GU366021
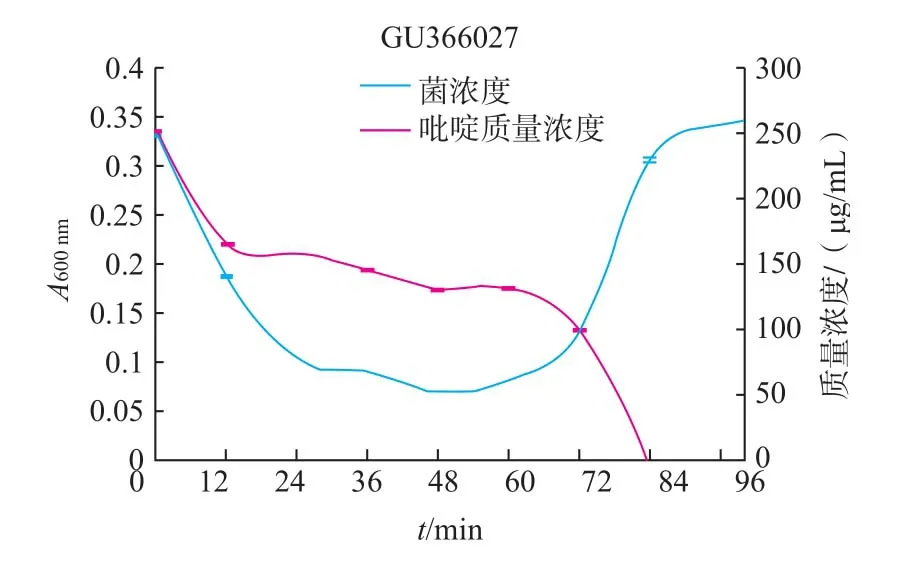
图5 GU366027的生长曲线和吡啶降解率曲线Fig.5Growth curve and pyridine degradation curve of strain GU366027
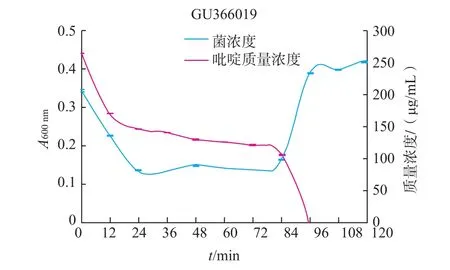
图6 GU366019的生长曲线和吡啶降解率曲线Fig.6Growth curve and pyridine degradation curve of strain GU366019
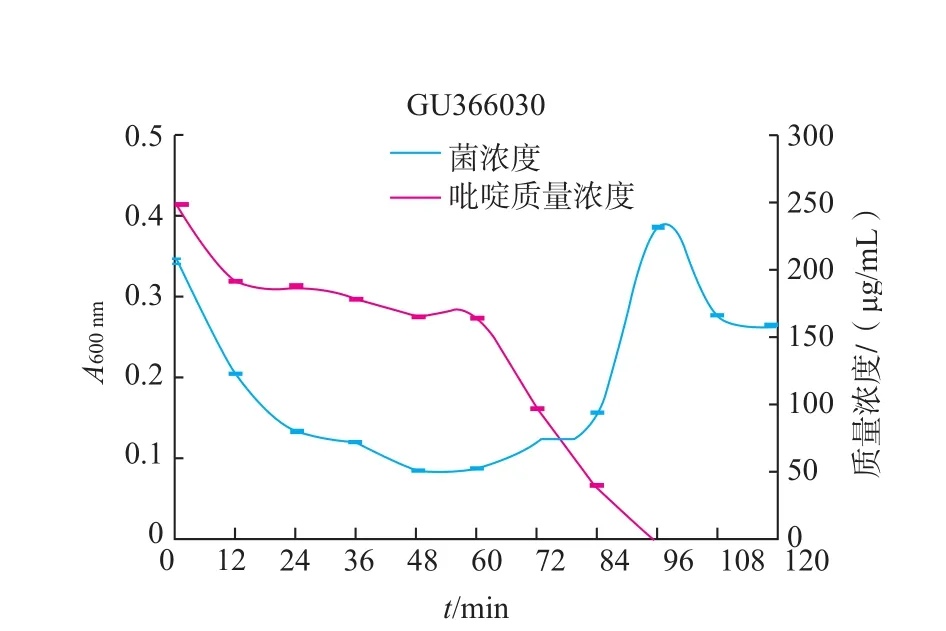
图7 GU366030的生长曲线和吡啶降解率曲线Fig.7Growth curve and pyridine degradation curve of strain GU366030

图8 GU366034的生长曲线和吡啶降解率曲线Fig.8Growth curve and pyridine degradation curve of strain GU366034

图9 GU366028的生长曲线和吡啶降解率曲线Fig.9Growth curve and pyridine degradation curve of strain GU366028
由图4~11可知,8株乳酸菌降解菌株在添加吡啶(300 μg/mL)的无机盐培养基中生长较缓慢,迟缓期72 h左右。当菌株生长到达对数期时,8株菌株对吡啶的利用速度加快,显示较强的降解能力,其中2株(GU366027、GU366021)在84 h,3株(GU366034,GU366019、GU366030)在96 h,3株(GU366037,GU366038、GU366028)在108 h将吡啶完全降解,培养基中吡啶的残留量为零,降解率为100%。
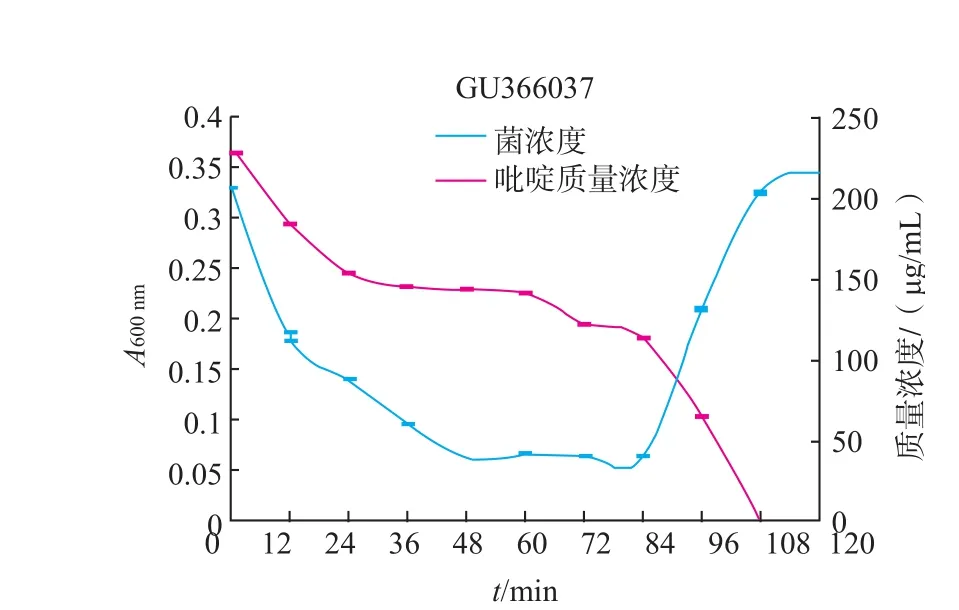
图10 GU366037的生长曲线和吡啶降解率曲线Fig.10Growth curve and pyridine degradation curve of strain GU366037

图11 GU366038的生长曲线和吡啶降解率曲线Fig.11Growth curve and pyridine degradation curve of strain GU366038
实验中乳酸菌最初在无机盐培养基中生长比较缓慢,迟缓期较长,在这段时间里对吡啶的降解能力也不高,可能是吡啶作为有害物质,在菌株的接种初期对菌株产生了毒害作用,部分菌种死亡。进入迟缓期的菌株的调节机制为应对恶劣环境做出改变,利用吡啶作为碳、氮源供给自身生长,在经过较长一段迟缓期后,能够较好应用吡啶作为碳、氮源供给生长,当菌株生长到达对数期时,8株菌株对吡啶的利用速度加快,显示较强的降解能力。
3 讨论
目前吡啶降解菌主要来源于被污染的环境,而对动物消化道微生物对吡啶的降解研究较少。Lynn Vanhaecke等对来自6位正常成人肠道中的微生物以吡啶为碳源进行研究,发现吡啶可以被人体肠道中微生物降解和转化,不同肠道样品72 h降解率为47~95%,使吡啶失去对机体的致突变作用[18],该研究提示动物消化道微生物在机体内对吡啶转化和降解起着重要作用。目前对乳酸菌降解有毒有害物质的研究主要集中在亚硝酸盐、黄曲霉毒素和胆固醇降解等方面[19-20]。
作者研究的乳酸菌菌株来源于骆驼瘤胃,有别于乳制品发酵、蔬菜发酵和自然环境中的乳酸菌,具有特殊的生理功能。一方面在骆驼体内发挥着降解骆驼常食用植物的毒素,保障食用骆驼蓬、假木贼、狼毒等有毒植物而不会中毒[11];另一方面在骆驼瘤胃特殊环境中的长期适应,具有了降解有害物质的能力,并可以尝试应用于其它有害物质的降解研究。作者对骆驼瘤胃中的8株乳酸菌降解吡啶的能力开展研究,证实骆驼瘤胃乳酸菌可以高效降解吡啶。希望骆驼瘤胃乳酸菌可以有效应用于环境污染物的降解和处理,为环境污染的生物处理提供新的微生物资源,扩大乳酸菌的应用范围;也为动物源乳酸菌降解有害物质的研究提供研究方法和思路。后期研究将进一步探讨降解乳酸菌的最佳降解条件和降解机制,希望能够将来自骆驼消化道降解吡啶的乳酸菌有效地应用于环境污染的治理。
[1]杨威.气相色谱法测定地表水中吡啶的方法研究与探讨[J].绿色科技,2014,1:170-171.
YANG Wei.Gas chromatography method for the determination of surface water pyridine Research and Discussion[J].Green Technology,2014,1:170-171.(in Chinese)
[2]孙纪全,徐莲,汤岳琴等.红球菌Chr-9降解吡啶和苯酚的特性[J].应用与环境生物学报,2012,18(4):647-650.
SUN Jiquan,XU Lian,TANG Yueqin,et al.Degradation Characteristics of Pyridine and Phenol by Rhodococcus sp.Chr-9[J]. Chinese Journal of Applied and Environmental Biology,2012,18(4):647-650.(in Chinese)
[3]易霞,钟江.两株假单胞菌对吡啶和喹啉的生物降解[J].微生物学报,2011,51(8):1087-1097.
YI Xia,ZHONG Jiang.Biodegradation of pyridine and quinoline by two Pseudomonas strains[J].Acta Microbiologica Sinica,2011,51(8):1087-1097.(in Chinese)
[4]Qiao Lin,Wang Jian-Long.Microbial degradation of pyridine by Paracoccus sp.isolated from contaminated soil.[J].Journal of Hazardous Materials,2009,176(1):220-225.
[5]于晨龙,张七斤,陈光明等.不同来源乳酸菌的分离与鉴定[J].中国畜牧兽医,2014,41(2):208-212.
YU Chen,ZHANG Qijin,CHEN Guangming.et al.Isolation and Identification of Lactobacillus from Different Origins[J].China Animal Husbandry&Veterinary Medicine,2014,41(2):208-212.(in Chinese)
[6]陈静,黄德国,杨阳.乳酸菌对污水的降解作用研究[J].城市建设理论研究,2012,24.
CHEN Jing,HUANG Deguo,YANG Yang.Lactobacillus degradation of sewage in study[J].Urban Construction Theory Research,2012,24.(in Chinese)
[7]Carlson JR,Breeze RG.Ruminal metabolism of plant toxins with emphasis on indolic compounds[J].Animal Science Journal,1984,58(4):1040-1049.
[8]Jeannette T,Hovermale and A.Metabolism of pyrrolizidine alkaloids by Peptostreptococcus heliotrinreducens and a mixed culture derived from ovine ruminal fluid.[J].Biophysical Chemistry,2002,101:387-399.
[9]Kaczensky P,Adiya Y,von Wehrden H et al.Space and habitat use by wild Bactrian camels in the Transaltai Gobi of southern Mongolia[J].Biological Conservation,2014,169(100):311-318.
[10]Rogan M,.Rattray A,Morrie Craig.Molecular Characterization of Sheep Ruminal Enrichments that Detoxify Pyrrolizidine Alkaloids by Denaturing Gradient Gel Electrophoresis and Cloning[J].Microbial Ecology,2007,54(2):264-275.
[11]安登第,朱艳蕾,唐静等.骆驼瘤胃耐受/降解去氢骆驼蓬碱细菌的筛选[J].微生物学报,2010,50(8):1001-1007.
AN Dengdi,ZHU Yanlei,TANG Jing,et al.Screening of harmine tolerance/degrading bacteria from camel rumen[J].Acta Microbiologica Sinica,2010,50(8):1001-1007.(in Chinese)
[12]丁林生,孟正木.中药化学[M].南京:东南大学出版社,2005.
[13]沈萍,陈向东.微生物学实验[M].北京:高等教育出版社,2007.
[14]庹苏行,杨华武,吴名剑等.甲醇溶液直接吸收-离子液体富集-气相色谱-质谱法测定卷烟主流烟气中吡啶、喹啉和苯乙烯[J].分析化学,2012,40(7):1053-1058.
TUO Suxing,YANG Huawu,WU Mingjian,et al.Determination of Pyridine、Quinoline and Styrene in Mainstream Smoke Trapped by Methanol Solution Direct-Ionic Liquid Gathering Coupled Gas Chromatography-Mass Spectrometry[J].Chinese Journal of Analytical Chemistry,2012,40(7):1053-1058.(in Chinese)
[15]赖永忠.顶空进样-固相微萃取测定饮用水源水中吡啶[J].岩矿测试,2011,30(5):596-600.
LAI Yongkong.Determination of Pyridine in Drinking Source W ater by Head Space Sampling-Solid Phase M icroextraction[J]. Rock and Mineral analysis,2011,30(5):596-600.(in Chinese)
[16]吴丽娟,杨丽莉,胡恩宇等.液-液萃取-气相色谱法同时测定水中吡啶、松节油和苯胺[J].中国环境监测,2011,27:9-12
WU Lijuan,YANG Lili,HU Enyu,et al.Liqu-Liquid Extraction and Gas Chromatography for Simultaneous Measurement of Aniline、Turpentine Oil and Pyridine in Water[J].Environmental Monitoring in China,2011,27:9-12.(in Chinese)
[17]王基成,张秀霞等.两株吡啶降解菌的分离与鉴定[J].生态环境,2008,17(1):117-121.
WANG Jicheng,ZHANG Xiuxia,et al.Isolation and identification of two pyridine-degrading strain[J].Ecology and Environment,200 8,17(1):117-121.(in Chinese)
[18]Vanhaecke Lynn,Van Hoof Nathalie,Van Brabandt Willem,et.al.Metabolism of the food-associated carcinogen 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine by human intestinal microbiota.[J].Journal of Agricultural and Food Chemistry,2006,54(9):3454-3461.
[19]张庆芳,迟乃玉,郑燕等.乳酸菌降解亚硝酸盐机理的研究[J].食品与发酵工业,2002,28(8):27-31.
ZHANG Qinfang,CHI Naiyu,ZHENG Yan,et al.The study on mechanism of nitrite degradation by lactic acid bacteria[J].Food and Fermentation Industries,2002,28(8):27-31.(in Chinese)
[20]宋明鑫,许丽,王文梅等.乳酸菌降解胆固醇的作用机理及其在动物中的研究现状[J].饲料工业,2011,32(22):48-51. SONG Mingxin,XU Li,WANG Wenmei,et al.Lactobacillus degradation mechanism of action and research status of cholesterol in animals[J].Feed Industry,2011,32(22):48-51.(in Chinese)
Study on the Biodegradation of Pyridine by Lactobacillus Reuteri from Camel Rumen Extracts
ZHENG Lijuan,AN Dengdi,FEI Yingying,TANG qin,ZENG Xianchun*
(College of Life Science/Special Environment Species Protection and Regulation Biology Laboratory of Xinjiang,Xinjiang Normal University,Urumqi 830054,China)
8 lactobacillus reuteri were isolated from camel rumen and then cultured in mineral saults medium using pyridine(300 μg/mL)as the sole carbon source and nitrogen source.The absorbance at 600 nm was periodically measured by UV spectrophotometer to check the growth of Lactobacillus.The degradation of pyridin by lactobacillus reuteri was dynamically detected using Gas Chromatography-Mass Spectrometry(GC-MS)and the residual amount after degradation was calculated.According to the results,all the lactobacillus could effectively degraded pyridine,among which GU366027 and GU366021 can completely degraded pyridine when cultured for 84 h,while GU366034,GU366019 and U366030 needed 96h and others(GU366037,GU366038,GU366028)for 108 h.
camel rumen,lactobacillus reuteri,pyridine,biodegradation
Q 939.9
A
1673—1689(2015)04—0361—06
2014-08-13
国家自然科学基金项目(31160028);新疆自治区高校科研计划重点项目(XJEDU2010I44);新疆师范大学研究生科技创新项目(20131211);
*通讯作者:曾献春(1971-),女,江苏徐州人,教授,主要从事应用微生物学研究。E-mail:zengxc2004@163.com
