不同处理对毛红椿种子发芽的影响
2015-11-20王金厚乔春华王立超王晓东
王金厚,乔春华,王立超,石 燕,王晓东
(1.黄山学院 生命与环境科学学院 安徽 黄山245041;2.南京森林公安学院 江苏 南京210023)
生物多样性保护是全球范围内广泛关注的热点问题,其中如何有效保护濒危植物一直是研究的重点[1]。一般认为,濒危植物因种子产量低、种子生活力和发芽率低,从种子到幼苗转化率较低,导致幼苗稀少,种群更新存在困难。因此,促进和提高濒危植物种子发芽是保护和开发濒危植物种质资源的关键工作[2]。通过探讨濒危植物种子的生物学特性与其萌发影响因素之间的相互作用和相关性,可以为提高濒危植物种子的发芽率、发芽势、发芽指数和活力指数等提供科学理论依据。目前,国内外学者相继开展了影响濒危植物种子萌发的研究,如不同基质对种子萌发的影响[3]、外界生态因子(包括温度、光照等)和化学物质对种子萌发的影响[4-6]等。
毛红椿[Toona ciliata var.pubescens]为楝科(Meliaceae)香椿属红椿的天然变种植物,又名毛红楝、红楝子,落叶或近常绿乔木,主要产于我国的四川、贵州、福建、安徽等地,虽然在我国分布不广,但其生态幅较宽,向北分布可至安徽黄山北纬30°-40°[7,8]。近年来由于自然环境变化、过度砍伐以及其天然更新比较慢等原因,毛红椿数量和分布区在不断减少[9],零星分布于我国安徽、浙江、江西、湖南、云南等省,大多数居群内的植株数量不超过100 株[10],在1991年已被列为第一批国家二级保护濒危植物[11]。自20 世纪70年代末,一些学者就开始了毛红椿天然林群体分布、生物学特性和生长特性以及育苗、引种栽培技术等方面的研究[2,7,12-14],但对毛红椿种子萌发能力的影响因素方面的研究报道甚少,张丽等2011年[15]对毛红椿种子萌发的影响因素进行了初探。结果表明,毛红椿种子萌发最佳温度为25-27℃,光照会抑制毛红椿种子发芽,浸种可以提高毛红椿种子的发芽势和发芽率,并且0.3%高锰酸钾溶液消毒处理能显著促进毛红椿种子萌发。而培养基质、激素等因素对毛红椿种子萌发影响方面未见报道。为此,本试验以毛红椿种子为对象,探讨其在光照和黑暗环境下的不同播种基质上、不同浓度的赤霉素(GA3)下、酸胁迫下以及不同浓度的毛红椿果壳浸提液下对毛红椿种子萌发的影响,以提高毛红椿种子发芽率,为保护珍稀的毛红椿种质资源与促进种群更新以及在不同土壤地区播种育苗、引种栽培提供科学理论依据。
1 材料与方法
1.1 试验材料
毛红椿种子来源于安徽泾县,种子采收时间为2013年10月26日,带回实验室后,在室内自然晾晒贮藏,待果实开裂获得纯净种子和果壳。经测定,种子的千粒重为6.18g/千粒,优良度为94%。试验仪器设备与药品有培养箱(型号为DHG-9070AS)、人工气候箱 (型号为RXZ 智能型、PQX 型)、98%浓硫酸(H2SO4)、盐酸(HCl)、赤霉素(GA3)、培养皿、滤纸。
1.2 试验方法
1.2.1 不同播种基质对毛红椿种子发芽的影响试验
选择4 种不同的基质即红壤、黄心土、河沙和滤纸进行种子发芽试验。其中红壤取自黄山学院实习苗圃,属于地带性的红壤。河沙来源于黄山学院南区建筑工地,使用前用土壤筛出小石子和夹杂物,然后带回实验室。黄心土取自黄山学院南区第二教学楼和逸夫综合楼之间的空地,取土时先清除地表杂草等,挖开表层土壤至心土层,然后用铁铲取土,装入塑料袋,带回实验室。将筛选的毛红椿饱满种子播种在4 种不同基质(红壤、黄心土、河沙、滤纸)上,每基质3 个重复,每重复50 粒种子(下同),每基质分别在光照和黑暗2 种环境下培养。具体方法为:将试验所需的4 种基质和规格相同的全部培养皿放在电热恒温鼓风干燥箱中105℃高温消毒2 小时后取出自然冷却备用,然后将4 种基质分别放入6 个培养皿中,在每个培养皿中装入红壤、黄心土和河沙的量为培养皿高度的2/3 左右,以滤纸为发芽基质的培养皿中放入2 层滤纸,之后在每个培养皿中均匀的撒播毛红椿种子50 粒,并浇透水,在试验期间保持基质湿润且种子周围不出现水膜。将不同基质的培养皿置于温度25℃,光照(5000lx)24h/d 人工气候箱中和温度25℃电热恒温培养箱中培养,即分别为光照培养和黑暗培养。每天观察和记录各处理种子的发芽情况,统计发芽数。当胚根与种子等长时,即认为该种子已发芽[16]。发芽终期(第10 天)记录最终发芽种子数量。
1.2.2 GA3处理对毛红椿种子发芽的影响试验
不同浓度的GA3溶液的配制:用分析天平称取1.0000gGA3于烧杯中加少量95%酒精再加适量蒸馏水搅拌溶解后移至500ml 容量瓶中定容,得浓度为2000mg·L-1的GA3溶液;用量筒量取2000mg·L-1的GA3溶液250ml 于烧杯中,再移至500ml 容量瓶中定容,得浓度为1000mg·L-1的GA3溶液;用量筒量取1000mg·L-1的GA3溶液250ml 于烧杯中,再移至500ml 容量瓶中定容,得浓度为500mg·L-1的GA3溶液;以此类推,分别配置浓度为2000mg·L-1、1000mg·L-1、500mg·L-1、100mg·L-1、50mg·L-1、10mg·L-1的GA3溶液,共计6 个水平。用不同浓度的GA3溶液和蒸馏水培养以滤纸为培养基质的毛红椿种子,每水平3 个重复。将播种好的毛红椿种子置于温度25℃电热恒温培养箱中培养。最后观察和记录种子的萌发情况,统计发芽数。
1.2.3 酸胁迫对毛红椿种子发芽的影响试验
酸溶液的配制:按照n(H2SO4):n(HCL)=1:1 混合硫酸和盐酸,即硫酸与盐酸等摩尔比配制成混合溶液,用蒸馏水将混合溶液稀释至pH=1、pH=4、pH=5的酸溶液,相同方法可以得到pH=4 时不同摩尔比的酸溶液,即n (H2SO4):n (HCL)=1:2 和n(H2SO4):n(HCL)=2:1 的酸溶液。酸溶液稀释时用精密pH 试纸确定稀释后溶液的pH 值。将种子均匀撒播在以滤纸为培养基质的培养皿内,用不同摩尔比酸溶液、相同摩尔比不同pH 值的酸溶液和蒸馏水为培养液进行萌发,贴好标签,每个处理3 个重复。将其置于温度25℃电热恒温培养箱中培养。最后观察和记录种子的萌发情况,统计发芽数。
1.2.4 毛红椿果壳浸提液对毛红椿种子发芽的影响试验
不同浓度的果壳浸提液的配制:取已去除种子的毛红椿果壳80g,将其浸泡于400g 蒸馏水中24 h,获得果壳与水比例为1:5 的果壳浸提液。取适量浸提液,将其稀释1 倍,获得果壳与水比例为1:10的果壳浸提液; 以此类推,可获得1:5、1:10、1:20和1:50 的4 种比例的果壳浸提液并分别放入各自的广口瓶中,贴上标签,放入冰箱中低温保存备用。用不同浓度的果壳浸提液和蒸馏水培养毛红椿种子,每种浓度3 个重复,将其置于温度25℃电热恒温培养箱中培养。最后观察和记录种子的萌发情况,统计发芽数。
1.3 数据处理
根据试验记录的数据,计算毛红椿种子的发芽率、发芽势、发芽指数和平均发芽速度。其中种子发芽指标的计算公式为[17]:
种子发芽率 (GR)=正常发芽种子粒数/供测定种子总数×100%
发芽势(GP)=发芽种子数达到高峰时正常发芽种子粒数/供检种子总数×100%
式中:Gt为在第t 天的种子发芽数;Dt为相应种子发芽所用的时间。
采用常用的数据处理软件Microsoft Excel 2003 进行数据的统计和发芽指标的计算,应用DPS9.50 软件对不同处理下毛红椿种子的发芽率、发芽势、发芽指数、平均发芽速度作方差分析和多重比较,其中发芽率和发芽势运用反正弦平方根转换后计算。
2 结果与分析
2.1 光照条件及播种基质对毛红椿种子发芽的影响
光照条件下不同播种基质对毛红椿种子萌发的影响及多重比较结果见下表1。可见滤纸的发芽率、发芽势、发芽指数和平均发芽速度在处理间均是最高的,分别是91.36%、64.07%、44.03 和6.55,比其他处理的平均值分别高出了10.83%、20.32%、28.60%和3.97%; 而以红壤为播种基质的处理的各项发芽指标最低,其发芽指数与滤纸的发芽指数有显著差异(p=0.0189<0.05),平均发芽速度与滤纸的平均发芽速度有极显著差异(p=0.0032<0.01)。各处理间的发芽率的大小为滤纸>河沙>黄心土>红壤;发芽势的大小为滤纸>河沙>红壤>黄心土,尽管各处理间的发芽率和发芽势有差异,但其差异性并没有达到显著性水平。综合分析发芽各指标数值,毛红椿种子在光照条件下以滤纸和河沙为播种基质其发芽情况较理想。
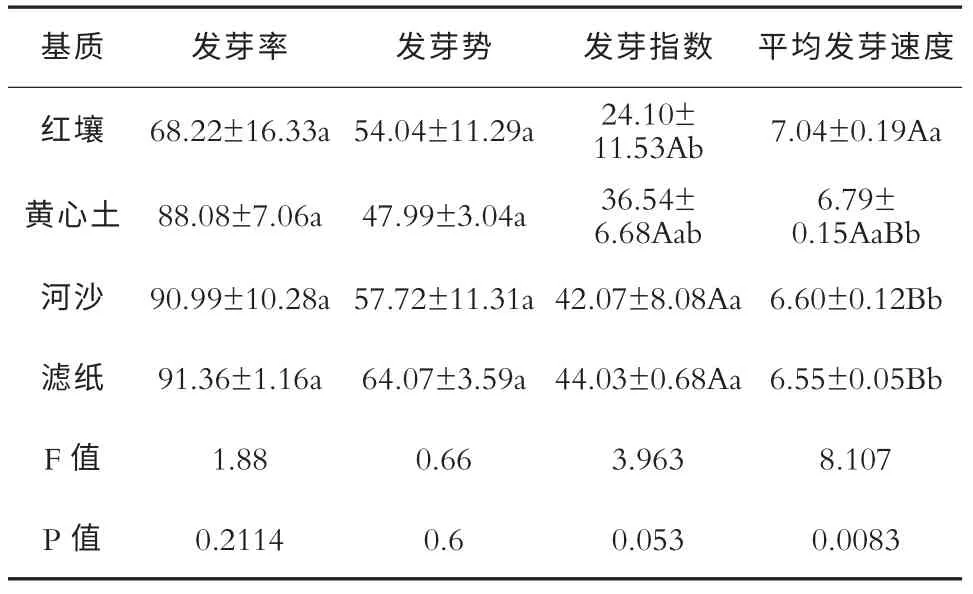
表1 光对毛红椿种子发芽率、发芽势、发芽指数和平均发芽速度的影响
黑暗条件下不同播种基质对毛红椿种子萌发的影响及多重比较结果见表2。各处理间的发芽率与滤纸相比均有所提高,其中以河沙最高,为92.32%,比滤纸的发芽率提高了5.45%,虽然发芽率均有所提高,但是其差异并不显著。发芽势方面,各处理的发芽势均没有滤纸的发芽势数值大,并且以黄心土为播种基质处理的发芽势最低,只有46.66%,与滤纸的发芽势85.15%有显著差异 (p=0.0183<0.05)。以黄心土、河沙为基质的发芽指数比滤纸的发芽指数27.51 分别提高了40.79%和25.37%,并且其差异极显著(p=0.0002<0.01)。各处理间的平均发芽速度较滤纸的平均发芽速度有所提高,且存在极显著的差异性(p=0.0001<0.01),其中以黄心土、河沙为播种基质的平均发芽速度比滤纸的平均发芽速度分别提高了7.09%和4.02%。

表2 黑暗对毛红椿种子发芽率、发芽势、发芽指数和平均发芽速度的影响
光照和基质对毛红椿种子发芽指标影响的双因素方差分析结果见表3。从发芽率来看,不同播种基质间、光照与黑暗环境间以及二者的交互作用对毛红椿种子发芽率的影响均表现为差异不显著。不同播种基质间对毛红椿种子发芽势的影响有显著差异(p=0.0282<0.05);光照与黑暗环境间对其发芽势的影响亦表现为显著差异(p=0.01<0.05),而不同播种基质间和光照与黑暗环境间的交互作用对其发芽势的影响表现为差异不显著(p=0.3717>0.05)。在发芽指数方面,不同播种基质间对毛红椿种子发芽指数的影响是有极显著的差异(p=0.0049<0.01);光照与黑暗环境间对其发芽指数的影响是没有显著差异的,然而二者的交互作用对其发芽指数又表现为显著差异 (p=0.0269<0.05)。对于平均发芽速度,不管是不同播种基质间、光照与黑暗环境间,还是二者的交互作用,均表现对毛红椿种子平均发芽速度有极显著的差异性。
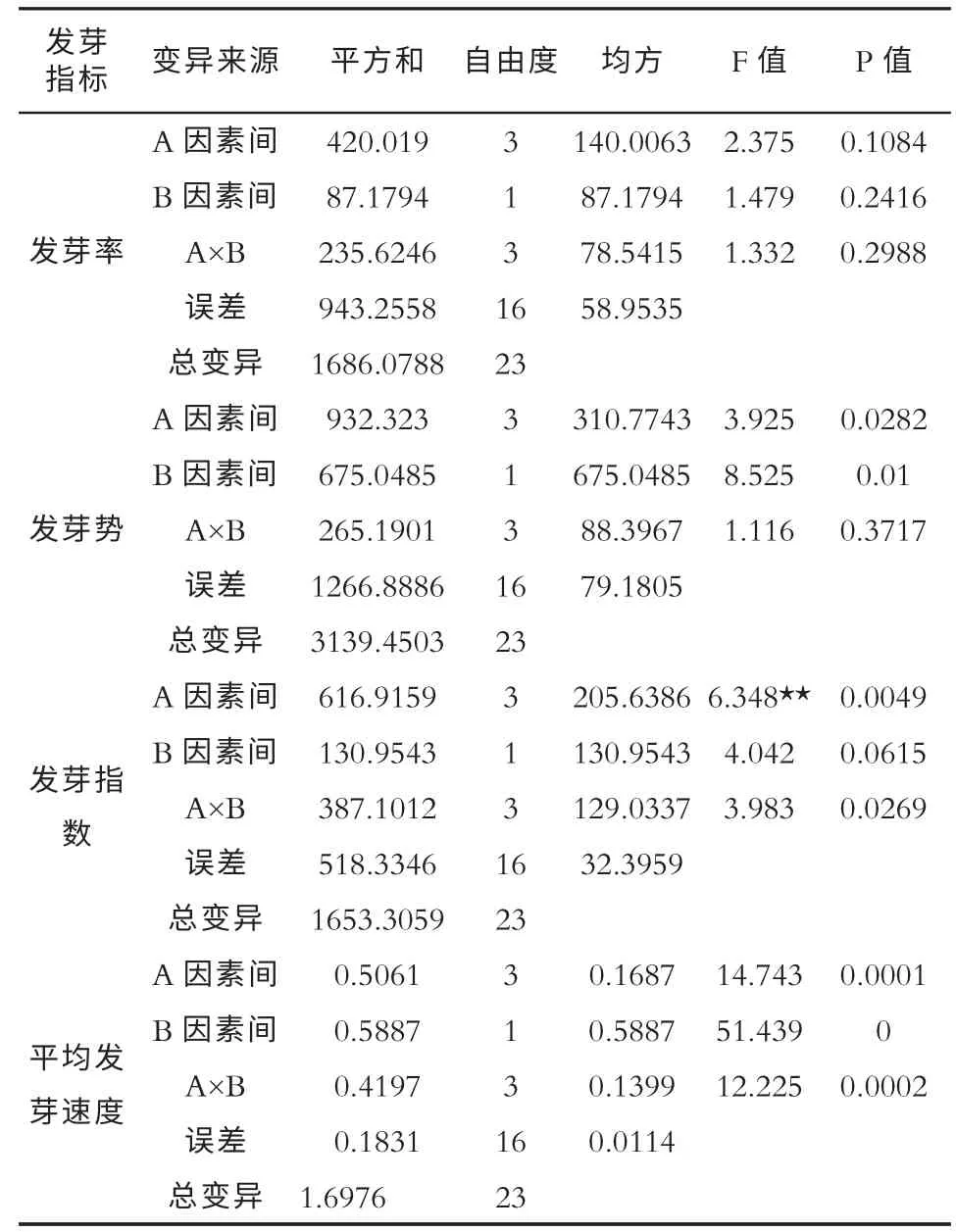
表3 光照和基质对毛红椿种子发芽指标影响双因素方差分析
从表3 中还可以看出,以红壤、黄心土和河沙为播种基质时的发芽率均表现为黑暗环境下处理高于光照环境下处理的发芽率,且红壤的2 种环境下差异最大,相差了19.33%,而以滤纸为播种基质时,光照下的发芽率略高于黑暗环境。除黄心土基质2 种环境下发芽势差别不大外,其他基质在2 种光照条件环境下发芽势均表现为黑暗环境下高于光照环境下,且均高出20.00%。红壤基质和黄心土基质的发芽指数在黑暗环境下高于光照环境下;而河沙基质和滤纸基质的发芽指数表现为光照环境下高于黑暗环境下。除黄心土基质的平均发芽速度在2 种光照环境下相近外,其他基质的平均发芽速度均表现为黑暗环境下高于光照环境下,且滤纸基质相差最大,为0.7 天。说明光照不仅会降低毛红椿种子的发芽率[14],而且也会抑制其种子发芽势、发芽指数和平均发芽速度。
2.2 GA3 溶液浓度对毛红椿种子发芽的影响
不同浓度GA3溶液处理对毛红椿种子萌发的影响及多重比较结果见表4。综合不同浓度GA3溶液对毛红椿种子发芽的影响结果表明,通过不同浓度的GA3溶液培养毛红椿种子对提高其发芽率、发芽指数和平均发芽速度均有一定的促进作用,但对发芽势的促进作用不明显甚至会有抑制作用。其中,以不同浓度GA3培养的种子的发芽率均高于蒸馏水处理水平,且发芽率均高于90%,但差异不显著(p=0.15>0.05),只有经浓度为1000mg·L-1的GA3溶液培养的种子的发芽率与蒸馏水处理水平的发芽率有显著差异(p=0.0112<0.05);经GA3溶液培养后种子的发芽指数也均高于蒸馏水处理水平,其各值均大于34,其平均值比蒸馏水处理水平高35.73%,并且二者差异极显著(p=0.0001<0.01);经GA3溶液处理后的种子的平均发芽速度相对于蒸馏水处理水平也有明显的提高,并且与蒸馏水处理水平的多重比较结果为差异极显著(p=0.0001<0.01)。经过不同浓度的GA3溶液处理后,毛红椿种子萌发总体表现为发芽率、发芽势、发芽指数随GA3浓度的升高呈先增大后减小的趋势; 平均发芽速度随GA3浓度的升高呈先加快后减慢的趋势。并且以GA3浓度为1000mg·L-1处理后的种子其发芽率、发芽势、发芽指数和平均发芽速度分别为97.38%、86.16%、40.10、6.79,均高于其他浓度处理的结果,相对于蒸馏水处理水平比较,其发芽率、发芽势、发芽指数和平均发芽速度分别提高了11.23%、1.19%、45.77%和6.77%,说明该浓度的GA3溶液对毛红椿种子萌发有明显的促进作用。

表4 不同赤霉素浓度对毛红椿种子发芽率、发芽势、发芽指数和平均发芽速度的影响
2.3 酸胁迫对毛红椿种子发芽的影响
酸胁迫对毛红椿种子发芽的影响及多重比较结果见表5。相同摩尔比,pH=1 时,其种子的发芽率、发芽势、发芽指数和平均发芽速度均为0,与蒸馏水和其他酸胁迫水平间差异极显著 (p 值分别为0.0000、0.0002、0.0000、0.0000<0.01),表明强酸会使毛红椿种子失活而不能发芽。其他处理水平下的发芽率、发芽指数和平均发芽速度较蒸馏水各值均有所提高,平均分别提高了8.02%、46.99%和7.45%,且发芽指数和平均发芽速度指标的差异为极显著水平(p 值均为0.0000<0.01)。相同摩尔比时,pH=5的发芽率、发芽指数和平均发芽速度最高,分别为96.00%、41.67、6.73,较蒸馏水处理的发芽率、发芽指数和平均发芽速度分别提高了9.65%、51.47%和7.73%,且发芽率的差异显著,不同pH 值对毛红椿种子发芽指标影响总体表现为“弱促强抑”的趋势。相同pH(pH=4),不同摩尔比的酸胁迫处理,其种子发芽率大小顺序为1:2>2:1>1:1;发芽势和发芽指数大小顺序均为2:1>1:1>1:2;平均发芽速度的大小顺序为1:1>2:1>1:2,但各处理间的差异不显著。综合各处理的发芽指标数值,当n(H2SO4):n(HCL)=1:1,pH=5 时,各发芽指标较为理想。

表5 酸胁迫对毛红椿种子发芽率、发芽势、发芽指数和平均发芽速度的影响
2.4 不同浓度果壳浸提液对毛红椿种子发芽的影响
以不同浓度的毛红椿果壳浸提液培养毛红椿种子,对其萌发的影响及多重比较结果见表6。不同浓度的果壳浸提液对毛红椿种子发芽的总的趋势呈低浓度促进高浓度抑制,其中1:20 是其种子发芽率最高,为95.55%,相比于蒸馏水其发芽率提高了9.14%,1:10 时其种子发芽率也达到了95.38%,其他浓度处理的发芽率也均高于蒸馏水,但是水平间差异不显著(p=0.1664>0.05)。发芽势方面,只有1:10时其种子发芽势高于蒸馏水为89.35%,其他浓度处理均低于蒸馏水;1:20 时的种子发芽势最低,为52.00%,且它与1:10 浓度处理和蒸馏水的发芽势的差异显著(p=0.0106<0.05)。发芽指数和平均发芽速度方面,表现为低浓度促进、高浓度抑制的趋势。1:50-1:10 浓度处理的发芽指数分别为42.20、42.42和40.38,比蒸馏水的发芽指数分别提高了53.40%、54.20%和46.78%; 平均发芽速度分别为6.64、6.67和6.75,比蒸馏水的平均发芽速度分别提高了9.19%、8.70%和7.41%,且二者与蒸馏水和浓度为1:5 处理间的对应值均表现为差异极显著(p 值均为0.0000<0.01),而浓度为1:5 的果壳浸提液处理较1:50-1:10 浓度处理,其发芽指数和平均发芽速度表现出“低促高抑”的趋势。就分析结果总体而言,果壳浸提液浓度为1:20 时的各项发芽指标较理想。

表6 果壳浸提液浓度对毛红椿种子发芽率、发芽势、发芽指数和平均发芽速度的影响
3 结论与讨论
1.黑暗条件有利于毛红椿种子发芽,在光照条件下不同播种基质对毛红椿种子萌发影响是有差异的。而且提高毛红椿种子的发芽指标,需要有通气透水性强的播种基质。
2.从本试验结果中可以看出,不同浓度的GA3溶液对毛红椿种子的萌发有一定的影响,影响结果总体表现为发芽率、发芽势和发芽指数均随GA3溶液浓度的升高呈先增大后减小的趋势;平均发芽速度随GA3浓度的升高呈先加快后减慢的趋势,且当GA3浓度为1000mg·L-1时,毛红椿种子的各项发芽指标较好,低于该浓度时促进不明显,高于该浓度时有抑制的现象。
3.在pH=4 时,不管硫酸与盐酸的摩尔比如何,其对毛红椿种子萌发均有促进作用,但是不同摩尔比比例的混合酸溶液对毛红椿种子发芽率的影响有一定的差异,其促进作用大小顺序为:1:2>2:1>1:1,可能与不同摩尔硫酸根离子和氯离子对毛红椿种子萌发影响不同有关。
4.本试验结果表明,不同浓度的果壳浸提液对毛红椿种子萌发影响总的趋势呈低浓度促进高浓度抑制。在果壳浸提液浓度为1:20 时,毛红椿种子的发芽率最高,为95.55%,而高于1:20 时,其发芽率开始下降,当果壳浸提液浓度为1:5 时,与蒸馏水处理相比,毛红椿种子发芽率和发芽势均低于蒸馏水处理,表明毛红椿果壳中含有对自身种子起抑制作用的水溶性化感物质,说明了毛红椿是具有自毒作用的树种。因此,在以后的毛红椿人工林的经营管理和果壳肥料开发及运用方面应有适当的措施,以克服或减轻毛红椿的自毒作用。以本试验结果为依据,可以在日后对毛红椿叶片和枝条里所含物质的种类、作用以及对自身自毒作用和对其他植物的他感作用方面做进一步的研究。
[1]Luc De Meester, Peter van Tienderen, Marinus Werger, et al.Challenges for biodiversity research in Europe [J].Procedia Social and Behavioral Sciences, 2011,13:83–100.
[2]何中声,刘金福,洪伟,等.不同处理对格氏栲种子发芽的影响[J].北京林业大学学报,2012,34(2):66-70.
[3]黄桂华,梁坤南,周再知,等.不同基质对柚木种子发芽与幼苗生长的影响[J].种子,2009,28(10):86-90.
[4]Geissler K,Gzik A.Germination ecology of three endangered river corridor plants in relation to their preferred occurrence[J].Flora, 2010,205(9):590-598.
[5]文彬,何惠英,王如玲,等.濒危植物多毛坡垒种子萌发的生理生态特性[J].云南植物研究,2009,31(1):42-48.
[6]卢杰,郑维列,张建新.温度对长鞭红景天种子发芽的影响[J].西北林学院学报,2010,25(3):101-106.
[7]邹高顺.珍贵速生树种红椿与毛红椿引种栽培研究[J].福建林学院学报,1994,14(3):271-276.
[8]张光富.安徽珍稀濒危植物及其保护[J].安徽师范大学学报(自然科学版),2000,23(1):36-39.
[9]钱崇澎,陈焕铺.中国植物志[M].北京:科学出版社,1978:36-37.
[10]刘军.毛红椿天然居群遗传结构研究[D].北京:中国林业科学研究院,2007:1-4.
[11]傅立国.中国植物红皮书(第1 册)[M].北京:科学出版社,1991:142-669.
[12]王树凤,陈益泰,徐爱春.盐胁迫对2 种珍贵速生树种种子萌发及幼苗生长的影响[J].植物资源与环境学报,2007,16(1):49-52.
[13]周翔宇.中国香椿属的研究[D].南京:南京林业大学,2005:13-14.
[14]黄红兰,张露,廖承开.毛红椿天然林种子雨、种子库与天然更新[J].应用生态学报,2012,23(4):972-978.
[15]张丽,张露.毛红椿种子萌发影响因素初探[J].林业科技开发,2011,25(6):54-56.
[16]陶月良,叶利勇,杨加付.温州盘菜种子萌发特性研究[J].河南科技,2002,20(4):375-377.
[17]雷小平,靳立荣,马登萍.不同基质对北方枸杞出苗和苗期生长的影响[J].青海大学学报(自然科学版),2009,27(1):71-74.
