葛根素对乳腺癌细胞MCF-7增殖及凋亡的影响
2015-11-20李馨刚北华大学附属医院吉林吉林132000
李馨刚 (北华大学附属医院,吉林 吉林 132000)
研究表明,葛根素具有保护心血管系统、抗氧化、降血糖等功能〔1~3〕。李娟等〔4〕表明,葛根素可以抑制人小细胞肺癌细胞株H446的增殖;Yu等〔5〕的研究也证实,葛根素对结肠癌细胞株HT-29细胞增殖具有一定的抑制作用,而葛根素对乳腺癌细胞株MCF-7的作用未见报道。本研究采用葛根素处理人乳腺癌MCF-7细胞,观察对其细胞增殖和凋亡的影响,并初步探讨其作用机制。
1 材料与仪器
1.1材料 乳腺癌MCF-7细胞购于美国ATCC公司;葛根素(纯度 >99%)购于中国药品生物制品检定所;RPMI 1640细胞培养基购自美国Hyclone公司;胰蛋白酶、优质胎牛血清购自美国Gibco公司;四甲基偶氮唑盐(MTT)、碘化丙啶(PI)及Triton X-100购自美国Sigma公司;蛋白抽提-RIPA裂解液购自武汉博士德生物工程有限公司;二喹啉甲酸(BCA)蛋白分析试剂盒购自碧云天生物科技公司;Bcl-2、Bax、Cleaved caspase-3单克隆抗体及内参还原型辅酶(GAPDH)购自美国Cell Sigaling Technology公司;二抗辣根过氧化物酶(HRP)标记的IgG购自北京中杉金桥生物技术有限公司;Annexin-V-FITC/PI细胞凋亡检测试剂盒购自北京赛宝生物公司;其他试剂均为分析纯。
1.2仪器 5417小型台式冷冻离心机自德国Eppendorf公司;Mini Protean 3 Cell小型垂直电泳槽自美国Bio-Rad公司;Multiskan Mk3酶标仪自Thermo公司;TS100型显微镜自日本Nikon公司;FACS CaliburTM流式细胞仪自美国BD公司。
1.3方法
1.3.1细胞培养 严格遵循无菌原则,将已解冻的MCF-7细胞于含15%胎牛血清的培养基中常规培养(37℃、5%CO2饱和湿度),每隔24 h更换培养基,镜下观察待达到80% ~90%融合,采用0.25%胰蛋白酶消化传代,稳定传3~5代,取对数生长期的细胞用于实验。
1.3.2细胞增殖活性检测 取对数生长期MCF-7细胞,以1×105/孔的密度接种培养板(96孔),24 h后向培养基中加入葛根素,使终浓度依次为 0、20、50、100、200 μg/ml,其中以0 μmol/L为对照组,其余浓度则设为实验组,常规条件(37℃、5%CO2饱和湿度)下培养,分别于培养 24、48、72、96 h后向每孔加入5 mg/ml的MTT溶液10 μl,4 h后在492 nm波长下采用酶标仪读取各组吸光值(A),增殖抑制率(%)=(1-实验组A/对照组A)×100%。同一观察时间点每个浓度重复3次。
1.3.3细胞凋亡率及细胞周期检测 采用Annexin V-FITC/PI双染流式细胞术检测细胞凋亡,PI单染流式细胞术检测细胞周期。按1×106/孔的密度将MCF-7细胞接种培养板(6孔),24 h后向培养基中加入葛根素使终浓度依次为0、20、50、100、200 μg/ml,常规条件(37℃、5%CO2饱和湿度)下培养,24 h 后收集细胞并行磷酸盐缓冲液(PBS)冲洗,根据Annexin-V-FITC/PI细胞凋亡检测试剂盒说明书操作,分别加入Annexin V/FITC和PI,染色15 min后上机测定凋亡率及细胞周期。
1.3.4凋亡指数检测 向预先置入培养板底部的灭菌小玻片接种MCF-7单细胞悬液,镜下观察待细胞贴壁后,加入葛根素,使终浓度依次为 0、20、50、100、200 μg/ml,培养 48 h 后采用多聚甲醛固定细胞,PBS冲洗采用Hoechst 33258(5 μg/ml),室温下避光染色,30 min后于荧光显微镜下观察,每个片子随机选取5个高倍视野,凋亡指数=凋亡细胞数/总细胞数×100%。
1.3.5免疫印迹 收集 0、20、50、100、200 μg/ml葛根素处理48 h后的MCF-7细胞,1 000 r/min离心5 min后,向细胞沉淀中加入细胞裂解液,于冰上采用裂解后,测定蛋白浓度(BCA法),每个样本取定量蛋白,与上样缓冲液混合后,常规行10%十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳和半干转法转膜,根据膜大小加入适量一抗,除Bax的稀释比例为1∶100外,其余均为1∶200,4℃孵育过夜,Tris盐酸缓冲液(TBST)洗膜后加入二抗(1∶3 000),室温2 h后行ECL显色,采用Gel-Pro analyzer软件分析各条带光密度,以目的蛋白与GAPDH光密度的比值表示。
1.4统计学方法 应用SPSS19.0软件进行单因素方差分析和SNK-q法。
2结果
2.1不同浓度葛根素对MCF-7细胞增殖的影响 葛根素可抑制MCF-7细胞的增殖活性,除20 μg/ml葛根素作用24 h外,各浓度作用24、48、72、96 h后的增殖抑制率均高于0 μg/ml(P <0.05),且 20、50、100、200 μg/ml组间差异有统计学意义(P <0.05);总体上葛根素可呈剂量和时间依赖的方式提高增殖抑制率(P<0.05)。见表1。
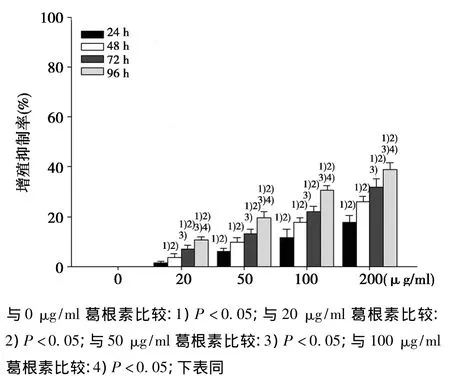
图1 不同浓度葛根素对MCF-7细胞增殖抑制情况
2.2不同浓度葛根素对MCF-7细胞凋亡的影响 葛根素可提高 MCF-7 细胞的早期、晚期凋亡率,20、50、100、200 μg/ml的早期、晚期凋亡率均高于0 μg/ml(P<0.05),且各浓度组间均有统计学差异(P<0.05);同时,葛根素可提高MCF-7细胞的凋亡指数,随葛根素浓度的增加,凋亡指数升高,且各浓度间均有统计学差异(P<0.05)。见表1。

表2 不同浓度葛根素对MCF-7细胞凋亡的影响(x ± s,%)
2.3不同浓度葛根素对MCF-7细胞周期的影响 葛根素可降低S期及G2/M期细胞比例,提高G0/G1期细胞比例,各浓度间均有统计学差异(P<0.05)。见表2。
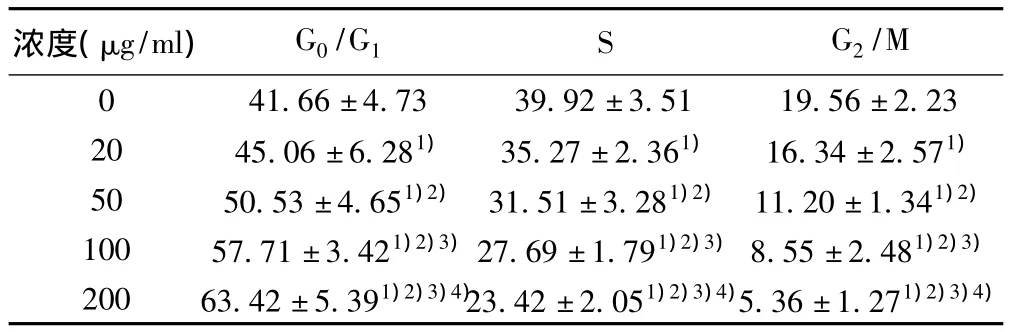
表2 不同浓度葛根素对MCF-7细胞周期的影响(x ± s,%)
2.4不同浓度葛根素对凋亡相关基因表达的影响 葛根素可降低Bcl-2蛋白水平,且升高Bax和Cleaved caspase-3的蛋白水平,各浓度间均有统计学差异(P<0.05)。见表4。
表4 不同浓度葛根素对MCF-7细胞凋亡相关基因表达的影响(s)
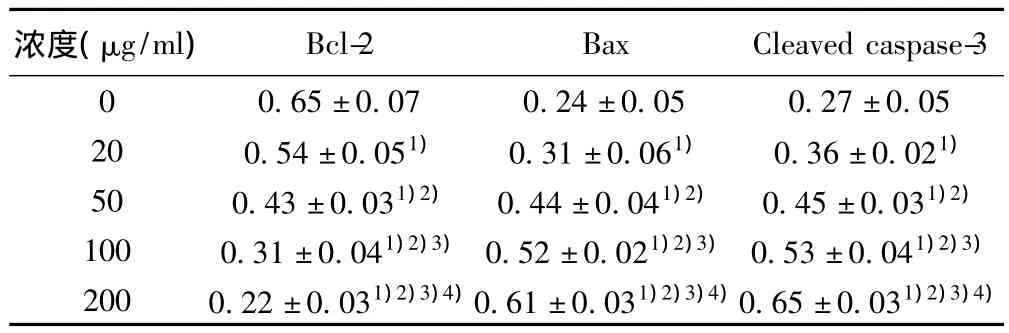
表4 不同浓度葛根素对MCF-7细胞凋亡相关基因表达的影响(s)
浓度(μg/ml)Bcl-2 Bax Cleaved caspase-3 0 0.65±0.07 0.24±0.05 0.27±0.05 20 0.54±0.051) 0.31±0.061) 0.36±0.021)50 0.43±0.031)2) 0.44±0.041)2) 0.45±0.031)2)100 0.31±0.041)2)3)0.52±0.021)2)3)0.53±0.041)2)3)200 0.22±0.031)2)3)4)0.61±0.031)2)3)4)0.65±0.031)2)3)4)
3讨论
恶性肿瘤严重威胁着人类生命和健康,其发病率和死亡率在许多国家和地区均高居首位〔6〕。肿瘤的化学治疗同手术治疗和放疗一样,已成为治疗肿瘤的重要手段之一,然而目前使用的肿瘤化疗药物常伴有严重的副作用,如疼痛、呕吐、脱发、进食困难等〔7〕。近年来,从传统中药中筛选抗肿瘤先导化合物及抗肿瘤活性成分逐渐成为人们关注的热点。目前,来源于植物药的抗癌制剂已超过总抗癌药物的30%,其中紫杉醇、长春新碱和喜树碱等已成为许多肿瘤治疗的首选药〔8〕。
本研究提示葛根素可抑制MCF-7细胞的增殖。细胞周期紊乱是癌细胞的基本特征,而抗癌效果或增敏剂一般通过影响细胞周期来发挥抗癌作用〔9〕。本研究亦发现葛根素可影响MCF-7的细胞周期,葛根素可将细胞阻滞在G0/G1期。除细胞过度增殖与细胞周期异常外,恶性肿瘤的发生与细胞凋亡减少亦有关〔10〕。本研究结果发现,与未处理细胞相比,葛根素处理后的MCF-7细胞凋亡率、凋亡指数及凋亡促进基因的蛋白水平均上调,而凋亡抑制基因的表达下降,以上表明葛根素可促进MCF-7细胞的凋亡。该作用可能与提高凋亡促进蛋白表达、降低凋亡抑制蛋白表达有关。
1 Zhang H,Zhang L,Zhang Q,et al.Puerarin:a novel antagonist to inward rectifier potassium channel(IK1)〔J〕.Mol Cell Biochem,2011;352(1-2):117-23.
2 Liu S,Zhang C,Shi Q,et al.Puerarin blocks the signaling transmission mediated by P2X3 in SG and DRG to relieve myocardial ischemic damage〔J〕.Brain Res Bull,2014;101(1):57-63.
3 Li Z,Shangguan Z,Liu Y,et al.Puerarin protects pancreatic β-cell survival via PI3K/Akt signaling pathway〔J〕.J Mol Endocrinol,2014;53(1):71-9.
4 李 娟,胡永华.葛根素对人小细胞肺癌H446细胞周期和相关周期蛋白表达的影响〔J〕.中草药,2008;39(10):1535-7.
5 Yu Z,Li W.Induction of apoptosis by puerarin in colon cancer HT-29 cells〔J〕.Cancer Lett,2006;238(1):53-60.
6 徐 珊,徐昌芬.肿瘤多药耐药性发生机制及中药逆转作用的研究进展〔J〕.中国肿瘤生物治疗杂志,2006;13(6):404-11.
7 Zeremski V,Savic A.Post-remission therapy of adult acute mycloid leukemia:high dose cytosine-arabinoside versus other consolidation regimens〔J〕.Med Pregl,2014;67(3-4):83-90.
8 Ando M,Yonemori K,Katsumata N,et al.Phase I and pharmacokinetic study of nab-paclitaxel,nanoparticle albumin-bound paclitaxel,administered weekly to Japanese patients with solid tumors and metastatic breast cancer〔J〕.Cancer Chemother Pharmacol,2012;69(2):457-65.
9 张伟红,张西臣,邢沈阳,等.DHRS7对人乳腺癌细胞MCF-7细胞周期的影响及其在乳腺癌组织中的表达〔J〕.吉林大学学报(医学版),2012;38(3):537-42.
10 方艳秋,齐亚灵,芦小单,等.环氧合酶2抑制剂NS-398对人肝癌细胞SMMC-7721增殖与凋亡的影响〔J〕.吉林大学学报(医学版),2013;39(6):1190-4.
