电针对局灶性脑缺血大鼠神经行为学及酪氨酸激酶JAK2的影响
2015-11-20许能贵广州中医药大学针灸康复临床医学院广东广州510006
刘 荣 许能贵 (广州中医药大学针灸康复临床医学院,广东 广州 510006)
研究证明,脑缺血损伤引起的细胞凋亡多与白介素、肿瘤坏死因等细胞因子有关,而JAK/STAT系统可能在以上因子发生作用的信号转导过程中的起重要作用〔1〕。JAK2作为酪氨酸蛋白激酶JAK家族的一员,参与了免疫、造血、神经等系统的信号转导〔2〕。研究发现,脑缺血损伤后 JAK2磷酸化抑制剂AG490可以抑制JAK2的活化,下调STAT3的磷酸化水平,抑制神经元细胞凋亡,从而保护脑缺血后神经细胞以及改善神经功能缺损〔3〕。扬谦梓等〔4〕在研究兔右侧大脑中动脉梗死模型中发现,与对照组相比,应用JAKs酪氨酸磷酸化抑制剂AG490可改善大鼠神经行为评分(NBS)并缩小其脑梗死面积。我们的前期研究工作已初步证实了,脑缺血后磷酸化JAK2、STAT3超量表达,JAK2-STAT3信号转导通路异常激活;而脑缺血后电针治疗可下调p-JAK2、p-STAT3蛋白的表达水平,阻断JAK2-STAT3信号转导通路的异常激活,这可能为电针治疗脑缺血损伤、抑制神经元凋亡的重要机制之一〔5~7〕。本实验探讨酪氨酸激酶JAK2在脑缺血损伤中的作用,进一步揭示电针治疗缺血性脑疾病的作用机制。
1 材料与方法
1.1实验动物 SPF级SD大鼠250只,雄性,体重180~220 g,广州中医药大学动物实验中心提供,许可证号:SCXK(粤)2008-0020。将动物分为假手术组、模型组、电针组、AG490组、电针+AG490组,每组各50只,各组按造模后时间的不同分为2 h、1、3、7和21 d的5个时间段,每小组10只大鼠。
1.2主要试剂 AG490(德国Merck公司)、DMSO(美国Sigma公司)、大鼠JAK2原位杂交检测试剂盒(针对大鼠JAK2靶基因的mRNA序列为:①5'-GCCGC CACTG AGCAA AAAGG TAAGA CAT,②5'-TCGCT CAACG GCAAA GGTCA GGAAG TAT)(天津灏洋生物工程有限公司)、DAB显色试剂盒(武汉博士德公司)、兔抗 p-JAK2多克隆抗体(美国 Santa公司)、山羊抗兔IgG-HRP(美国Santa公司)。
1.3主要仪器 G6805-Ⅰ型电针仪(青岛鑫升厂)、华佗牌无菌针灸针(0.3 mm×25 mm,苏州医疗用品厂)、932型电热凝器(上海医疗器械八厂)、Leica冰冻切片机(德国Leica公司)、大鼠大脑立体定位仪(上海京工实业有限公司)、蔡司AxioCam-MR显微镜(德国Zeiss公司)。
1.4方法
1.4.1局灶性脑缺血模型制备 采用热凝闭大脑中动脉致局灶性脑缺血模型。用10%水合氯醛溶液,按0.33 ml/100 g腹腔注射麻醉大鼠。取右侧卧位固定,沿耳眼连线中点切开皮肤,分离颞肌,暴露颞骨做一骨窗,轻抬脑,显露大脑中动脉,用932型电热凝器轻触大脑中动脉,使之凝闭,造成局灶性脑缺血模型。其中假手术组只手术暴露大鼠大脑中动脉,不予凝闭。
1.4.2治疗方法 电针组术后给予电针治疗,选取“百会”、“大椎”两穴。两穴接上电针,用疏密波,疏密波调制频率为20次/min,电流强度约1~2 mA,以大鼠安静耐受为度,时间30 min,1 次/d。
1.4.3AG490侧脑室注射 将AG490溶解于3%二甲基亚砜(DMSO)溶液中。大鼠腹腔注射10%水合氯醛(0.33 ml/100 g)麻醉后,于立体定向仪上固定门齿与两外耳道。头顶皮肤剃毛,消毒后切开颅顶皮肤。钝性分离筋膜,暴露Bregma点,并以黑墨水标记。进针点位于Bregma点后0.8 mm,矢状缝右侧1.5 mm。用注射器针头在定点上钻孔,保证将颅骨钻透但不伤及脑实质。消毒棉球止血,干燥术野后,将装载有10 μl药物的25 μl微量注射器(尖端连接玻璃电极)与立体定向仪连接,针深至腹侧4.8 mm。进入侧脑室后,缓慢匀速推注药物,时间为10 min,再留针2 min。
1.5神经功能缺损评分 采用Zea-Longa的5分制评分标准进行神经功能缺损评分,其中1~4分为动物缺血模型成功的标志。具体评分标准如下:0分:无任何神经功能缺损症状;1分:轻微神经功能缺损,不能完全伸展对侧前爪;2分:中度局灶性神经功能缺损,行走时向缺血灶对侧转圈;3分:重度局灶性神经功能缺损,站立时向缺血灶对侧倾倒;4分:不能自发行走,意识丧失。
1.6JAK2 mRNA原位杂交 将冰冻切片置过氧化氢封闭液室温20 min,以封闭内源性过氧化氢酶。0.01 mol/L PBS清洗5 min×1。滴加消化工作液,覆盖组织表面,室温20 min。0.01 mol/L PBS清洗5 min×3。0.2×SSC洗涤3 min×1。滴加预杂交工作液覆盖组织37℃湿盒孵育1 h。预杂交后的洗涤-揭去盖玻片以0.2×SSC洗涤5 min×3。滴加杂交工作液(含探针5 μg/ml)覆盖组织37℃湿盒孵育2 h。杂交后的洗涤-揭去盖玻片以0.2×SSC洗涤5 min×3,0.01 mol/L PBS洗涤5 min×3。滴加小鼠抗地高辛生物素标记的抗体工作液,覆盖组织37℃湿盒孵育45 min。0.01 mol/L PBS冲洗5 min×3。滴加高敏过氧化物酶链亲和素复合物工作液。覆盖组织37℃湿盒孵育45 min。0.01 mol/L PBS冲洗5 min×3。DAB显色,光学显微镜下观察至细胞内胞质阳性颜色与细胞外背景颜色对比度反差明显时蒸馏水洗终止反应。苏木素复染,胞核为蓝色。梯度乙醇(75%、85%、95%、100%)脱水,5 min/次,二甲苯透明3 min×2,中性树胶封片保留。应用Image-ProPluse 6.0图像分析系统测定光密度值。
1.7统计学方法 采用SPSS13.0统计软件包进行单因素方差分析及LSD检验。
2结果
2.1神经功能缺损评分 见表1。假手术组大鼠各时段神经功能缺损评分均为0分。在脑缺血不同时间段方面,脑缺血1 d时各组大鼠神经功能缺损评分与其他时间段相比处于较高水平。在不同处理方面,模型组的分值最高,除21 d组外,与电针组、AG490组及AG490+电针组比较,差异均有统计学意义(P<0.05)。缺血后3 d模型组大鼠神经功能缺损有所减轻,部分大鼠向病灶对侧倾倒或转圈运动,与假手术组比较有显著差异(P<0.01),而电针组、AG490组和AG490+电针组大鼠神经缺损功能逐渐恢复,评分明显低于同时间段模型组(P<0.01),但3组间评分比较无统计学意义(P>0.05)。缺血7 d后,各组大鼠神经功能缺损状况有所改善,其中电针组、AG490组和AG490+电针组大鼠神经行为学评分与同时间段模型组相比均降低(P<0.05)。21 d后模型组大鼠神经功能缺损评分继续下降,与假手术组比较仍有显著差异(P<0.01),但模型组、电针组、AG490组和AG490+电针组之间无显著差异(P>0.05)。
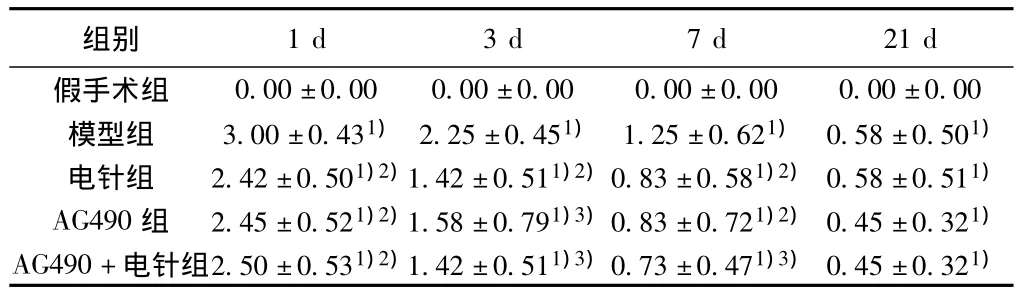
表1 各组大鼠神经功能缺损评分比较(x ± s,n=10)
2.2缺血灶大脑皮质JAK2 mRNA表达 各时段的假手术组均只有极少量JAK2 mRNA表达。缺血2 h后其他各组JAK2 mRNA水平即开始升高,与同时段假手术组相比均有显著性差异(P<0.01),其中又以模型组升高最明显,与 AG490组、AG490+电针组间差异有统计学意义(P<0.05)。除假手术组,缺血1 d后各组均升高达到峰值,模型组最为显著,电针组次之,AG490组及AG490+电针组也达到组内峰值。电针组、AG490组及AG490+电针组JAK2 mRNA表达比模型组显著降低 (P<0.01)(图1)。各组在缺血3 d后JAK2 mRNA水平开始下降,7 d后各组均持续下降,电针组、AG490组及AG490+电针组仍明显低于模型组 (P<0.01)。除假手术组,到了缺血后21 d各组JAK2 mRNA表达水平差异不明显 (P>0.05),见表2。

图1 脑缺血后1 d各组局灶性脑缺血大鼠大脑缺血侧皮质JAK2 mRNA表达(DAB,×400)
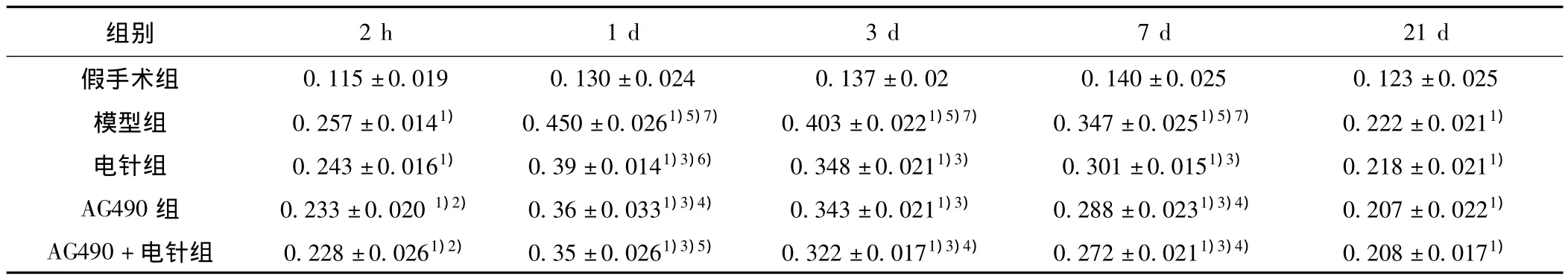
表2 各组大鼠JAK2 mRNA表达比较(x ± s,n=10)
3讨论
JAKs激酶为JAK/STAT信号转导系统的重要组成部分,其是许多细胞因子、生长因子的重要信号传感器。JAKs激酶不仅在神经系统表达,也是脑缺血后的炎性反应、决定病灶区细胞凋亡进程的重要因素。
JAK2是JAK家族中较为重要的一个成员,其与STAT家族的多个成员共同构成了多条信号转导途径,如JAK2/STAT3、JAK2/STAT5等〔8〕。脑缺血时能引起大量细胞因子和生长因子的释放,这些因子能够激活JAK2的表达,从而作用于其下游因子STAT,使其磷酸化。本研究发现在局灶性脑缺血大鼠模型中再灌注6~72 h的缺血侧皮质和纹状体中,磷酸化JAK2表达增多,在脑缺血后磷酸化JAK2的阳性物质主要分布于缺血侧皮质和纹状体的小胶质细胞和巨噬细胞中。此外,脑内注射AG490可以阻止缺血后JAK2活化,并可以明显地缩小病变区域梗死的体积和减轻细胞凋亡和神经功能的缺失〔8〕。
神经功能缺损是评价局灶性脑缺血以及缺血性脑损害最重要的终末指标之一。研究中神经行为学观察性评分指标包括运动减少、前肢屈曲、肌力下降、身体旋转、侧倾姿势、呼吸窘迫等,此评分标准能较客观地分析脑缺血后神经功能障碍程度。本研究提示脑缺血后JAK2超量表达及活化在脑缺血诱导的神经元死亡中起着决定性的作用,电针治疗能有效抑制JAK2的超量表达,从而阻断JAK2诱导的信号转导通路的异常激活,这可能为电针治疗脑缺血损伤、抑制神经元凋亡的重要机制之一。对于脑缺血损伤后JAK-STAT信号转导通路与细胞凋亡的关系及“针刺刺激-信号调节-神经自稳态启动”的确切途经和机制是我们进一步探索深化研究的方向。
1 Planas AM,Gorina R,Chamorro A.Signalling pathways mediating inflammatory responses in brain ischaemia〔J〕.Biochem Soc Trans,2006;34(6):1267-70.
2 Wang LA,Bi H,Ji HR,et al.Effect of lumbrokinase on JAK-STAT pathway in rat brain during cerebral ischemia and reperfusion〔J〕.Chin Pharm J,2009;44(24):1862-5.
3 谢惠芳,徐如祥,魏继鹏,等.JAK2/STAT3信号转导通路在缺血性脑损伤中作用机制的研究〔J〕.中风与神经疾病杂志,2008,25:135-8.
4 杨谦梓,雷 翀,路志红,等.JAK-STAT通路抑制剂和自由基清除剂联合应用对局灶性脑缺血再灌注损伤的保护作用研究〔J〕.中国危重急救医学,2008;20(11):641-4.
5 刘 荣,易 玮,许能贵,等.脑缺血后JAK-STAT信号转导系统的调控及针刺干预作用〔J〕.中国老年学杂志,2011;31(4):717-8.
6 刘 荣,易 玮,许能贵,等.JAKs激酶在脑缺血损伤中的影响及针刺干预作用〔J〕.辽宁中医药大学学报,2011;7(1):43-5.
7 刘 荣,许能贵,易 玮,等.脑缺血后JAK-STAT信号转导系统的调控及针刺干预作用〔J〕.神经解剖学杂志,2011;27(6):617-22.
8 Satriotomo I,Bowen KK,Vemuganti R.JAK2 and STAT3 activation contributes to neuronal damage following transient focal cerebral ischemia〔J〕.J Neurochem,2006;98(2):1353-68.
