运动康复联合药物干预对血管性痴呆的治疗作用
2015-11-20牛文亚新乡医学院体育教学部河南新乡453003
牛文亚 (新乡医学院体育教学部,河南 新乡 453003)
研究发现,对血管性痴呆(VD)大鼠应用胰岛素增敏剂后可改善其认知功能〔1〕。临床上,糖尿病患者适当运动可改善病情,而康复训练对VD患者认知功能亦有一定改善,但其机制是否与改善胰岛素抵抗及增加胰岛素降解酶(IDE)活性有关尚不明确〔2〕。本实验对VD模型大鼠进行运动康复联合药物干预,通过检测大鼠认知能力改变情况及海马区神经元损伤变化,初步探讨运动康复联合药物治疗对VD的干预效果。
1 材料与方法
1.1材料 清洁级 SD雄性大鼠50只,4~5月龄,体质量180~220 g(河南省实验动物中心);许可证号为SYXK-豫-005-0012。动物房温度18℃ ~20℃,环境洁净度5 000~8 000级,相对湿度40% ~50%,换气次数20次/h,气流速度0.15~0.2 m/s,多级定向控制空气压差10% ~15%,自动定时器控制7:00~19:00为光照期、19:00~07:00为黑暗期,常规豚鼠饲料及二次净化水饲养。氢化麦角碱(天津华津制药有限公司)。电动转动仓、水迷宫,淮北正华生物仪器设备有限公司。
1.2方法
1.2.1VD模型制备 大鼠术前12 h禁食,4 h禁水。10%水合氯醛(0.33 ml/100 g)腹腔注射麻醉,保证手术期间有自主呼吸。仰卧固定,颈部去毛、强力碘消毒后沿颈正中切开,分离出双侧颈总动脉,并套以双重"0"号线,在双侧颈总动脉的近心端及远心端分别结扎,并从中间离断,以确保阻断动脉血流。注意术中无菌操作,手术切口给予庆大霉素注射液2 ml,缝合切口。手术后将动物送至通风良好的动物房饲养。
1.2.2实验设计与分组 ① 正常对照组:常规饲养;②VD模型组:采用双侧颈总动脉永久性结扎(2VO)制备大鼠VD模型;③药物治疗组:VD模型大鼠10只,每天清晨空腹予氢化麦角碱溶液灌胃给药(灌胃浓度 2 mg/kg,灌胃容量为10 ml/kg),连续灌胃8 w;④运动康复组:VD模型大鼠10只,每次在电动转动仓(转速20转/min,半径20 cm)里面运动20 min,3次/d,连续8 w;⑤ 运动康复联合药物治疗组:VD模型大鼠10只,每次在电动转动仓(转速20转/min,半径20 cm)里面运动20 min,3次/d;并且,每天清晨空腹予氢化麦角碱溶液灌胃(灌胃浓度2 mg/kg,灌胃容量为10 ml/kg),连续8 w。
1.2.3光镜下观察神经元形态 取甲醛固定组织块,石蜡包埋,制作3~4 μm厚切片,经HE染色后在光学显微镜下观察。
1.2.4电镜下观察神经元形态 取液氮冻存组织块,戊二醛固定,制作0.5 mm3电镜切片,经透射电镜下观察。
1.2.5免疫荧光显微镜下观察NOS在神经元胞质之内的表达取液氮冻存组织块3~4块,制作冰冻切片。分别用1∶800的钙离子一抗以及荧光标记的二抗孵育,荧光显微镜下观察。
1.3统计学方法 采用SPSS14.0软件,计量资料以s表示。组间比较用单因素方差分析,多重比较采用SNK-q法。
2结果
2.1大鼠跳台试验 运动康复组大鼠跳台试验潜伏期与VD模型组比较明显延长,运动康复联合药物组与药物治疗组比较有显著差异(P<0.05);运动康复组大鼠平均5 min错误次数与VD模型组比较明显减少,运动康复联合药物组与药物治疗组比较有显著差异(P<0.05)。见表1。
2.2大鼠避暗试验 运动康复组大鼠避暗试验潜伏期与VD模型组比较明显延长,运动康复联合药物组与药物治疗组比较有显著差异(P<0.05);运动康复组大鼠平均5 min错误次数与VD模型组比较明显减少,运动康复联合药物治疗组与药物治疗组比较有显著性差异(P<0.05)。见表2。
2.3大鼠水迷宫实验 运动康复组大鼠通过平台次数与VD模型组比较明显增加,运动康复联合药物组与药物治疗组比较有显著差异(P<0.05);各组织间的总游泳距离和平均游泳速度没有明显差异,见表3。

表1 各组大鼠跳台试验比较(x ± s,n=10)

表2 各组大鼠避暗试验(x ± s,n=10)

表3 各组大鼠水迷宫试验(x ± s,n=10)
2.4大鼠海马区神经元染色 模型组海马C1区三层锥体细胞排列紊乱;大脑额叶区及海马C1区皮层锥体细胞肿胀,并有炎细胞浸润,星形胶质细胞增生;部分锥体细胞胞体变小或呈三角形,顶树突延长,有核固缩和破裂现象,胞质呈均匀嗜伊红色;部分锥体细胞胞核变浅,基质疏松伴明显微空泡形成;血管周围有红细胞渗出,个别可见小血管增生。氢化麦角碱治疗组和运动康复组对VD均有明显的抑制作用,运动康复联合药物治疗组要优于药物治疗组和运动康复组。见图1。
2.5电镜观察大鼠海马区神经元 模型组血脑屏障内膜不光滑;神经元细胞皱缩、膜结构不清;胞核固缩,染色质聚集成团、边集,异染色质增多,核周可见高电子密度团块;高尔基体增多,线粒体肿胀,嵴融合并出现空泡变性。见图2。
2.6大鼠海马区钙离子荧光 模型组海马区神经元钙离子荧光明显增强,药物治疗组和运动康复组荧光减弱,运动康复联合药物治疗组荧光更加弱,见图3。
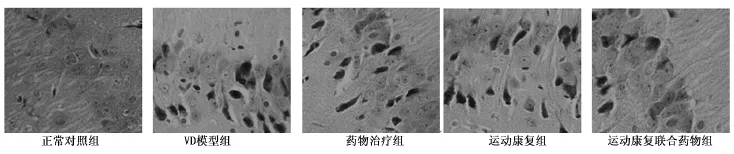
图1 各组大鼠海马区神经元染色(HE,×400)
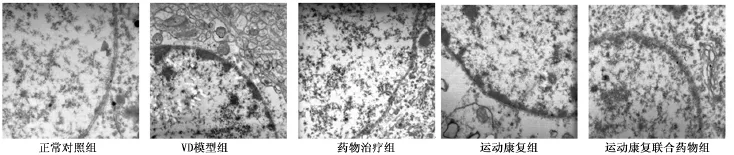
图2 电镜观察各组大鼠海马区神经元(×12 000)

图3 大鼠海马区钙离子荧光(×100)
3讨论
VD与AD不同,存在很大的异质性,VD是由于脑血管病引起的系列神经损伤和脑灌注不足,使疾病的发展变得更为复杂。关于血管性痴呆的诊断,应用比较广泛的是美国国立神经疾病与卒中研究所和瑞士神经科学研究国际协会(NINDAAIREN)的诊断标准。预防VD的主要策略是干预脑血管病的危险因素,包括高血压、糖尿病、高脂血症和心房颤动,治疗原发病,预防脑血管病的复发〔3〕。
目前,治疗VD的一线药物主要是乙酰胆碱酯酶(AchE)抑制剂,AchE抑制剂在缓解痴呆进展和行为障碍方面安全有效〔4〕。一直以来,对VD的治疗多采用治疗阿尔茨海默病(AD)的药物,如AchE抑制剂、胞磷胆碱、尼莫地平、加兰他敏等。早期的研究认为多奈哌齐对VD患者的认知功能和日常生活能力都有一定的改善〔5,6〕。最近的研究表明,尽早地采用多奈哌齐和加兰他敏治疗,VD患者的执行功能等认知功能均好于对照组,但总体功能和日常生活能力并无明显区别〔7~9〕。而长效胞磷胆碱治疗VD的研究未能发现其对患者的认知损害具有改善作用〔10〕。Kavirajan 等〔11〕认为,AchE 抑制剂只对 VD 患者的认知功能有轻微的益处,而对总体功能和日常生活能力都无明显改善,虽然皮质下血管病变使胆碱能纤维损伤为胆碱酯酶抑制剂治疗VD的有效性提供了合理的理论支持,但其中的一些有效性很可能与VD患者潜在的 AD病理改变有关,故不推荐常规使用这些药物治疗VD。Mobius等〔12〕研究证实盐酸美金刚可以改善VD患者的认知功能,特别是对小血管病变的 VD。Muresanu等〔13〕证实脑活素治疗对 VD的认知功能和脑电活动有明显的改善。有研究〔14〕指出,尼莫地平能够明显改善患者的认知功能,但也只是可能对VD的高危人群有保护作用。
临床上,康复训练在治疗VD虽取得一定疗效,但其机制尚不完全明确。康复训练可通过改善胰岛素抵抗以增强胰岛素信号通路〔15〕。胰岛素信号通路参与海马与皮层的记忆形成、突触可塑性,改善记忆等过程〔16〕。有研究表明,脑缺血性损伤后可出现机体对胰岛素敏感性及脑组织对糖利用率下降〔17,18〕。基于此,可以推测脑缺血时可能导致胰岛素抵抗。当机体出现胰岛素抵抗时,可因高胰岛素血症过多与IDE结合,而使其活性下降,进而可导致β-淀粉样多肽(Aβ)清除下降,并可能出现类似AD的病理过程。研究发现,对VD大鼠应用胰岛素增敏剂后可改善其认知功能。临床上,糖尿病患者适当运动可改善病情,而康复训练对VD患者认知功能亦有一定改善,但其机制是否与改善胰岛素抵抗及增加IDE活性有关,尚不明确。本实验结果提示运动康复联合药物治疗对VD的干预效果优于单独的药物治疗。
康复训练改善VD大鼠认知功能障碍可能与改善胰岛素抵抗并增加海马IDE的表达有关,改善胰岛素抵抗机制可能与康复训练激活PPARγ通路进而改善胰岛素抵抗有关〔19〕。本实验发现运动康复联合药物治疗对VD有明显的抑制作用,或能为了解VD发病机制以及通过运动治疗VD提供新的思路。
1 Storozheva ZI,Proshin AT,Sherstnev VV,et al.Dicholine salt of succinic acid,a neuronal insulin sensitizer,ameliorates cognitive deficits in rodent models of normal aging,chronic cerebral hypoperfusion,and beta-amyloid peptide-(25-35)-induced amnesia〔J〕.BMC Pharmacol,2008:8:1.
2 王红卫,叶 青,黄 雁,等.康复训练对血管性痴呆大鼠胰岛素抵抗及海马胰岛素降解酶的影响〔J〕.中南大学学报(医学版),2013;38(11):1167-71.
3 Cankurtaran M,Yavuz BB,Cankurtaran ES,et al.Risk factors and type of dcmcntia:vascular or Alzhcim〔J〕.Arch Gcrontol Gcriatr,2008;47(1):25-34.
4 Baskys A,Hcu AC.Vascular preaches and perspectives〔J〕.Clin Intcrv Aging,2007;2(3):327-35.
5 Wilkinson D,Doody R,Helme R,et al.Donepezil in vascular dementia:a randomized,placebo-controlled study〔J〕.Neurology,2003;61(4):479-86.
6 Black S,Roman GC,Geldmacher DS,et al.Efficacy and tolerability of donepezil in vascular dementia:positive results of 24-week,multicenter,international,randomized,placebo-controlled clinical trial〔J〕.Stroke,2003;34(10):2323-30.
7 Roman GC ,Salloway S,Black SE,et al.Randomized,placebo-controlled,clinical trial of donepezil in vascular dementia:differential effects by hippocampal size〔J〕.Stroke,2010;41(6):1213-21.
8 Wilkinson D,Roman G,salloway S,et al.The Long-term efficacy and tolerability of donepezil in patients with vascular dementia〔J〕.Int J Geriatr Psychiatry,2010;25(3):305-13.
9 Auchus AP,Brashear HR,Salloway S,et al.Galantamine treatment of vascular dementia:a randomized trial〔J〕.Neurology,2007;69(5):448-58.
10 Cohen RA,Browndyke JN,Moser DJ,et al.Long-term citicoline(cytidine diphosphate choline)use in patients with vascular dementia:neuroimaging and neuropsychological outcomes〔J〕.Cerebrovasc Dis,2003;16(3):199-204.
11 Kavirajan H,Schneider LS.Efficacy and adverse effects of cholonesterase inhibitors and memantine in vascular dementia:a meta-analysis of randomised controlled trials〔J〕.Lancet Neurol,2007;6(9):782-92.
12 Mobius HJ,Stoffler A.Memantine in vascular dementia〔J〕.Int Psychogeriatr,2003;15(S1):207-13.
13 Muresanu DF,Alvarez XA,Moessler H,et al.Persistence of the effects of cerebrolysin on cognition and qEEG slowing in vascular dementia patients:results of a 3-month extension study〔J〕.J Neurol Sci,2010;299(1/2):179-83.
14 梅正福.尼莫地平联合多奈哌齐治疗轻中度血管性痴呆的疗效观察〔J〕.海南医学院学报,2011;17(17):1322-3.
15 Liu X,Yuan H,Niu Y.The role of AMPK/mTOR/S6K1 signaling axis in mediating the physiological process of exercise-induced insulin sensitization in skeletal muscle of C57BL/6 mice〔J〕.Biochim Biophys Acta,2012;1822(11):1716-26.
16 Muller AP,Gnoatto J,Moreira JD,et al.Exercise increases insulin signaling in the hippocampus:physiological effects and pharmacological impact of intracerebroventricular insulin administration in mice〔J〕.Hippocampus,2011;21(10):1082-92.
17 Wang YY,Chen CJ,Lin SY,et al.Hyperglycemia is associated with enhanced gluconeogenesis in a rat model of permanent cerebral ischemia〔J〕.Mol Cell Endocrinol,2013;362(1/2):50-6.
18 Mori K,Yamamoto T,Nakao Y,et al.Novel neuroprotective effect of cisternal and intra-cerebral magnesium sulfate solution infusion on delayed cerebral death in rat hippocampal neurons after transcient global ischemia〔J〕.Brain Res,2012;1480(1):72-80.
19 Elmazar MM,El-Abhar HS,Schaalan MF,et al.Phytol/phytanic acid and insulin resistance:potential role of phytanic acid proven by docking simulation and modulation of biochemical alterations〔J〕.PLoS One,2013;8(1):e45638.
