藻有机物的消毒副产物生成特性研究
2015-11-19张强,刘燕
张 强,刘 燕
(1.湖北省环境科学研究院,武汉 430072;2.复旦大学 环境科学与工程系,上海 200433)
为了保障饮用水在流行病学上的可靠性与安全性,人们在饮用水处理过程中采用消毒的方式杀灭水源水中可能存在的各种病原微生物,以切断介水传染病的传播途径,预防传染病的发生或流行.然而在饮用水消毒过程中,消毒剂除了起灭活微生物的作用外,还能与原水中存在的天然有机物、有机污染物等发生反应生成消毒副产物(Disinfection By-products,DBPs),而大量的DBPs均被证实是致畸、致突以及致癌的[1-3].DBPs的诸多控制途径中,在消毒工艺前大幅削减原水中的DBPs前体物被认为是最为经济可行的方法[4].因此,为保障饮用水的化学性安全,控制饮用水DBPs的产生,针对DBPs前体物的研究就成为了学者们关注的焦点.
自七十年代中期发现DBPs以来,一般认为DBPs主要的前体物是水体中所含的天然有机物—腐殖质,即腐殖酸和富里酸.随着对DBPs及其前体物研究的不断深入,研究者们发现,天然水体中的藻类及其胞外有机物(Extracellular Organic Matters,EOMs)也是DBPs重要的前体物[5-6].研究表明,藻类及其EOMs的主要化学成分包括蛋白质、核酸、脂肪和多糖等[7-8].而目前国内外学者对于藻有机物及其各化学成分的DBPs生成特性研究尚不够全面和深入,大量相关研究仍主要针对三卤甲烷(Trihalomethans,THMs)类和卤乙酸(Haloacetic Acids,HAAs)类副产物[9-11],鲜有涉及到藻有机物的N-亚硝基二甲胺(N-nitrosodimethylamine,NDMA)生成特性的研究.而根据我们之前的研究可知[12],牛血清蛋白(Bovine Serum Albumin,BSA)、淀粉、DNA 和鱼油均可较好地模拟替代微生物细胞成分中的蛋白质、多糖、核酸和脂肪.因此,本研究拟采用腐殖酸为对照样,以铜绿微囊藻及其EOMs模拟代表通常存在于水源水体中的藻类及其EOMs,以BSA、淀粉、DNA 和鱼油分别模拟藻类及其EOMs主要组成成分中的蛋白质、多糖、核酸和脂肪,并分别全面考察这些化合物在消毒过程中的THMs,HAAs和NDMA等DBPs的生成情况.
1 材料与方法
1.1 铜绿微囊藻培养及EOMs提取
铜绿微囊藻购于中国科学院水生生物研究所的淡水藻种库.培养基选用BG-11,其具体营养成分及浓度详见表1.在温度25℃,pH=9.0条件下采用2 000lux的照明方式(12h 光照,12h 避光)培养[13].并通过光学显微镜进行日常计数以监测其生长情况.本研究中采用经长期培养后处于稳定期的铜绿微囊藻,其一半藻溶液直接用于总有机碳(Total Organic Carbon,TOC)分析和消毒实验;剩余一半藻溶液参照Chandrakanth等[14]的方法进行藻EOMs的提取,而后将提取的EOMs溶液用于TOC测定和消毒实验.

表1 BG-11培养基营养成分及浓度Tab.1 Nutrient concentrations in BG-11culture
1.2 模拟化合物配制
分别称量0.2g BSA(BR,国药集团化学试剂有限公司)、0.5g淀粉(AR,国药集团化学试剂有限公司)、0.25g腐殖酸(BR,上海巨枫化学科技有限公司)、0.5g DNA(BR,国药集团化学试剂有限公司)和1.5mL的鱼油(BR,上海金拾生物科技有限公司),然后用milli-Q 纯水溶解并分别定容至500mL,配制成各模拟化合物贮备液,静置过夜.淀粉和鱼油溶液在进行实验前用定量滤纸过滤.所有模拟化合物溶液均用0.2mol/L NaH2PO4和0.2mol/L NaOH 调节pH 至7.0,并于4℃下保存用于后续的TOC浓度测定和消毒试验.
1.3 消毒实验
分别准确量取20mL各种模拟化合物水样,即铜绿微囊藻溶液,EOMs,BSA,淀粉,腐殖酸,DNA 和鱼油于带聚四氟乙烯内衬垫的安培瓶中,然后向安培瓶内按c(Cl2)/c(TOC)=1投加NaClO 进行氯化消毒,以涡流震荡器快速混匀反应,于恒温培养箱内暗处接触反应24h,温度控制在25±1℃范围,待反应完全后用于THMs和HAAs分析.通过之前的研究可知[15-16],臭氧消毒是产生NDMA 的主要原因之一.此外,杨磊[17]还深入研究了臭氧消毒过程中NDMA 的生成机理,发现主要有甲醛催化亚硝化、N2O4亚硝化和经羟胺成肼等途径.因此,在本研究中用于NDMA 分析的样品在氯化反应前先按c(O3)/c(TOC)=0.1投加O3进行预臭氧,待反应2h后,再按与测定THMs和HAAs的样品完全相同的条件进行氯化消毒实验.
1.4 DBPs分析
本研究中进行定量分析的DBPs包括THMs,HAAs以及NDMA 三大类.其中,THMs类为CHCl3;HAAs类包括一氯乙酸(MCAA)、二氯乙酸(DCAA)和三氯乙酸(TCAA).参照美国APHA 和EPA 的标准方法[18-19],分别采用正戊烷和甲基叔丁基醚对氯化反应后的藻有机物样品中的THMs和HAAs进行萃取,然后将萃取出来的HAAs进行酯化反应.随后采用GC/ECD 对直接萃取的THMs和酯化反应后的HAAs样品进行定量分析,具体的气相色谱分析条件详见Zhang等[20]的研究论文中.采用反相高效液相色谱法测定NDMA,具体的液相色谱分析条件详见陈忠林等[21]的研究论文中.
采用全程空白、平行分析和加标回收实验对预处理和分析过程进行质量控制.全程空白即以milli-Q纯水为空白样品,与消毒后的模拟化合物样品一起完成全部预处理和分析流程.平行分析即制备3份相同的模拟化合物样,分别完成全部预处理和分析流程.加标回收实验即在样品预处理前分别加入一定量的CHCl3标液、HAAs混合标液以及NDMA 标液,与本底样品同时完成全部预处理和分析流程.
2 结果与讨论
2.1 分析方法的质量控制
在THMs、HAAs和NDMA 的分析过程中,所有的空白样品中均未检出目标DBPs.样品分析过程中,平行测定3次条件下,得到CHCl3测定结果的相对标准偏差(RSD)在5.3%~16.7%之间,MCAA 测定结果的RSD 在7.2%~17.7%之间,DCAA 测定结果的RSD 在2.3%~15.0%之间,TCAA 测定结果的RSD 在10.0%~18.4%之间,NDMA 测定结果的RSD 在2.7%~16.7%之间,表明采用的DBPs分析方法均具有良好的精密度.对7种模拟化合物样品进行加标回收实验,实验结果如表2所示,5种DBPs的回收率均在68.4%~101.2%之间,方法准确度高,可满足5种DBPs的分析要求.
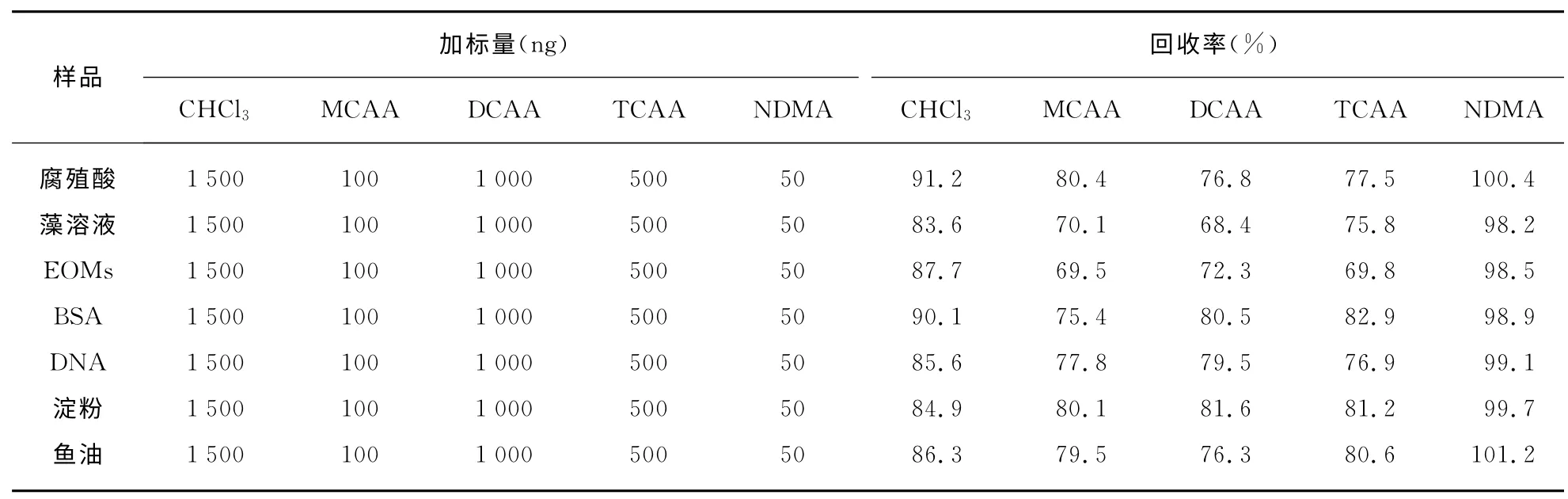
表2 5种DBPs的加标回收率结果Tab.2 The recoveries of 5species of DBPs
2.2 藻有机物的THMs生成特性
图1是7种有机物样品经氯化消毒后CHCl3的产生情况.由图1 可知,7 种有机物在单位TOC浓度条件下,鱼油的CHCl3生成势最大,为17.57μg/mg TOC,其后依次是藻溶液(11.55μg/mg TOC),EOMs(4.01 μg/mg TOC),BSA(3.60 μg/mg TOC),DNA(3.08μg/mg TOC)、腐殖酸(2.46μg/mg TOC)和淀粉(0.75μg/mg TOC).由此可推知,鱼油模拟代表的脂肪较BSA 模拟代表的蛋白质、淀粉模拟代表的多糖等其他藻有机物成分具有更高的CHCl3生成势,是更为有效的CHCl3前体物.Marhaba等[22]的研究也得出相似的结论,他们通过实验发现脂肪具有远高于多糖的THMs生成势.此外,从实验结果还可知,藻溶液具有近3倍于其EOMs的CHCl3生成势,由此可以推论得知,本实验中的铜绿微囊藻胞内有机物(IOMs)较其EOMs具有更高的CHCl3生成势.这与Graham 等[23]的研究结论相似,他们发现在相同实验条件下,藻细胞IOMs可产生2倍于其EOMs的THMs.而在本实验中,通常被认为是DBPs重要前体物的腐殖酸却表现出了较低的CHCl3生成势,远低于藻溶液,这与此前Hoehn等[5]研究结论是一致的.

图1 7种有机物的CHCl3生成情况Fig.1 CHCl3formation potential of seven organic matters
2.3 藻有机物的HAAs生成特性
图2是7种有机物样品经氯化消毒后HAAs的产生情况.由图2可知,在检出的3类氯代HAAs中,DCAA 是7 种有机物产生的主要HAAs种类,其产生量要远高于其他两类氯代HAAs.7种有机物在单位TOC浓度条件下,藻溶液的总HAAs生成势最大,为14.82μg/mg TOC,其后依次是BSA(10.60μg/mg TOC),DNA(5.70μg/mg TOC),EOMs(5.28μg/mg TOC)、鱼油(4.64μg/mg TOC)、腐殖酸(4.46μg/mg TOC)和淀粉(1.68μg/mg TOC).与THMs生成情况不同的是,鱼油并未表现出高的HAAs生成势,其HAAs生成势低于藻溶液、EOMs,BSA 和DNA,同时还远低于其自身的THMs生成势,表明脂肪类物质在本实验条件下更易于生成THMs而非HAAs.而与THMs生成情况相同的是,藻溶液产生了较其EOMs更高浓度的HAAs,表明铜绿微囊藻IOMs较其EOMs而言,不仅具有更高的THMs生成势,同时也具有更高的HAAs生成势.与THMs生成情况相似,腐殖酸和淀粉依旧表现出最低的总HAAs生成势,表明在本实验条件下腐殖酸和多糖类有机物并非有效的HAAs前体物.

图2 7种有机物的HAAs生成情况Fig.2 HAAs formation potential of seven organic matters
2.4 藻有机物的NDMA 生成特性
图3是7 种有机物样品经臭氧和氯化消毒后NDMA 的产生情况.由图3 可知,淀粉和鱼油经消毒反应后并未检出NDMA,究其原因认为与二者自身的化学结构与成分有关.通过我们之前的研究可知[15],NDMA 的产生源于含N 有机化合物与消毒剂的反应,目前主要的NDMA前体物基本被限定为二甲胺和含有二甲胺官能团的叔胺,而淀粉和鱼油的化学结构中并不含有二甲胺官能团或其他的含N 官能团,因此在二者的消毒样品中未能检出NDMA.由图3可知,其余5种有机物在单位TOC浓度条件下,腐殖酸的NDMA 生成势最大,为0.293μg/mg TOC,其后依次是藻溶液(0.216μg/mg TOC)、DNA(0.215μg/mg TOC)、BSA(0.212μg/mg TOC)和EOMs(0.054μg/mg TOC).腐殖酸、藻溶液、DNA 和BSA 均表现出了相对较高的NDMA 生成势,而毒理学研究表明NDMA 产生的慢性毒性作用可引起肝癌、肺癌及神经系统的损伤,其致癌风险性要远高于CHCl3等卤代DBPs[15].因此,在采用O3或氯胺消毒工艺的水厂中尤其要注意对原水中腐殖酸和各种藻有机物的去除,以防消毒过程中NDMA 的大量产生.
与THMs和HAAs生成情况相同的是,藻溶液表现出了较其EOMs更高的NDMA 生成势,表明铜绿微囊藻IOMs是较其EOMs更为有效的THMs、HAAs和NDMA 前体物.因此,为了有效控制饮用水的DBPs健康风险,在处理含藻原水时应注意采取合适的预处理工艺,在有效去除水体中藻类物质的同时还要避免对藻细胞的破坏,防止藻细胞内包括蛋白质、核酸等在内的有机物泄漏,而导致水体中藻类DBPs前体物的激增,致使后续消毒过程中各类DBPs的大量产生.
(1)本研究中采用的铜绿微囊藻其IOMs较其EOMs而言,具有更高的THMs、HAAs和NDMA 生成势,因此在处理含藻原水时应注意采取合适的预处理工艺将藻细胞完整地去除,以防IOMs外泄导致DBPs前体物的大量增加.
(2)腐殖酸尽管表现出相对较低的THMs和HAAs生成势,但是其具有较其他藻有机物更高的NDMA 生成势,鉴于NDMA 的高致癌风险,在采用O3或氯胺消毒时应尤其注意在消毒工艺前对腐殖酸进行有效去除,以降低NDMA 生成风险.
(3)脂肪类物质具有较高的THMs生成势,蛋白质类物质具有较高的HAAs和NDMA 生成势,核酸类物质也具有较高的NDMA 生成势.因此,在水处理过程中也需要注意对这些已存在于原水中的藻有机物进行有效去除.

图3 7种有机物的NDMA 生成情况Fig.3 NDMA formation potential of seven organic matters
[1]Fenster L,Waller K,Windham G,et al.Trihalomethane levels in home tap water and semen quality[J].Epidemiology,2003,14(6):650-658.
[2]Windham G C,Waller K,Anderson M,et al.Chlorination by-products in drinking water and menstrual cycle function[J].Environmental Health Perspectives,2003,111(7):935-941.
[3]Rodriguez M J,Serodes J,Danielle R.Formation and fate of haloacetic acids(HAAs)within the water treatment plant[J].Water Research,2007,41(18):4222-4232.
[4]张 强,刘 燕,魏源源,等.饮用水消毒预处理工艺研究进展[J].化学通报,2010,73(11):980-985.
[5]Hoehn R C,Barnes D B,Thompson B C,et al.Algae as sources of trihalomethane precursors[J].Journal of the American Water Works Association,1980,72(6):344-350.
[6]Wei Y Y,Liu Y,Zhang Y,et al.Influence of soluble microbial products(SMP)on wastewater disinfection byproducts:trihalomethanes and haloacetic acids species from the chlorination of SMP[J].Environmental Science and Pollution Research,2011,18(1):46-50.
[7]Hong H C,Mazumder A,Wong M H,et al.Yield of trihalomethanes and haloacetic acids upon chlorinating algal cells,and its prediction via algal cellular biochemical composition[J].Water Research,2008,42(20):4941-4948.
[8]Huang W J,Cheng Y L,Cheng B L.Ozonation byproducts and determination of extracellular release in freshwater algae and cyanobacteria[J].Environmental Engineering Science,2008,25(2):139-151.
[9]Plummer J D,Edzwald J K.Effect of ozone on algae as precursors for trihalomethane and haloacetic acid production[J].Environmental Science &Technology,2001,35(18):3661-3668.
[10]方晶云,马 军,王立宁,等.臭氧预氧化对藻细胞及胞外分泌物消毒副产物生成势的影响[J].环境科学,2006,27(6):1127-1132.
[11]Paim A P,Souza J B,Adorno M A,et al.Monitoring the trihalomethanes present in water after treatment with chlorine under laboratory condition[J].Environmental Monitoring and Assessment,2007,125(1-3):265-270.
[12]Zhang Q,Liu B,Liu Y.Effect of ozone on algal organic matters as precursors for disinfection byproducts production[J].Environmental Technology,2014,35(13-16):1753-1759.
[13]Dai R,Liu H,Qu J,et al.Effects of amino acids on microcystin production of the Microcystis aeruginosa[J].Journal of Hazardous Materterials,2009,161(2-3):730-736.
[14]Chandrakanth M S,Krishnan S,Amy G L.Interactions between ozone,AOM,and particles in water treatment[J].Journal of Environmental Engineering,1996,122(6):459-468.
[15]覃 操,徐 斌,夏圣骥,等.饮用水处理工艺中NDMA 的生成与去除特性研究[J].中国给水排水,2010,26(21):16-20.
[16]张 强,刘 燕,张 云,等.饮用水含氮消毒副产物N-亚硝基二甲胺前体物研究进展[J].化学通报,2011,74(9):817-821.
[17]杨 磊.水中亚硝胺类消毒副产物生成规律及其前质去除方法研究[D].哈尔滨:哈尔滨工业大学,2010,67-77.
[18]APHA/AWWA/WEF.Standard methods for the examination of water and wastewater [M].Washington,D C:American Public Health Association/American Water Works Association/Water Environment Federation,1998.
[19]USEPA.Determination of haloacetic acids and dalapon in drinking water by liquid-liquid microextraction derivatization,and gas chromatography with electron capture detection[S].Washington,D C:Technical Support Center Office of Ground Water and Drinking water,2003,EPA 815-B-03-002.
[20]Zhang Q,Liu Y,Wei Y Y,et al.Removal of viruses and disinfection by-products(DBPs)at two drinking water treatment plants in southern China[J].Desalination and Water Treatment,2012,48(1-3):221-231.
[21]陈忠林,徐冰冰,齐 虹,等.高效液相色谱测定水中痕量亚硝基二甲胺[J].中国给水排水,2007,23(8):84-87.
[22]Marhaba T F,Van D.The variation of mass and disinfection by-product formation potential of dissolved organic matter fractions along a conventional surface water treatment plant[J].Journal of Hazardous Materterials,2000,74(3):133-147.
[23]Graham N J D,Wardlaw V E,Perry R,et al.The significance of algae as trihalomethane precursors[J].Water Science &Technology,1998,37(2):83-89.
