rMBP-NAP依赖IL-12/IL-23轴对肝癌H22荷瘤小鼠的抑瘤作用研究
2015-11-18王小龙康巧珍门颖丽黄夏冰张亚萌刘鑫
王小龙 康巧珍 门颖丽 黄夏冰 张亚萌 刘鑫
(郑州大学生命科学学院 河南郑州 450001)
IL-12是一种异源二聚体型促炎性细胞因子,主要由固有免疫细胞如树突状细胞、单核细胞、巨噬细胞、中性粒细胞等表达[1]。IL-12在连接固有免疫和获得性免疫中起到了重要作用,并在抗肿瘤免疫研究中受到重视。通过IL-12蛋白药物或者IL-12基因药物处理荷瘤小鼠发现,IL-12能显著性抑制肿瘤的生长,其抗肿瘤作用依赖于诱导IFN-γ的高表达[2]。IL-23是同属于IL-12家族中的另一个细胞因子,其与IL-12具有相似的结构,两者具有相同的p40亚基[3]。近年来,随着对IL-23生物学功能研究的深入,IL-23在抗肿瘤中的作用也逐渐受到重视。IL-23能够引起CD8+T在肿瘤组织中的大量浸润,发挥抗肿瘤作用,IL-23的抗肿瘤作用的发挥与细胞因子IFN - γ 表达量增加正相关[4-5]。
幽门螺杆菌中性粒细胞激活蛋白(Helicobacter pylori neutrophil-activating protein,HP-NAP)是幽门螺杆菌重要的毒力因子,同时HP-NAP也是一种TLR2激动剂,能够激活中性粒细胞和单核细胞中的TLR2信号通路,并促进其分泌IL-12和IL-23细胞因子。同时,经HP-NAP刺激的中性粒细胞和单核细胞与T细胞共培养后,能够增强T细胞分泌IFN-γ,即促进Th1型免疫反应[6]。有研究证实,HP-NAP具有抑制小鼠H22荷瘤模型肿瘤生长的作用,其中伴随着分泌IFN-γ的T细胞数目的增加[7-8]。结果提示,IFN-γ在HP-NAP发挥免疫调节功能乃至发挥抗肿瘤作用的过程中具有重要作用。而IL-12/IL-23在IFN-γ介导的HP-NAP诱导的抗肿瘤作用中的角色有待于进一步的研究。
本实验室通过分子克隆的方法构建HP-NAP的原核表达载体,成功纯化得到了重组中性粒细胞激活蛋白rMBP-NAP,并在小鼠H22肝癌肿瘤模型中对其抗肿瘤作用进行了评估。进一步利用抗体分别阻断IL-12和IL-23,检测IFN-γ的表达,探究rMBPNAP依赖于IL-12/IL-23的抗肿瘤作用机制。
1 材料与方法
1.1 材料
1.1.1 试剂 rMBP-NAP蛋白由本实验室通过Amylose Resin(nEB,England)亲和层析纯化获得;BCA蛋白定量试剂盒购于北京索莱宝生物科技有限公司;RPMI-1640培养基购于北京索莱宝生物科技有限公司;胎牛血清购于浙江天杭生物科技有限公司;IFN-γ ELISA试剂盒购于Biolegend;抗体IgG Control、小鼠anti-IL-12抗体及小鼠anti-IL-23p19抗体购于美国R&D systems;丝裂霉素 C(MMC)购于Genview。
1.1.2 实验动物 SPF级雌性6~8周 BABL/c小鼠,购于北京维通利华实验动物技术有限公司,合格证号:SCXK(京)2012-0001。饲养于河南省医药科学研究院SPF级动物室,试验过程中动物自由饮食饮水,光照周期为12/12 h。
1.1.3 肿瘤细胞 H22小鼠肝癌细胞系,由河南省医药科学研究院惠赠,培养并保存于本实验室。
1.2 方法
1.2.1 H22荷瘤小鼠模型建立及治疗 将2×106个H22细胞以0.2 ml体积量皮下注射BABL/c小鼠左前肢腋下,荷瘤后第2天将小鼠随机分为两组:PBS组和rMBP-NAP组。PBS组每只注射0.2 ml PBS,rMBPNAP 组每只注射0.2 ml的50 μg rMBP -NAP,连续治疗7 d,期间每天称量小鼠体质量并用游标卡尺测量肿瘤的长(L)和宽(D),利用公式V=0.5×L×D2计算肿瘤体积。
1.2.2 丝裂霉素C处理H22肿瘤细胞 将H22肿瘤细胞与丝裂霉素C(终浓度为10 μg/ml)于37℃,5%CO2培养箱中共培养。2 h后,移去培养基,PBS洗3次,加入新鲜RPMI-1640培养基,继续培养。
1.2.3 ELISA 检测 IL-12/IL-23抗体阻断后脾细胞中的IFN-γ 荷瘤小鼠模型建立如1.2.1所述,模型期间,荷瘤小鼠不进行给药处理,荷瘤后第8天即处死小鼠,无菌条件下取出脾脏,制成单个脾细胞悬液,调整细胞浓度为1×107个/ml。以2×106个/孔铺于两个24孔板中,同时按10∶1的比例加入相应数量MMC处理的H22肿瘤细胞。向上述脾细胞中每孔同时加入100 μg/ml rMBP-NAP和抗体 anti-IL-12(10 μg/ml)/anti- IL -23(500 ng/ml)/Goat IgG control,即分为4组,IL-12阻断组,IL-23阻断组,IgG同型对照组以及空白对照组(PBS代替rMBP-NAP且无抗体处理),分别于抗体加入后3 d和7 d(于第3天每孔加入100 U/ml的重组人IL-2继续培养),收集培养上清,ELISA法检测培养上清中的IFN-γ。
1.3 统计学处理 采用GraphPad Prism 5.0软件进行分析,定量资料采用均数±标准差(±s)表示,两组间比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 rMBP-NAP抑制肝癌H22荷瘤小鼠肿瘤生长 荷瘤3 d后,rMBP-NAP组和PBS组小鼠均出现肿瘤,但rMBP-NAP组肿瘤体积小于PBS组。荷瘤后4~7 d,相对于PBS组,rMBP-NAP组小鼠肿瘤体积增长显著减缓(P<0.05)。第8天牺牲小鼠,称量并比较瘤重,结果显示rMBP-NAP组肿瘤质量显著低于PBS组(P<0.01)。见图1。
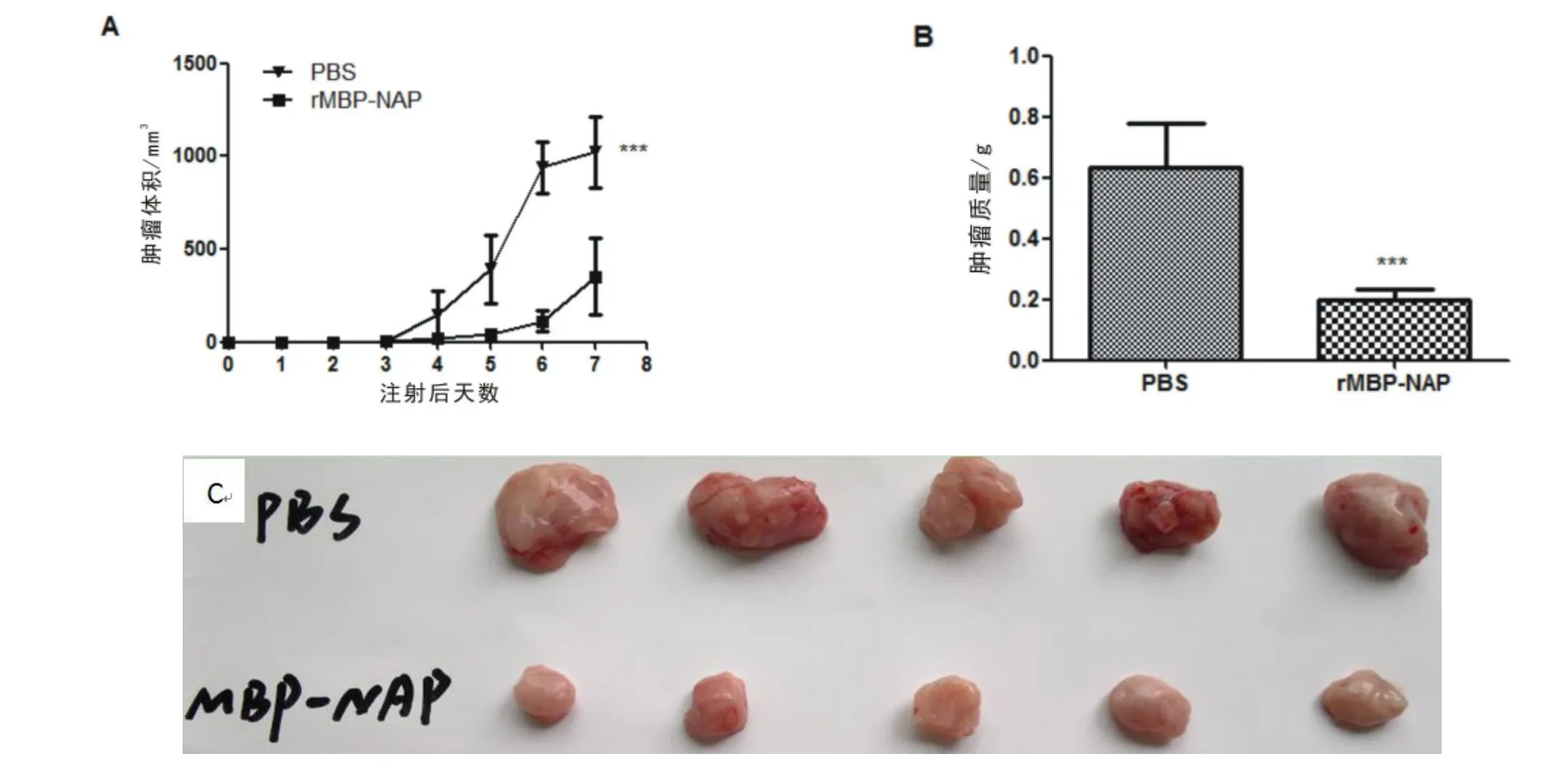
图1 rMBP-NAP抑制H22荷瘤小鼠肿瘤生长
2.2 IL-12和IL-23抗体阻断显著降低IFN-γ的分泌 培养3 d后,对各组脾细胞培养上清中的IFN-γ表达量进行检测,结果显示,与空白对照组相比,rMBP-NAP促进脾细胞分泌大量的IFN-γ。加入anti-IL-12抗体,rMBP-NAP不能有效诱导IFN-γ分泌,低于检测下限。加入 anti-IL-23抗体后,IFN-γ浓度为500 pg/ml,与同型对照抗体组相比,呈极显著性下降。培养7 d后,收集上清并检测IFN-γ表达量,anti-IL-12抗体组(20 pg/ml)和anti-IL-23抗体组(1 000 μg/ml)IFN-γ的表达量仍显著低于同型对照抗体组(1 600 μg/ml)。见图2。
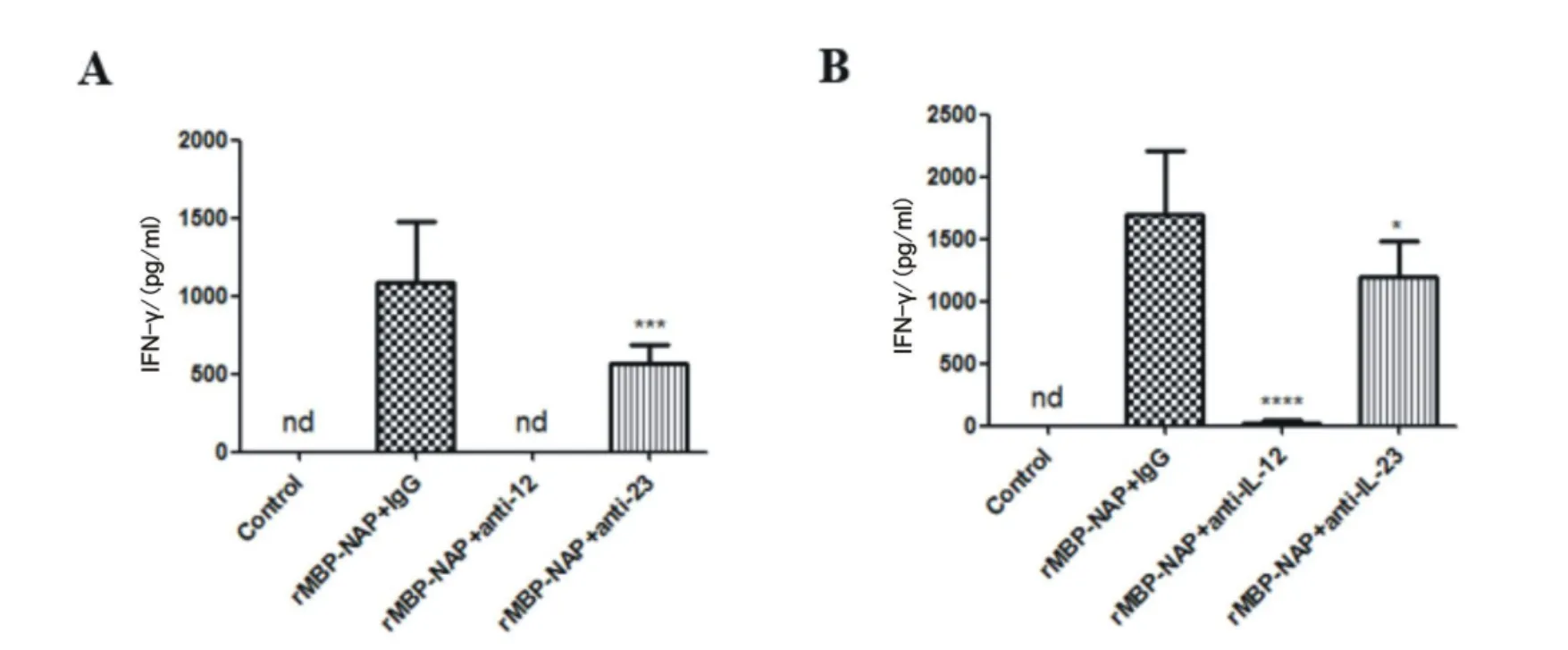
图2 IL-12和IL-23抗体阻断对IFN-γ表达的影响
3 讨论
IL-12是一种促炎性细胞因子,IL-12能够直接作用于T细胞和NK细胞等,增强Th1型免疫反应、细胞毒性T细胞(CTL)反应及NK杀伤作用,对于肿瘤细胞的清除具有重要作用,因此,IL-12被普遍认为是一种强有力的抗肿瘤相关细胞因子。IL-23同属于IL-12家族成员,与IL-12表现出一定的功能相似性,IL-23在抗肿瘤免疫中的作用也逐渐受到人们的关注[9]。HP-NAP被证实能够有效地诱导中性粒细胞和单核细胞表达IL-12和IL-23细胞因子,具有抗肿瘤作用的潜力。实验结果显示,rMBP-NAP能够显著抑制H22荷瘤小鼠肿瘤的生长,瘤体积明显减小,瘤重明显减轻。荷瘤小鼠脾细胞体外以rMBPNAP刺激且分别用IL-12或IL-23抗体阻断。3 d后收集脾细胞培养上清,anti-12抗体处理组检测不到IFN-γ表达,anti-23抗体处理组IFN-γ浓度显著下降(500 pg/ml)。处理7 d后,anti-12抗体组和anti-23与同型对照组相比差异有统计学意义。结果提示,IFN-γ介导的rMBP-NAP的抗肿瘤作用主要依赖于IL-12,且IL-23与IL-12协同作用进一步提升IFN-γ的表达,起到增强抗肿瘤的作用。已有研究证实,在小鼠肿瘤模型中,IL-12和IL-23联合作用能够起到更好的抗肿瘤效果。加入IL-23能够显著增强IL-12的抗肿瘤作用。而IL-23发挥抗肿瘤作用,依赖于机体内源性IL-12[10]。这提示IL-12和IL-23可能通过相互影响、相互促进的方式协同促进IFN-γ表达,从而发挥抗肿瘤作用。本研究对rMBP-NAP在H22荷瘤小鼠模型中的抗肿瘤作用及IL-12/IL-23轴在其中扮演的角色进行了初步的研究,为rMBP-NAP的抗肿瘤治疗应用提供了一定的理论基础。
[1]Nizzoli G,Krietsch J,Weick A,et al.Human CD1c+dendritic cells secrete high levels of IL-12 and potently prime cytotoxic T-cell responses[J].Blood,2013,122(6):932 -942.
[2]Kerkar S P,Goldszmid R S,Muranski P,et al.IL -12 triggers a programmatic change in dysfunctional myeloid-derived cells within mouse tumors[J].J Clin Invest,2011,121(12):4746 -4757.
[3]Ngiow S F,Teng M W,Smyth M J.A balance of interleukin -12 and-23 in cancer[J].Trends Immunol,2013,34(1):548 - 555.
[4]Li J,Zhang L,Zhang J,et al.Interleukin 23 regulates proliferation of lung cancer cells in a concentration-dependent way in association with the interleukin - 23 receptor[J].Carcinogenesis,2013,34(3):658-666.
[5]Reay J,Gambotto A,Robbins P D.The antitumor effects of adenoviralmediated,intratumoral delivery of interleukin 23 require endogenous IL -12[J].Cancer Gene Ther,2012,19(2):135 -143.
[6]de Bernard M,D’Elios M M.The immune modulating activity of the Helicobacter pylori HP - NAP:Friend or foe?[J].Toxicon,2010,56(7):1186-1192.
[7]Codolo G,Fassan M,Munari F,et al.HP - NAP inhibits the growth of bladder cancer in mice by activating a cytotoxic Th1 response[J].Cancer Immunol Immunother,2012,61(1):31 -40.
[8]Ramachandran M,Yu D,Wanders A,et al.An infection - enhanced oncolytic adenovirus secreting H.pylori neutrophil- activating protein with therapeutic effects on neuroendocrine tumors[J].Mol Ther,2013,21(11):2008 -2818.
[9]Vignali D A,Kuchroo V K.IL -12 family cytokines:immunological playmakers[J].Nat Immunol,2012,13(8):722 -728.
[10]Choi I K,Li Y,Oh E,et al.Oncolytic adenovirus expressing IL -23 and p35 elicits IFN-gamma- and TNF-alpha-co-producing T cellmediated antitumor immunity[J].PLoS One,2013,8(7):e67512.
