海马神经细胞网络传感器及其记录5-HT对网络活动的作用*
2015-11-18胡靓,秦臻,王琴,李蓉,王平*
胡 靓,秦 臻,王 琴,李 蓉,王 平*
(1.浙江大学生物传感器国家专业实验室,生物医学工程教育部重点实验室,生物医学工程与仪器科学学院,杭州 310027;2.中科院传感技术国家重点实验室,上海 200050)
海马神经细胞网络传感器及其记录5-HT对网络活动的作用*
胡 靓1,2,秦 臻1,王 琴1,李 蓉1,王 平1,2*
(1.浙江大学生物传感器国家专业实验室,生物医学工程教育部重点实验室,生物医学工程与仪器科学学院,杭州 310027;2.中科院传感技术国家重点实验室,上海 200050)
海马神经网络活动在调节记忆和学习等行为中具有重要作用,而五羟色胺是调节此类行为的重要神经递质。目前,某些研究手段揭示了5-HT对海马神经元活动的作用,但是这些手段并没有直观展示海马神经元网络的电生理活动。因此,为了研究5-HT在体外海马神经元网络活动中的作用,本实验建立了微电极阵列(Microelectrode Array,MEA)的检测平台。利用60通道MEA芯片,可以实时无损地记录5-HT作用前后的多位点信号,实验结果证明5-HT对海马神经元的动作电位有抑制作用,但是对低频振荡没有明显变化。该实验表明,这种海马神经元网络传感器可以对神经元进行无损、长时间的记录。上述研究结果表明,这种新的细胞网络传感器有望成为神经元网络活动研究中的一种重要手段。
生物传感器;海马神经元网络;微电极阵列(MEA);神经元网络活动;5羟色胺;网络振荡
海马神经元的生理活动在调节记忆和学习等行为上具有重要作用。研究表明,海马神经元活动可以被某些神经递质兴奋或者抑制,进而产生不同的电生理发放模式。这些不同的发放模式可能代表大脑功能的不同处理阶段[1-3]。还有研究表明,异常神经网络活动如癫痫样放电可能造成海马神经网络功能障碍,进而导致如Alzheimer症等记忆受损症[4-5]。因此非常有必要研究海马神经网络活动来了解更多大脑工作的方式。
另外,在上个世纪90年代,海马神经元网络作为传感器敏感单元,已经被体外培养在微电极阵列表面来检测一些毒素及化学物质。通过改变自发活动模式,神经元网络能对大量具有神经活性的物质进行响应,且具有相当高的灵敏度[6-8]。研究结果表明,体外培养的神经元网络可以保持电生理和药理活性长达9个月,有利于进行长时程检测。以神经元网络作为敏感单元的生物传感器在对药物,毒素和气味物质的检测中具有良好表现。但是,以上研究中通常采用的是海马组织或者神经元,对其所检测的物质的信号传导机理和编码缺乏认识和研究,其网络的特异性和功能性应用方面的研究也比较少。因此本实验研究了体外神经元网络中的信号传导。
在哺乳动物神经系统中,5-HT是一种广泛分布的神经递质,参与调节人类情感,摄食等行为。5-HT受体主要分布于脑区,尤其是海马区,皮层和基底神经节等区域[9]。几乎所有的5-HT受体亚基都在海马区表达,5-HT受体在海马神经元中对神经元活动具有抑制性调节作用[10-11],5-HT受体对海马神经网络振荡也有调节作用[12-13]。因此不同于传统的在体记录方式[14],本实验采用体外多点记录方式,对体外培养的海马神经元网络胞外电生理活动进行。该方法降低了海马神经元网络的复杂度,为研究细胞间信号传播提供了简便的检测方法。

图1 MEA芯片
本研究采用微阵列电极技术,建立了一个胞外电生理记录平台。这种方法可以实时无损地记录神经元网络多点信息,为研究体外神经元网络活动提供了大量信息。同时,单个神经元的电生理活动也可以同时采集。在以往的研究中,我们已经将这种技术应用于生物组织例如嗅黏膜或嗅球切片的电生理记录[15-16]。这种基于生物组织的复合传感方式对刺激具有良好的灵敏度和特异性。而本实验中,采用体外培养海马神经元网络的方式,相较于生物组织切片而言,降低了网络的复杂度,便于实验观察和分析信号。
1 实验方法
1.1 MEA芯片加工
采用标准微加工技术制备MEA芯片。首先,将一层30 nm钛层和一层300 nm金层分别沉积到玻璃基底上,作为粘附层和电极层。采用光蚀刻技术蚀刻出电极位点和引线的布局。除去光刻胶后沉积一层1 μm Si3N4作为钝化层,再用KOH暴露出电极和焊盘。将用金线将芯片上的焊盘和PCB上的接口连接,用环氧胶将细胞培养腔固定在芯片上(图1(a))。
如图1(b)所示,MEA芯片为8×8阵列排布。单个电极大小为20 μm,电极间距为150 μm。60个电极作为记录电极。实验前对电极表面电镀铂黑,采用交流阻抗谱评估铂黑的效果。结果表明,电镀铂黑明显降低低频段阻抗(图1(c))。该结果与基于MONTECARLO模型的结果一致,证明纳米颗粒的沉积具有降低电极阻抗的作用,有利于提高性噪比[17]。
1.2 海马神经元网络的培养
选取出生1 d~2 d的SD乳鼠,断头取脑。取海马组织剪碎后置于含有3 g/L灭火牛血清的HBSS溶液中,用0.25%胰酶消化15 min。用200孔/inch的细胞筛将分离的细胞加入含有10%灭火牛血清的DMEM制成悬浮液,随后加入MEA培养腔中进行培养。细胞接种密度为104个/cm2。培养液每两天更换一次,七天后初步形成海马神经元网络,便可以进行实验。
1.3 MEA检测神经元网络电位
MEA检测海马神经元电位的原理图如图2所示。采用MEA-1060(Multi Channels Systems,Germany)采集放大系统进行实时记录神经元电位信号。采样率为10 kHz,Ag/AgCl电极作为参考电极。首先,记录磷酸盐酸缓冲液(PBS)中海马神经元网络的自发放电位10 min。然后移除PBS溶液,加入100 μM的5-HT溶液,检测海马神经元网络在5-HT刺激下的响应。最后,洗脱5-HT溶液,换成PBS环境下检测神经元网络的发放。
1.4 数据处理
采用MC-Rack软件记录采集并放大后的60通道海马神经元网络发放电位。采用Butterworth带通滤波器对原始信号进行滤波(100 Hz~300 Hz),观察动作电位发放情况。对每个试验阶段(自发状态,5-HT处理,5-HT洗脱)下60通道中记录到神经点发放活动的通道数进行统计,作为活跃通道数,来评价5-HT的抑制作用。采用Clampfit对3个实验阶段的原始信号进行频谱分析,观察低频状态下的网络振荡状态。

图2 采用多位点电生理检测平台记录5-HT对海马神经元网络活动的原理图。
2 实验结果
2.1 海马神经元网络的培养
图3为在MEA芯片表面培养6 d所形成的神经元网络。海马神经元和胶质细胞能从轴突这个特征中很好的区分开来。海马神经元具有两极或三极的形状,并和周围的神经元通过突触相连接。而胶质细胞作为支持细胞,没有轴突的形成。

图3 海马神经元网络和胶质细胞
2.2 海马神经元网络自发活动的特点
首先,根据电极的排布位置和实验记录的数据,得出了自发状态下神经冲动传导速度。通过发放模式特征和位置,同一个网络中的不同神经元的信号被归类出来;统计相邻电极上记录到信号的延时,除以电极间的距离,得到神经冲动传导的速度。自发状态下,神经冲动传播速度大约为1.4 cm/s,而在无髓鞘神经纤维上神经冲动的传播速率大约为20 cm/s~35 cm/s[18]。这主要是由于体外培养的神经元网络在生理活性较低造成。且神经电兴奋在突触间传播速度比在神经纤维上的传导速度更低。其次,我们分析了自发状态下海马神经元网络的振荡特性。在实验中可以观察到大量的网络同步振荡活动(图4(a)。通过频谱分析发现主要为theta、alpha、beta振荡(图5)。
2.3 5-HT对海马神经元网络的抑制效应
为了研究5-HT对海马神经元网络的作用,实验记录了网络对100 μM 5-HT的响应。在检测到自发响应的海马神经元网络中加入5-HT进行刺激,神经元网络活动(5次)表现出几乎完全被抑制的现象。而将5-HT洗脱后,神经元的动作电位活动又迅速恢复(图4(a)。活跃通道数统计也证明了100 μM 5-HT的抑制作用(图4(b)。

图4 海马神经元网络活动在5-HT作用下的响应
高频电生理信号体现了单个神经元的动作电位发放,而低频的神经网络振荡则体现了神经元之间的相互作用。神经振荡是中枢神经系统中存在的一种节律性,本实验中的低频神经振荡属于局部场电位,是由大量神经元同步发放引起的振荡活动。图5中频谱分析结果显示,神经网络的振荡频率主要成分在theta和beta频段,且在5-HT刺激前后振荡频率并没有明显改变。
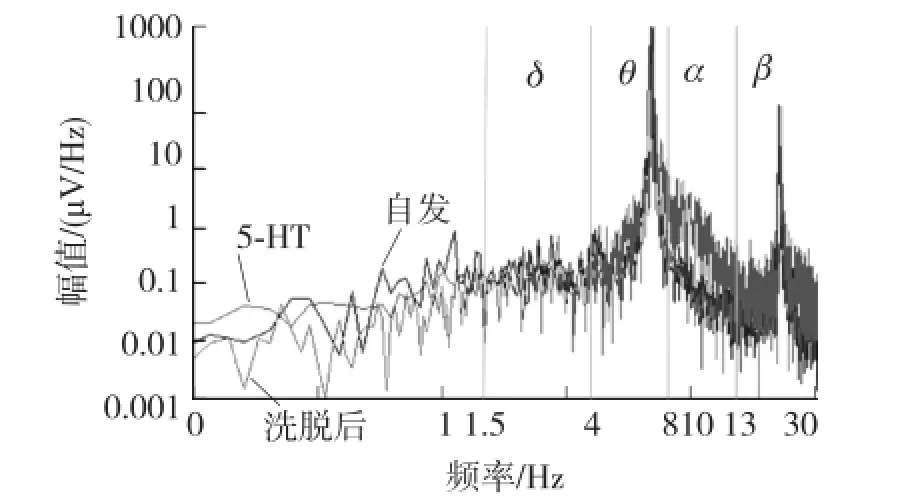
图5 低频网络振荡频率在5-HT作用前后无明显变化
3 讨论
本文通过结合体外培养海马神经元网络,建立了一个简化的海马神经元网络,并分析了海马神经元网络响应信号的时域和空间特点。研究表明单个海马神经元活动在不同频段振荡表明了神经元的一种内在能力,这种能力是协调网络活动的基础。在本研究中,单个海马神经元的自发放频率远远高于在体检测的神经元发放频率(低于1 spike/s)[19]。这种显著差别可能来源于两种检测方式的差别。在体检测中,微电极阵列植入海马可能会引起神经组织的损伤,导致神经元活动的减弱。而离体的MEA芯片对神经元是无损的,可以进行长时程检测。另外,贴附在MEA芯片表面的神经元比在体情况下神经元和电极的接触更为紧密。体外培养的神经元网络可能比在体的神经组织活动更为活跃。
实验中海马神经元的动作电位被5-HT几乎完全抑制,这也与以往报道的结果一致。这个结果和文献报道一致,即5-HT1A受体激动剂和5-HT自身都能抑制大鼠海马区的神经元活动。这种抑制效应可以通过选择性或非选择性的5-HT1A受体拮抗剂阻断。研究报道,5-HT能诱导海马神经元超极化,并通过激活钾通道来增加抑制性突触后电位[20]。同时,5-HT通过与5-HT1A受体作用,能激发GABA能中间神经元,增加抑制性突出后电位的形成,从而降低神经元的发放活动[21]。
实验中海马神经元网络出现了同步振荡的电生理活动。同步振荡是一种最基本的网络活动,海马神经元网络的一个重要特征就是能产生有节律性的振动。本实验中,theta,beta振荡共同存在于海马神经网络振荡中。同步的theta/beta网络振荡可能表明了未成熟的脑皮层形成早期功能性网络的内源性能力。海马神经网络的振荡频率范围可能对海马神经信号的编码解码研究提供信息。5-HT对调节theta节律具有重要作用,而本实验中直接对海马神经元施加5-HT刺激,对并没有明显改变海马神经网络的振荡频率。目前具体的机制并不清楚,但是有多种可能的原因。首先,实验中直接施加5-HT刺激于体外培养的神经元网络,相比于以往的研究采用腹膜下注射等系统性输入方式,也许缺乏某些能和5-HT作用来调节网络振荡的效应器。5-HT调节在体海马theta振荡主要是由于调节GABA能和胆碱能神经元的抑制/兴奋平衡来影响网络振荡。而体外培养的神经元网络振荡可能缺乏与这些中间神经元的相互作用。另外,实验中采用的体外培养的神经元网络还处于网络形成初期(7 d左右),神经元网络的功能性连接可能还不成熟,因此对5-HT也无法响应。
4 结论
通过培养海马通路神经元,构建了一种新的海马细胞神经元网络传感器。实验结果表明,多点记录的MEA传感器可以有效记录海马神经元网络的胞外电位和振荡活动,具有无损和长时程连续测量的优势。另外,实验结果证明,5-HT能抑制海马神经元动作电位的方法,但是对体外培养的初级海马神经元网络振荡频率没有明显变化。在后续的研究中,我们将探索如何将海马神经元更好地贴附于微电极表面上,以提高传感器的稳定性,灵敏度和可重复性。在实验室同事以前的工作中,采用共自组装单体层(SAM)技术来修饰细胞传感器的电极表面,提高了传感器的生物相容性,并成功将细胞固定在目标位置[22]。另外,对于海马神经元的生理特性,还可以采用其他手段进行多参数观测,如荧光探针技术[23],电化学阻抗[24],膜片钳传感器[25]等。
[1] Izquierdo I,Medina J H.Memory Formation:The Sequence of Biochemical Events in the Hippocampus and Its Connection to Activity in other Brain Structures[J].Neurobiology of Learning and Memory,1997,68(3):285-316.
[2] Heynen A J,Quinlan E M,Bae D C,et al.Bidirectional,Activity-Dependent Regulation of Glutamate Receptors in the Adult Hippocampus in vivo[J].Neuron,2000,28(2):527-536.
[3] Dzhala V I,Staley K J.Excitatory Actions of Endogenously Released GABA Contribute to Initiation of Ictal Epileptiform Activity in the Developing Hippocampus[J].The Journal of Neuroscience,2003,23(5):1840-1846.
[4] Palop J J,Chin J,Roberson E D,et al.Aberrant Excitatory Neuronal Activity and Compensatory Remodeling of Inhibitory Hippocampal Circuits in Mouse Models of Alzheimer's Disease[J].Neuron,2007,55(5):697-711.
[5] Palop J J,Mucke L.Synaptic Depression and Aberrant Excitatory Network Activity in Alzheimer's disease:Two Faces of the Same Coin?[J].Neuromolecular Medicine,2010,12(1):48-55.
[6] Heinrich A,Andó R,Túri G,et al.K+Depolarization Evokes ATP,Adenosine and Glutamate Release from Glia in Rat Hippocampus:A Microelectrode Biosensor Study[J].British Journal of Pharmacology,2012,167(5):1003-1020.
[7] GrossGW,RhoadesB,JordanR.NeuronalNetworksforBiochemical Sensing[J].SensorsandActuatorsB:Chemical,1992,6(1):1-8.
[8] Liu Z,Ren G,Zhang T,et al.The Inhibitory Effects of Nano-Ag on Voltage-ated Potassium Currents of Hippocampal CA1 Neurons [J].Environmental Toxicology,2011,26(5):552-558.
[9] Oleskevich S,Descarries L.Quantified Distribution of the Serotonin Innervation in Adult Rat Hippocampus[J].Neuroscience,1990,34(1):19-33.
[10]Salgado D,Alkadhi K A.Inhibition of Epileptiform Activity by Serotonin in Rat CA1 Neurons[J].Brain Research,1995,669(2):176-182.
[11]Lu K-T,Gean P-W.Endogenous Serotonin Inhibits Epileptiform Activity in Rat Hippocampal CA1 Neurons Via 5-Hydroxytryptamine<sub>1A</sub>Receptor Activation[J].Neuroscience,1998,86(3):729-737.
[12]Sörman E,Wang D,Hajos M,et al.Control of Hippocampal Theta Rhythm by Serotonin:Role of 5-HT2c Receptors[J].Neuropharmacology,2011,61(3):489-494.
[13]Celada P,Puig M V,Artigas F.Serotonin Modulation of Cortica lNeurons and Networks[J].Frontiers in Integrative Neuroscience,2013,7(25):1-20.
[14]曹端喜,庄柳静,苏凯麒,等.基于Wi-Fi技术的穿戴式动物嗅觉机器人[J].传感技术学报,2014,27(3):303-309.
[15]Liu Q,Zhang F,Hu N,et al.Microelectrode Recording of Tissue Neural Oscillations for a Bionic Olfactory Biosensor[J].Journal of Bionic Engineering,2012,9(4):494-500.
[16]Chen Q,Xiao L,Liu Q,et al.An Olfactory Bulb Slice-Based BiosensorforMulti-SiteExtracellularRecordingofNeuralNetworks[J].BiosensorsandBioelectronics,2011,26(7):3313-3319.
[17]徐莹,韩斌,徐铭恩,等.基于MONTE-CARLO模型的细胞传感器纳米颗粒表面处理分析[J].传感技术学报,2010,22(8):480-486.
[18]Andersen P,Silfvenius H,Sundberg S,et al.Functional Characteristics of Unmyelinated Fibres in the Hippocampal Cortex[J]. Brain Research,1978,144(1):11-18.
[19]Katz D B,Simon S,Nicolelis M A.Dynamic and Multimodal Responses of Gustatory Cortical Neurons in Awake Rats[J].The Journal of Neuroscience,2001,21(12):4478-4489.
[20]Ropert N.Inhibitory Action of Serotonin in CA1 Hippocampal Neurons<i>In vitro</i>[J].Neuroscience,1988,26(1):69-81.
[21]Ropert N,Guy N.Serotonin Facilitates GABAergic Transmission in the CA1 Region of Rat Hippocampus in vitro[J].The Journal of Physiology,1991,441(1):121-136.
[22]张威,胡靓,肖丽丹,等.自组装技术在细胞传感器相容性设计中的应用[J].浙江大学学报:工学版,2012,46(2):345-350.
[23]Stawarski M,Rutkowska-Wlodarczyk I,Zeug A,et al.Genetically Encoded FRET-Based Biosensor for Imaging MMP-9 Activity[J].Biomaterials,2014,35(5):1402-1410.
[24]王天星,黎洪波,苏凯麒,等.基于细胞电阻抗传感器的细胞多生理参数分析系统设计[J].传感技术学报,2014,27(3):1589-1595.[25]Soma N,Watanabe N,Shoji A,et al.Implantable Patch Sensor for L-Glutamate in Hippocampal Slices[J].Analytical Sciences,2013,29(2):181-185.

胡 靓(1988-),女,博士研究生,浙江大学生物医学工程与仪器学院。主要研究方向为生物传感器,味觉传感器,huliang1226@zju.edu.cn;

王 平(1962-),男,博士,教授,浙江大学生物医学工程与仪器科学学院、生物传感器国家专业实验室主任、生物医学工程教育部重点实验室主任国家杰出青年科学基金获得者。主要研究方向传感器与检测技术,生物芯片于生物电子学,人工嗅觉与人工味觉,cnpwang@zju.edu.cn。
Hippocampal Neuronal Network Biosensor and Its Application in Recording Network Activity with 5-HT Stimulation*
HU Liang1,2,QI Zhen1,WANG Qing1,LI Rong1,WANG Ping1,2*
(1.Biosensor National Special Laboratory,Key Laboratory of Biomedical Engineering of Education Ministry,Department of Biomedical Engineering,Zhejiang University,Hangzhou 310027,China;2.State Key Laboratory of Transducer Technology,Shanghai 200050,China)
Hippocampal neural activities have been proved to play important roles in various behaviors such as memoryand learning. 5-hydroxytryptamine(5-HT)isoneimportantneuraltransmitterinvolved in theseprocesses.Currently, some approaches revealed part of 5-HT effect on hippocampal activities;however,they did not illustrate the visual and direct electrophysiological activities in hippocampal neural networks. Thus,a microelectrode array (MEA) sensing platform were established in order to investigate the effect of 5-HT on simplified hippocampal neuronal networks (HNNs) in vitro. Taking advantage of our self-designed 60-channel MEA chip,multi-site electrophysiological signals of the HNNs can be recorded simultaneously in a non-invasive and convenient way. Experimental results confirmed that 100 μM 5- HT completely abolished the action potentials of hippocampal neurons but has little effect on the low frequency oscillation. This study suggests this HNN-based biosensor can monitor and record neuronal electrophysiology in a long term. Andthismulti-sitesensingplatform becomesapromisingapproachinthestudyofneuronalnetworkactivity.
biosensor;hippocampal neuronal network;microelectrode array(MEA);neuronal network activity;5-hydroxytryptamine(5-HT);network oscillation EEACC:7230
TP393
A
1004-1699(2015)07-0947-06
10.3969/j.issn.1004-1699.2015.07.001
项目来源:国家自然科学基金项目(30970765);教育部博士点基金项目(20120101130011)
2014-10-27 修改日期:2015-04-09
