依达拉奉抗大鼠脊髓损伤后脊髓细胞凋亡的机制初探
2015-11-18王继权赵兴长孙平李昊天褚鑫吕刚范仲凯
王继权,赵兴长,孙平,李昊天,褚鑫,吕刚,范仲凯
依达拉奉抗大鼠脊髓损伤后脊髓细胞凋亡的机制初探
王继权,赵兴长,孙平,李昊天,褚鑫,吕刚,范仲凯△
目的探讨依达拉奉(EDA)对大鼠脊髓损伤(SCI)后内质网应激(ERS)介导的细胞凋亡的影响。方法36只SD大鼠随机分为假手术(sham)组、SCI组、EDA组,每组12只。采用Allen's法建立SCI模型,sham组仅行椎板切除术。术后Sham组和SCI组给予与EDA组等体积等频次生理盐水处理;EDA组在SCI模型建成以后予以EDA(10 mg/kg),每12 h腹腔注射给药1次。于术后3 d取脊髓,应用Western blot检测C/EBP同源蛋白(CHOP)、Cleaved caspase-12和Cleaved caspase-3的表达水平,免疫荧光技术检测脊髓组织中caspase-12、CHOP阳性细胞的比率,TUNEL法检测脊髓细胞凋亡水平。结果SCI组较sham组CHOP、Cleaved caspase-12、Cleaved caspase-3的表达升高,Cleaved caspase-12、CHOP阳性细胞比率增加,脊髓组织细胞凋亡比率增加(均P<0.01)。EDA组较SCI组CHOP、Cleaved caspase-12和Cleaved caspase-3的表达降低,Cleaved caspase-12、CHOP阳性细胞比率减少,脊髓组织细胞凋亡比率减少(均P<0.01)。结论EDA对脊髓损伤有保护作用,机制可能与其抑制SCI后脊髓细胞的ERS和脊髓细胞的凋亡有关。
脊髓损伤;细胞凋亡;半胱氨酸天冬氨酸蛋白酶3;半胱氨酸天冬氨酸蛋白酶12;模型,动物;大鼠,Sprague-Dawley;内质网应激;依达拉奉;转录因子CHOP
脊髓损伤(spinal cord injury,SCI)分为原发性损伤和继发性损伤,后者包括内质网应激(ERS)、钙离子稳态失衡、损伤局部水肿、神经兴奋性中毒、氧化应激和炎症反应等[1],可导致永久性神经功能缺陷[2]。目前,对于继发性损伤的机制和阻断方式的研究成为热点。依达拉奉(EDA)是临床广泛用于治疗脑卒中的药物。有研究显示,EDA对糖尿病中风鼠的脑神经具有保护作用,其作用机制可能与其可抑制脑神经细胞ERS有关[3]。有研究表明,EDA对SCI亦具有保护作用[4]。施旺细胞移植联合EDA注射可促进脊髓损伤后大鼠神经纤维再生及神经功能改善[5]。但关于EDA对SCI的保护机制及对SCI后的ERS是否具有抑制作用报道少见。本研究通过检测EDA对SCI后CHOP、caspase-12和caspase-3的表达和脊髓细胞凋亡的影响,旨在探讨EDA对SCI后的脊髓细胞保护作用的可能机制。
1 资料与方法
1.1 一般资料SPF级SD大鼠36只,体质量220~250 g,雌雄各半,由辽宁医学院SPF级实验动物中心提供。随机数字表法分为假手术(sham)组、SCI模型组及EDA组,每组12只。每组大鼠再随机均分为2个亚组,其中的一个亚组用于Western blot检测CHOP、caspase-12和caspase-3的蛋白表达水平;另一个亚组用于免疫荧光检测caspase-12、CHOP表达阳性细胞比率,TUNEL法测脊髓细胞凋亡指数。
1.2 主要仪器与试剂全自动酶标仪(日本Corona),电泳仪(美国Bio-Rad),ECL显像仪(美国Aplegen),荧光显微镜(日本Olympus)。小鼠抗大鼠CHOP抗体(cell signaling technolo⁃gy);兔抗大鼠caspase-12,兔抗大鼠Cleaved caspase-3(英国abcam);驴抗小鼠荧光二抗,驴抗兔荧光二抗(美国Abb⁃kine),小鼠抗大鼠β-actin,山羊抗兔IgG二抗及山羊抗小鼠IgG二抗(Santa Cruz Biotechnology);依达拉奉(大连美仑生物科技有限公司);增强型ECL化学发光检测试剂盒(美国Mil⁃lipore);TUNEL试剂盒(美国Roche)。
1.3 动物处理及模型的构建SD大鼠用10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉,取俯卧位,75%乙醇常规消毒,在T8~T10处正中纵行切开皮肤,暴露T8~T10椎板和硬脊膜区域2 cm×2 cm,咬骨钳咬除棘突和椎板暴露脊髓。以10 g× 5 cm的冲量采用Allen打击法建立T9脊髓中度损伤模型。打击瞬间可见大鼠双后肢抽搐,尾痉挛摆动,即为SCI造模成功。sham组仅显露T8~T10节段脊髓,不予以打击。术后sham组和SCI组给予与EDA组等体积等频次的生理盐水处理;EDA组在SCI模型建成后予以EDA(10 mg/kg),每12 h腹腔注射给药1次。所有的鼠术后给予腹腔注射4万U/d青霉素抗感染,在室温20~25℃,湿度40%~60%的环境中喂养,每天人工按压膀胱排尿2~3次。
1.4 CHOP、Cleaved caspase-12和Cleaved caspase-3蛋白表达的检测打击3 d后,将3组中各一个亚组的动物采用10%水合氯醛麻醉,并在冰块上快速取出脊髓,以脊髓打击点为中心取长约1 cm(100 mg)的脊髓。按BCA蛋白浓度测定试剂盒说明书的步骤测定各样品的蛋白浓度。上样总蛋白量为40 μg,室温下SDS-PAGE凝胶电泳,并将胶上的蛋白转至PVDF膜上,常规封闭,洗膜后加相应蛋白浓度的一抗于4℃恒温箱中孵育过夜,洗膜后与相应的二抗于室温孵育1.5 h,随后ECL显色仪获取照片。用Image J 2x软件求出各蛋白与β-actin灰度值,并求出比值反映各蛋白的相对表达水平。
1.5 免疫荧光检测CHOP和caspase-12阳性细胞比率打击后3 d,将3组中各另一个亚组予以麻醉,行心脏灌注。先用生理盐水灌注150 mL左右,后采用4%多聚甲醛灌注约30 min,灌注成功时,小腿抽动。灌注结束后,迅速完整地取出距打击中心上下各3 mm,长约6 mm的脊髓组织并将其置于4%多聚甲醛中固定24 h,再置于30%蔗糖溶液中浸泡脱水24 h,在-20℃冰冻切片机中用OCT包埋,并分别在距离损伤中心点头侧和尾侧各2 mm处连续横断面切片,厚度5 μm。将切片用1×PBS洗3次,每次5 min,置于封闭液中封闭120 min,吸出封闭液,加入稀释的一抗,4℃孵育过夜后上荧光素标记的二抗,在室温避光条件下孵育1.5 h,然后用1× PBS洗3次,每次5 min,加DAPI,封片,于荧光显微镜下观察。细胞核中出现绿色颗粒为CHOP阳性细胞,细胞质中出现红色颗粒为caspase-12阳性细胞。每个组织切片均随机读取6个不重叠的高倍(×400)视野,计数6个视野的cas⁃pase-12或CHOP阳性细胞总数及细胞总数,以阳性细胞总数占总细胞数的比值反映每片组织中蛋白的表达情况。
1.6 TUNEL法检测脊髓细胞凋亡指数各组脊髓组织的灌注固定、取材、制片过程同上。按照TUNEL细胞凋亡检测试剂盒说明书进行操作,细胞核中出现红色颗粒为阳性。用荧光显微镜在每片组织片上随机读取6个不重叠的高倍(× 200)视野进行观察。凋亡指数(AI)定义为100个细胞核中凋亡细胞核的平均个数。
1.7 统计学方法采用SPSS 16.0软件进行统计学分析,符合正态分布的计量资料以表示,多组间样本均数的比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 Western blot检测结果sham组Cleaved cas⁃pase-12、CHOP和Cleaved caspase-3蛋白的相对表达量低于SCI组和EDA组,EDA组较SCI组3种蛋白相对表达量亦下调(P<0.01),见表1,图1。
Tab.1 The relative expression levels of cleaved caspase-12,CHOP and Cleaved caspase-3 protein in three groups表1 Cleaved caspase-12、CHOP和Cleaved caspase-3蛋白相对表达量(n=6)

Tab.1 The relative expression levels of cleaved caspase-12,CHOP and Cleaved caspase-3 protein in three groups表1 Cleaved caspase-12、CHOP和Cleaved caspase-3蛋白相对表达量(n=6)
**P<0.01;a与sham组比较,b与SCI组比较,P<0.05;表2同
组别sham组SCI组EDA组F Cleaved caspase-12 0.051±0.025 0.821±0.094a0.616±0.086ab170.315**CHOP 0.149±0.016 1.321±0.219a0.744±0.131ab82.765**Cleaved caspase-3 0.053±0.015 0.394±0.049a0.254±0.025ab160.622**
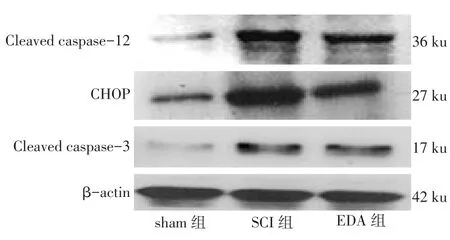
Fig.1 Western blot analysis of Cleaved caspase-12,CHOP and Cleaved caspase-3 in three groups图1 Western blot检测各组Cleaved caspase-12、CHOP和Cleaved caspase-3的表达
2.2 免疫荧光检测caspase-12、CHOP阳性细胞比率结果sham组脊髓组织中caspase-12、CHOP阳性细胞比率低于SCI和EDA组,EDA组较SCI组降低(P<0.01),见图2、表2。
Tab.2 The positive expression rates and apoptotic index of caspase-12,CHOP and TUNEL表2 Caspase-12,CHOP和TUNEL阳性细胞比率及凋亡指数(n=6)
组别sham组SCI组EDA组F caspase-12阳性细胞比率0.020±0.015 0.193±0.026a0.143±0.027ab79.631**CHOP阳性细胞比率0.098±0.031 0.419±0.051a0.246±0.037ab94.815**AI(%)1.85±1.15 15.44±2.04a10.63±2.15ab84.238**
2.3 TUNEL检测结果sham组中未见明显细胞凋亡;SCI组中AI高于sham和EDA组(P<0.01),见图3、表2。
3 讨论
SCI是脊柱外科的一种常见的神经损伤性疾病,近年来其发病率呈逐渐上升的趋势,且具有高致残率特点。在细胞中钙离子的失衡和氧化应激可激活ERS凋亡通路,引起细胞发生凋亡,从而加重SCI[6]。因此,研究如何阻断SCI后的ERS可能对SCI的治疗具有意义。
ERS引起的细胞凋亡信号通路中,caspase-12和CHOP是内质网应激细胞凋亡途径的2个标志性蛋白[7]。Caspase-12是位于内质网膜上的一种半胱天冬酶,ERS时caspase-12表达增加并活化,可直接激活与细胞凋亡相关的caspase级联反应,从而引起细胞凋亡[8]。另外,ERS时内质网跨膜蛋白PERK发生聚集并活化以激活转录因子elF2α,促进活化的转录因子ATF4的表达增加,从而使核转录因子CHOP的表达增加[9]。CHOP可通过下调Bcl-2的表达,以实现其促进凋亡的作用[10]。本研究通过West⁃ern blot和免疫荧光技术分别从蛋白水平和组织水平检测内质网应激凋亡途径的标志蛋白caspase-12和CHOP的表达,结果显示,SCI 3 d后,SCI组大鼠脊髓组织中活化的caspase-12和CHOP的表达量较sham组增高,表明脊髓细胞内内质网应激凋亡途径已被激活,与Zhang等[11]研究相似。Western blot检测显示,SCI 3 d后,SCI组较sham组Cleaved cas⁃pase-3的表达量显著增加。并且TUNEL染色结果显示,SCI组较sham组脊髓细胞AI亦增加,表明SCI 3 d后内质网应激细胞凋亡途径已经激活,并可能导致caspase-3调控的细胞凋亡的发生。
EDA是一种强效的氧自由基清除剂和抗氧化剂,已经广泛应用于临床脑卒中的治疗。研究发现,EDA可通过抑制氧自由基介导的氧化性损伤,从而减轻缺血再灌注对脊髓的损伤[12],并且可促进SCI后神经功能的恢复[13]。最近,一项应用EDA对比甲基泼尼松龙(MP)治疗SCI 8 h后的动物实验研究显示,EDA组caspase-3阳性细胞数较MP组更少,Bcl-xl的表达量较MP组的表达更高,EDA对SCI的维持治疗似乎更有效[14]。但是,关于EDA治疗SCI的分子生物学机制仍不十分清楚。本研究显示,SCI 3 d后EDA组Cleaved caspase-12、CHOP和Cleaved caspase-3的表达和脊髓细胞AI较SCI组均降低,表明EDA对SCI具有保护作用,机制可能与其可显著抑制SCI后ERS,并可抑制caspase-3调控的细胞凋亡,发挥脊髓保护作用相关。
综上所述,依达拉奉对SCI的保护作用可能与其可抑制SCI后的内质网应激凋亡途径并抑制脊髓细胞凋亡有关,有可能成为SCI治疗的一线用药。但是,临床上MP治疗SCI具有最佳的时间窗,而EDA应用于SCI治疗是否存在时间窗的问题仍有待进一步的研究。
(图2、3见插页)
[1]Lee JY,Maeng S,Kang SR,et al.Valproicacid protects motor neu⁃ron death by inhibting oxidative stress and endoplasmic reticulum stress-mediated cytochrome c release after spinal cord injury[J].J Neurotauma,2014,31(6):582-594.doi:10.1089/neu.2013.3146.
[2]Houle JD,Côté MP.Axon regeneration and exercise dependent plas⁃ticity after spinal cord injury[J].Ann N Y Acad Sci,2013,1279:154-163.doi:10.1111/nyas.12052.
[3]Srinivasan K,Sharma SS.Edaravone offers neuroprotectionin a dia⁃betic stroke model via inhibition of Endoplasmic Reticulum Stress[J].Basic Clin Pharmacol Toxicol,2012,110(2):133-140.doi:10.11 11/j.1742-7843.2011.00763.X.
[4]Ozgiary E,Serarslan Y,Oztürk OH,et al.Protective effects of edara⁃vone on experimental spinal cord injury in rats[J].Pediatr Neuro⁃surg,2011,47(4):254-260.doi:10.1159/000335400.
[5]Zhang SQ,Wu MF,Piao Z,et al.Edaravone combined with Schwann cell transplantation may repair spinal cord injury in rats[J].Neural Regen Res,2015,10(2):230-236.doi:10.4103/1673-5374.152376.
[6]Sovolyova N,Healy S,Samali A,et al.Stress to death mechanisms of ER stress-induced cell death[J].Biol Chem,2014,395(1):1-13. doi:10.1515/hsz-2013-0174.
[7]Liu D,Zhang M,Yin H,et al.Signaling pathways involved in endo⁃plasmic reticulum stress-induced neuronal apoptosis[J].Int J Neu⁃rosci,2013,123(3):155-162.doi:10.3109/00207454.2012.746974.
[8]Martinez JA,Zhang Z,Svetlov SI,et al.Calpain and caspase pro⁃cessing of caspase-12 contribute to the ER stress induced cell death pathway in differentiated PC12 cells[J].Apoptosis,2010,15(12):1480-1493.doi:10.1007/s10495-010-0526-4.
[9]Sano R,Reed JC.ER stress-induced cell death mechanisms[J]. Biochimica et Biophysica Acta,2013,1833(12):3460-3470.doi:10.1016/j.bbamcr.2013.06.028.
[10]Logue SE,Cleary P,Saveljeva S,et al.New directions in ER stressinduced cell death[J].Apopsis,2013,18(5):537-546.doi:10.1007/ s10495-013-0818-6.
[11]Zhang HY,Zhang X,Wang ZG,et al.Exogenous basic fibroblast growth factor inhibits ER stress-induced apoptosis and improves re⁃covery from spinal cord injury[J].CNS Neurousci Ther,2013,19(1):20-29.doi:10.1111/cns.12013.
[12]Hamaishi M,Orihashi K,Isaka M,et al.Low-dose edaravone injection into the clamped aorta prevents ischemic spinal cord injury[J].Ann Vasc Surg,2009,23(1):128-135.doi:10.1016/j.avsg.2008.05.010.
[13]Ohta S,Iwashita Y,Kakinoki R,et al.Effects of continuous intrave⁃nous infusion of MCI-186 on functional recovery after spinal cord injury in rats[J].J Neurotratuma,2011,28(2):289-298.doi:10.1089/ neu.2010.1477.
[14]Wang J,Guo G,Wang W,et al.Effect of methylprednisolone and edaravone administration on spinal cord injury[J].Eur Rev Med Pharmacol Sci,2013,17(20):2766-2772.
(2015-01-29收稿2015-04-30修回)
(本文编辑陆荣展)
Preliminary mechanism of edaravone against cell apoptosis after spinal cord injury in rats
WANG Jiquan,ZHAO Xingchang,SUN Ping,LI Haotian,CHU Xin,LYU Gang,FAN Zhongkai△
First Affiliated Hospital of Liaoning Medical College,Jinzhou 121001,China△
ObjectiveTo investigate the effects of edaravone(EDA)on cell apoptosis induced by endoplasmic reticu⁃lum stress(ESR)after spinal cord injury(SCI)in rats.MethodsThirty-six healthy adult SD rats were randomly divided in⁃to three groups(12 rats for each group):Sham group,SCI group and EDA group.The rat model of SCI was made by Allen's method and the sham group was only received laminectomy and kept the spinal cord intact.Rats in sham group and SCI group accepted the same volume and frequency of saline injection as EDA group.The EDA group was given 10 mg/kg EDA once every 12 h intraperitoneally.Three days after injuring,the spinal cords were harvested,and the protein levels of C/EBP homologous protein(CHOP),Cleaved caspase-12 and Cleaved caspase-3 were detected by Western blot assay.Immunofluo⁃rescence staining was used to analyze the positive ratio of caspase-12 and CHOP in spinal cord of three groups.Meanwhile,TUNEL staining was used to identify cell apoptosis of spinal cord.ResultsCompared with sham group,the protein levels of CHOP,Cleaved caspase-12 and Cleaved caspase-3 were obviously higher in SCI group(P<0.01);the proportion of Cas⁃pase-12 and CHOP positive cells was significantly increased(P<0.01),and the apoptotic rates were also significantly in⁃creased in spinal cord(P<0.01).However,compared with SCI group,the protein levels of CHOP,Cleaved caspase-12 and Cleaved caspase-3 were significantly decreased in EDA group(P<0.01);the proportion of Caspase-12 and CHOP positive cells was significantly reduced(P<0.01),and the apoptotic rates were also significantly decreased in spinal cord(P<0.01). ConclusionEDA has neuroprotective potential to spinal cord injury.The mechanism of its neuroprotective effect may asso⁃ciate with its inhibitory effect to the cell apoptosis induced by endoplasmic reticulum stress after SCI.
spinal cord injury;apoptosis;caspase 3;caspase 12;models,animal;rats,Sprague-Dawley;endoplasmic reticulum stress;edaravone;transcription factor CHOP
R651.2
A
10.11958/j.issn.0253-9896.2015.09.008
国家自然科学基金资助项目(81272074);辽宁省高等学校优秀人才支持计划项目(LJQ2014091);辽宁医学院校长基金项目(QM2014011)
辽宁锦州,辽宁省辽宁医学院附属第一医院骨科(邮编121001)
王继权(1989),男,硕士在读,主要从事脊髓损伤的机制及修复研究
△通讯作者E-mail:flanzz@163.com
