青蒿琥酯抑制人头颈部鳞状细胞癌增殖及诱导凋亡的机制
2015-11-18赵艳李丽华赵颂
赵艳,李丽华,赵颂
青蒿琥酯抑制人头颈部鳞状细胞癌增殖及诱导凋亡的机制
赵艳,李丽华△,赵颂
目的探讨天然小分子化合物青蒿琥酯(Akt)通过诱导人头颈部鳞癌细胞凋亡而抑制肿瘤生长的分子机制。方法培养人头颈部鳞癌细胞系UM-SCC-10A,利用四甲基偶氮唑蓝(MTT)法检测Akt半数抑制浓度(IC50);在荧光显微镜下观察不同浓度(0、2.5、5、10、20、40 μmol/L)Akt对细胞形态的影响;流式细胞仪检测细胞周期及凋亡情况;免疫印迹(Western blot)分析Akt诱导凋亡相关蛋白和细胞周期调节因子表达水平的变化。结果Akt对UMSCC-10A细胞的生长有明显抑制作用,且生长抑制率随药物浓度增加而增加;当Akt处理细胞48 h时,IC50为15.01 μmol/L。荧光显微镜下,使用细胞核染料Hoechst33258观察到细胞核内出现凋亡小体;流式细胞仪分析显示Akt诱导细胞周期阻滞在G1期,细胞出现大量凋亡;Western blot结果显示P53、P21蛋白表达量上调、细胞周期蛋白D(Cy⁃cline D)下调;线粒体途径诱导的Bcl-2相关X蛋白(Bax)、细胞色素C(cytochrome C)及半胱氨酸天冬氨酸蛋白酶-3(caspase-3)表达上调,B细胞淋巴瘤/白血病-2(Bcl-2)、procaspase-3表达下调,线粒体膜电位降低。结论Akt经由线粒体途径诱导UM-SCC-10A细胞凋亡,阻滞细胞周期于G1期,进而抑制肿瘤细胞增殖。
细胞凋亡;细胞增殖;头颈部肿瘤;青蒿琥酯
头颈部鳞状细胞癌(HNSCC)是原发于口腔颌面头颈部的恶性肿瘤,其发病率约占头颈部肿瘤的80%以上。近年来,临床上对于HNSCC虽然采用了手术、放化疗等综合性的治疗措施,但其5年生存率仍然徘徊在50%左右[1]。青蒿琥酯(Artesunate,Art)为倍半萜内酯类抗疟新药青蒿素的衍生物,不仅存在抗疟、抗菌等活性,还可以抗多种肿瘤细胞增殖[2],具有毒性低、不存在交叉耐药、可以逆转肿瘤细胞的多耐药性等优势。对于一些急性白血病[3]、妇科肿瘤[4]以及胰腺癌[5]的治疗已进入临床试验阶段,但对于头颈部鳞癌的作用还鲜见报道。本研究以UM-SCC-10A细胞系为模型,探讨Art诱导细胞凋亡、抑制细胞生长的机制,为临床应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试剂UM-SCC-10A细胞系购于上海细胞生物研究所。Art(苏州宝泽堂医药科技有限公司,纯度99%);胎牛血清、青霉素、链霉素、L-谷氨酰胺及四甲基偶氮唑蓝(MTT)均购于Sigma公司;caspase抑制剂Z-VAD-FMK、二甲基亚枫(DMSO)、Annexin V-FITC、DNA检测试剂盒(美国BD公司);单克隆抗体P21、P53、细胞周期蛋白D(Cycline D)、B细胞淋巴瘤/白血病-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、细胞色素C(cytochrome C)及半胱氨酸天冬氨酸蛋白酶-3(cas⁃pase-3,美国Cell signaling公司)。Hoechst33258、多聚甲醛、JC-1试剂盒购于碧云天。
1.1.2 仪器流式细胞仪FACS Calibur(美国BD公司);细胞培养箱(Thermo Scientific HERAcell 240i);全自动酶标仪(BioTek Synergyz)。
1.2 方法
1.2.1 细胞培养细胞置于含10%热灭活胎牛血清、2 mmol/L L-谷氨酰胺、100 U/mL青霉素和100 g/mL链霉素的DMEM培养基中,放于37℃、5%CO2细胞培养箱中培养。每2~4 d传代1次,取对数生长期细胞进行实验。
1.2.2 半数抑制浓度(IC50)分析取对数生长期细胞,以5× 103/孔密度接种于96孔培养板,37℃培养24 h,加入含终浓度分别为0、2.5、5、10、20、40 μmol/L Akt培养液,每个浓度设5个复孔,继续培养48 h,然后再加入10 μL MTT溶液(5 g/ L),37℃培养4 h后,2 000 r/min离心10 min,小心吸去上清液,每孔加入150 μL DMSO,于振荡器上振荡15 min,在全自动酶标仪570 nm处测定光密度(OD)值,计算细胞生长抑制率。SPSS-PROBIT法计算IC50。
1.2.3 实验分组分别取IC50附近2个剂量浓度10 μmol/L和20 μmol/L的Akt处理48 h组,和用PBS代替Akt的对照组进行实验检测。在细胞周期和细胞凋亡的检测中加入caspase抑制剂组来探讨凋亡路径,caspase抑制剂组细胞预先用50 μmol/L Z-VAD-FMK处理2 h,然后与20 μmol/L Akt组一起培养。
1.2.4 细胞核染色用4%多聚甲醛室温固定细胞15 min,PBS洗1次,然后用Hoechst33258(50 mg/L)染色,37℃避光孵育20 min,PBS洗3次,在荧光显微镜下观察细胞核形态。
1.2.5 细胞凋亡检测用Annexin V和PI双染试剂盒检测细胞凋亡情况。收集细胞,用PBS洗2次,弃去上清,加入5 μL Annexin V(10 mg/L)避光孵育10 min,再加入10 μL PI(20 mg/L),避光孵育10 min,流式细胞仪检测细胞凋亡率,采用cell-quest软件对数据进行获取和分析。
1.2.6 细胞周期检测收集细胞,用含2%胎牛血清的PBS洗1次,用75%预冷乙醇固定2 h,PBS洗2次,计数细胞1× 106个/mL,加入1 mL PI染液(3.8 mmol/L柠檬酸钠、20 mg/L PI、10 mg/L RNase A),室温避光孵育15 min,用流式细胞仪检测细胞各个周期的DNA含量,采用cell-quest软件对数据进行获取和分析。
1.2.7 线粒体膜电位检测收集细胞,用PBS洗2次,加入0.5 mL JC-1染液,37℃避光孵育20 min,PBS洗2次,重悬于500 μL PBS中,用流式细胞仪检测。
1.2.8 免疫印迹(Western blot)分析收集细胞,用PBS洗2次,加入细胞裂解液裂解并提取蛋白样本,煮沸变性5 min,上样于10%SDS-PAGE电泳分离,电转移至PVDF膜上,用5%(w/v)脱脂乳室温封闭1 h,然后用Tris-HCl洗1次,立即加入一抗溶液,平缓摇动,4℃过夜,室温下加二抗孵育1 h。以β-actin作为内参照,显影参照ECL试剂盒说明书操作。分析P53、P21、Cycline D、Bcl-2、Bax、cytochrome C、procas⁃pase-3、caspase-3蛋白表达。
1.3 统计学方法采用SPSS 13.0软件对数据进行分析。计量资料以表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 Akt对UM-SCC-10A细胞增殖的影响结果显示Akt能明显抑制细胞增殖,0、2.5、5、10、20、40 μmol/L时,细胞增殖抑制率分别为0、(20.17±0.90)%、(30.70±1.18)%、(52.21±0.67)%、(57.22±1.01)%、(60.23±0.70)%,生长抑制作用随药物浓度增加而增强。细胞经Akt处理48 h后,IC50值为15.01 μmol/L。
2.2 细胞核形态观察对照组可见细胞核染色均匀,呈圆形或椭圆形。10 μmol/L Akt组可见细胞核变形、核固缩,可见凋亡小体(箭头所示),20 μmol/L Akt组可见细胞几乎没有完整的核,可见核变形,如典型的月牙形细胞核(箭头所示),见图1。
2.3 Akt对UM-SCC-10A细胞凋亡的影响10、20 μmol/L Akt组与对照组相比凋亡率均增加,20 μmol/L Akt组比10 μmol/L Akt组增加更明显,而caspase抑制剂组与对照组比较没有明显增加,见图2。
2.4 Akt对UM-SCC-10A细胞周期的影响10、20 μmol/L Akt组、caspase抑制剂组与对照组相比,G1期DNA含量增加,S和G2期均减少,20 μmol/L Akt组、caspase抑制剂组比10 μmol/L Akt组效果更明显,caspase抑制剂组与20 μmol/L Akt组无明显差异,见图3。
2.5 Akt对线粒体膜电位的影响10、20 μmol/L Akt组与对照组相比,线粒体膜电位均降低,20 μmol/L Akt组比10 μmol/L Akt组降低更明显,见图4。
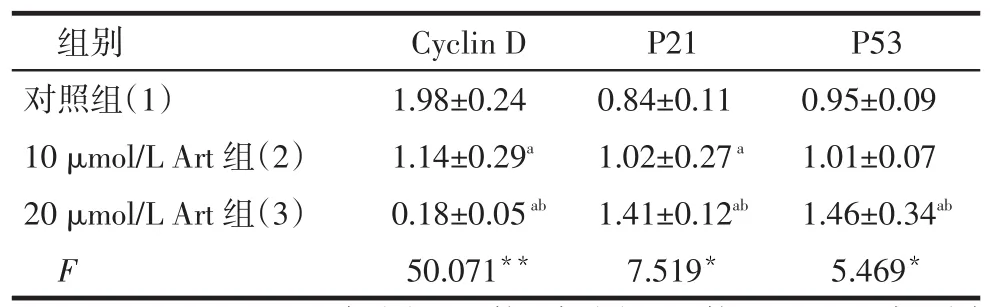
2.6 细胞周期调节因子的表达对照组、10 μmol/L Akt组、20 μmol/L Akt组相比,Cyclin D表达量依次降低,P21表达量依次增加;20 μmol/L Akt组P53表达量高于对照组和10 μmol/L Akt组,而后两组P53表达量差异无统计学意义,见图5、表1。
2.7 Bcl-2、Bax、procaspase-3、caspase-3、cyto⁃chrome C蛋白量的表达对照组、10 μmol/L Akt组、20 μmol/L Akt组相比,Bcl-2、procaspase-3表达量依次减少,cytochrome C、Bax和caspase-3表达量依次增加(均P<0.05),见图6、表2。
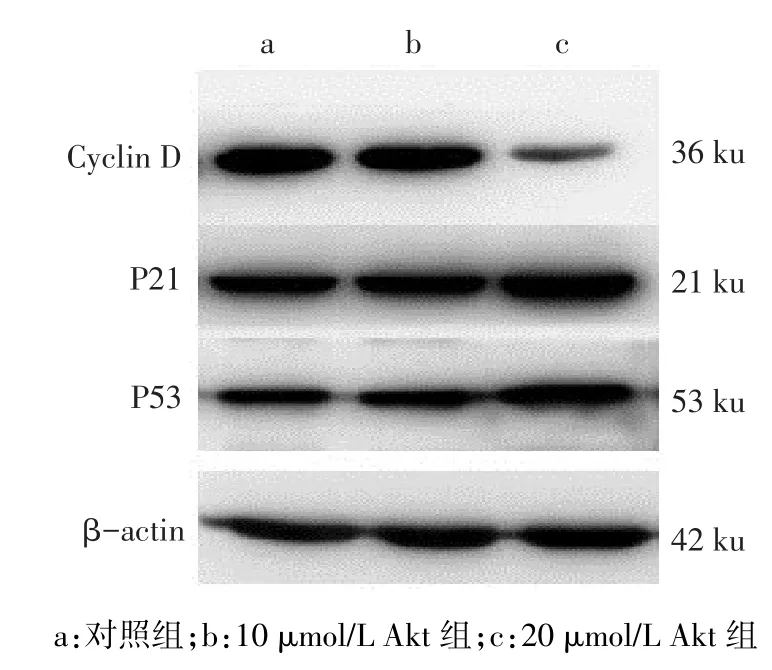
Fig.5 Expressions of cell cycle regulator after 48-hour treatment with different concentrations of Akt图5 不同浓度Akt作用48 h后UM-SCC-10A细胞周期调节因子的表达
Tab.1Expressions of cell cycle regulator after 48-hour treatment with different concentrations of Akt表1 不同浓度Akt作用48 h后UM-SCC-10A细胞周期调节因子的表达(n=5,)
Tab.1Expressions of cell cycle regulator after 48-hour treatment with different concentrations of Akt表1 不同浓度Akt作用48 h后UM-SCC-10A细胞周期调节因子的表达(n=5,)
*P<0.05,**P<0.01;a与(1)组比较,b与(2)组比较,P<0.05;表2同
组别对照组(1)10 μmol/L Art组(2)20 μmol/L Art组(3)F Cyclin D 1.98±0.24 1.14±0.29a0.18±0.05ab50.071**P21 0.84±0.11 1.02±0.27a1.41±0.12ab7.519*P53 0.95±0.09 1.01±0.07 1.46±0.34ab5.469*
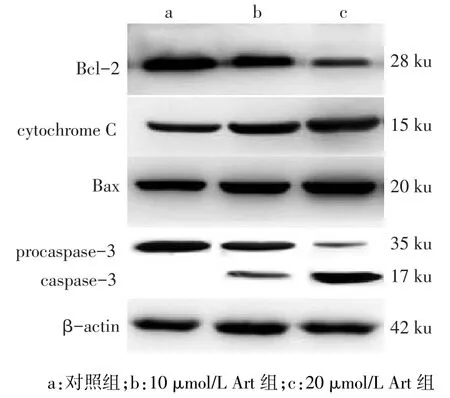
Fig.6 The apoptotic associated protein expression after 48-hour treatment with different concentrations of Akt图6 不同浓度Akt作用48 h后UM-SCC-10A细胞凋亡相关蛋白的表达情况
3 讨论
3.1 青蒿琥酯抑制UM-SCC-10A细胞增殖Akt作为天然化合物,具有高效、低毒、不易产生耐受等特点,已成为许多癌细胞系靶向治疗的理想选择[6]。虽然一些研究已经证明倍半萜内酯对于人类各种细胞系的抗癌活性[7],但是对于头颈部鳞癌的作用还未知。本文初步探讨了Akt对于UM-SCC-10A细胞的抑瘤效果及其机制,结果显示Akt能够明显抑制UM-SCC-10A细胞增殖,并随浓度增加而增强。
Tab.2 The apoptotic associated protein expression after 48-hour treatment with different concentrations of Akt表2 不同浓度Akt作用48 h后UM-SCC-10A细胞凋亡相关蛋白蛋白表达(n=5,)
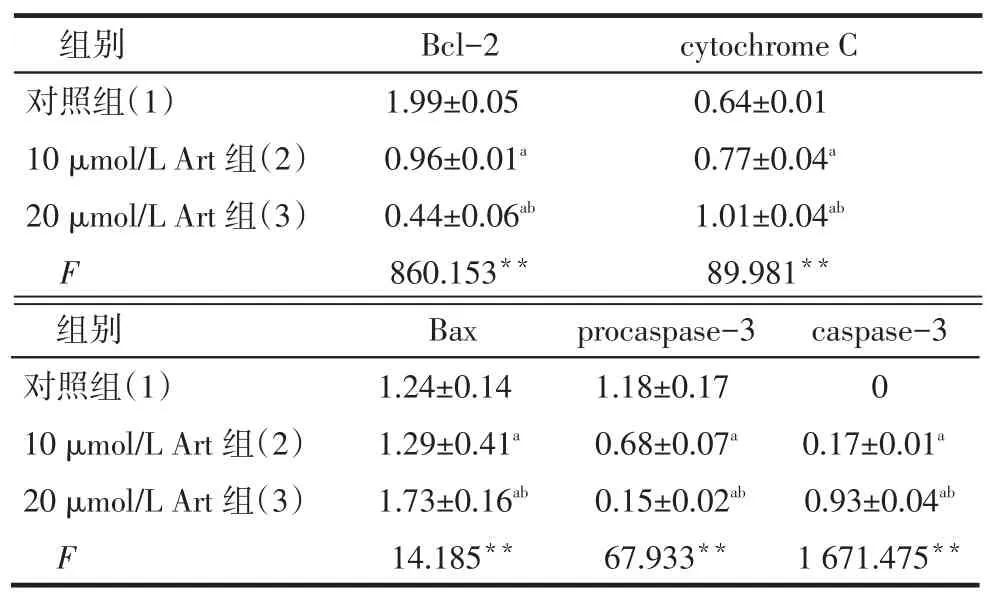
Tab.2 The apoptotic associated protein expression after 48-hour treatment with different concentrations of Akt表2 不同浓度Akt作用48 h后UM-SCC-10A细胞凋亡相关蛋白蛋白表达(n=5,)
组别对照组(1)10 μmol/L Art组(2)20 μmol/L Art组(3)F Bcl-2 1.99±0.05 0.96±0.01a 0.44±0.06ab 860.153**cytochrome C 0.64±0.01 0.77±0.04a 1.01±0.04ab 89.981**组别对照组(1)10 μmol/L Art组(2)20 μmol/L Art组(3)F Bax 1.24±0.14 1.29±0.41a 1.73±0.16ab 14.185**procaspase-3 1.18±0.17 0.68±0.07a 0.15±0.02ab 67.933**caspase-3 0 0.17±0.01a 0.93±0.04ab 1 671.475**
3.2 Akt通过线粒体途径诱导细胞凋亡细胞凋亡的发生有3种主要途径:死亡受体途径、线粒体途径和内质网途径[8]。Bcl-2家族蛋白是线粒体凋亡信号通路中的关键因子[9]。Bcl-2和Bax均为Bcl-2家族蛋白成员,Bax/Bcl-2的比值增加,使线粒体膜通透性增高,cytochrome C释放,促发caspase级联反应,导致caspase 3的活化,引起细胞不可逆的凋亡过程。已经证明caspase 3是哺乳动物细胞线粒体凋亡途径中主要效应因子[10]。本实验中Akt诱导UM-SCC-10A细胞发生凋亡且随浓度增加有所增加,与光镜下的形态学检测结果吻合。Western blot分析指出Akt明显地使Bcl-2表达下调,Bax表达上调,导致UM-SCC-10A细胞Bax/Bcl-2的比值增加,从而使线粒体膜通透性增高,通过观察线粒体膜电位的变化可以证实Bcl-2介导的线粒体凋亡途径。Cy⁃tochrome C的释放增加了caspase 3的表达,用cas⁃pase抑制剂后细胞凋亡数量明显减少,说明Akt诱导的UM-SCC-10A细胞凋亡是通过caspase依赖的线粒体凋亡途径实现的。
3.3 Akt通过诱导细胞周期阻滞抑制UM-SCC-10A细胞生长细胞增殖主要受到细胞周期的调节,当细胞周期中特殊的节点被阻滞则可能引起细胞凋亡[11]。肿瘤抑制基因P53可通过其靶基因P21直接抑制Cyclin D,从而引起细胞周期在G1期的阻滞[12]。本研究结果提示Akt可能通过上调P53及P21的表达,抑制Cyclin D,导致UM-SCC-10A细胞在G1期发生阻滞,从而抑制UM-SCC-10A细胞的生长,而且caspase活化的抑制作用不会改变细胞周期的阻滞,说明Akt对UM-SCC-10A细胞生长的抑制不仅由细胞凋亡引起,还由细胞周期阻滞引起。
(图1~4见插页)
[1]Guo W.Advances of targeted therapies in squamous cell carcinoma of oral and maxillofacial-head and neck[J].Journal of Oral and Max⁃illofacial Surgery,2012,22(2):77-81.[郭伟.晚期口腔颌面头颈部鳞癌靶向治疗的进展浅析[J].口腔颌面外科杂志,2012,22(2):77-81].doi:10.3969/j.issn.1005-4979.2012.02.001.
[2]Zhou JY,Zhu Y.Progress in antitumor effects of Artemisinin and its derivatives[J].Nat Prod Res Dev,2014,26(6):975-981.[周洁芸,朱焰.青蒿素及其衍生物抗肿瘤作用研究进展[J].天然产物研究与开发,2014,26(6):975-981].
[3]Wang WQ,Yin H.Effects of Artesunate on K562,K562/ADM cell apoptosis and NF-κB p65 expression in human leukemia[J].China Pharmacist,2014,17(5):729-731.[王玮琴,殷红.青蒿琥酯对人白血病K562,K562/ADM细胞凋亡的作用及对NF-κB p65表达的影响[J].中国药师,2014,17(5):729-731].
[4]Li Y,Ni ZY,Zhu MC,et al.Antitumour activities of sesquiterpene lactones from Inula helenium and Inula japonica[J].Z Naturforsch C,2012,67(7-8):375-380.
[5]Khan M,Ding C,Rasul A,et al.Isoalantolactone induces reactive oxygen species mediated apoptosis in pancreatic carcinoma PANC-1 cells[J].Int J Biol Sci,2012,8(4):533-547.doi:10.7150/ijbs.3753.
[6]Konishi T,Shimada Y,Nagao T,et al.Antiproliferative sesquiter⁃pene lactones from the roots of Inula helenium[J].Biol Pharm Bull,2002,25(10):1370-1372.
[7]Liu L,Zuo LF,Wang J.Effects of Artesunate on membrane potential of mitochondria and cell apoptosis of Ec9706 cells[J].Med J Chin PLA,2014,39(1):25-29.[刘亮,左连富,王静.青蒿琥酯对食管癌Ec9706细胞线粒体膜电位及凋亡的影响[J].解放军医学杂志,2014,39(1):25-29].doi:10.11855/j.issn.0577-7402.2014.01.06
[8]Wang LJ,Tian KCh,Wu WW,et al.Recent advances on the signal transduction pathways of apoptosis[J].China Animal Husbandry& Veterinary Medicine,2011,38(10):132-134.[王力俭,田可川,吴伟伟,等.细胞凋亡信号传导通路的研究进展[J].中国畜牧兽医,2011,38(10):132-134].
[9]Zhu YSh,Lu TY,Wang R,et al.Functional conversion of Bcl-2 into a pro-apoptotic molecule to regulate mitochondrial cytochrome c release[J].Chinese Bulletin of Life Sciences,2011,23(11):1076-1080.[朱玉山,卢铁元,王蕊,等.Bcl-2家族蛋白调控线粒体膜通透性和细胞色素C释放的新机制[J].生命科学,2011,23(11):1076-1080].
[10]Zinkel S,Gross A,Yang E.BCL2 family in DNA damage and cell cycle control[J].Cell Death Diffe,2006,13(8):1351-1359.
[11]Murray AW.Recycling the cell cycle:cyclins revisited[J].Cell,2004,116(2):221-234.
[12]Zhou M,Zhou CX.Advances on effect of traditional Chinese medi⁃cine on cancel cell cycle[J].Global Traditional Chinese Medicine,2014,7(10)813-816.[周曼,周春祥.中药对肿瘤细胞周期影响的研究进展[J].环球中医药,2014,7(10)813-816].doi:10.3969/j. issn.1674-1749.2014.10.029.
(2015-01-06收稿2015-04-22修回)
(本文编辑李鹏)
The effects and mechanism of artesunate inhibiting the proliferation and inducing the apoptosis of UM-SCC-10A cells
ZHAO Yan,LI Lihua△,ZHAO Song
Scientific Experimental Center of Liaoning Medical University,Jinzhou 121001,China△
ObjectiveTo study the influence of artesunate(Akt)on the proliferation and apoptosis of human head and neck squamous cell carcinoma(HNSCC),and to explore its molecular mechanism thereof.MethodsThe HNSCC cell line,UM-SCC-10A cells,was cultured in vitro.The Inhibitory concentration 50(IC50)was examined by MTT assay.The cell mor⁃phological changes were observed under inverted light micro-scope after being interfered by 0,2.5,5,10,20 and 40 μmol/L Akt.Cell cycle changes and apoptosis were measured by flow cytometry.And the expression of cell cycle regulators and apop⁃totic associated protein were detected by Western blot assay.ResultsMTT assay demonstrated that Akt significantly inhib⁃ited the proliferation of UM-SCC-10A cells in dose-dependent manner.After UM-SCC-10A cells were treated with Akt for 48 h,IC50was 15.01 μmol/L.Morphological changes of cell apoptosis such as karyopyknosis and conglomeration were ob⁃served by Hoechst 33258 staining.Flow cytometry showed that the apoptosis was associated with cell cycle arrest during the G1 phase.Western blot analysis showed that p53 and p21 protein was up-regulated and Cyclin D protein was down-regulat⁃ed.Furthermore,results revealed that Bcl-2 associated X protein induced by a mitochondrial pathway,cytochrome C and caspase-3 were up-regulated,and Bcl-2 and procaspase-3 were down-regulated.The mitochondrial membrane potential was reduced.ConclusionArtesunate can induce apoptosis of UM-SCC-10A cells via a mitochondrial pathway,which was associated with cell cycle arrest in the G1 phase.As a result,artesunate has an obvious inhibitory effects on proliferation of UM-SCC-10A cells.
apoptosis;cell proliferation;head and neck neoplasms;Artesunate
R739.91
A
10.11958/j.issn.0253-9896.2015.09.004
辽宁省教育厅优秀人才成长计划项目(LJQ2012074)
辽宁锦州,辽宁医学院科学实验中心(邮编121001)
赵艳(1973),女,本科,医学硕士学位,主要从事中药研究
△通讯作者E-mail:lilihua1018@sina.com
