靶向肿瘤坏死因子β小分子抑制剂的筛选及其功能鉴定
2015-11-18孙亚薇公海艳曹善楠刘鹏朱海燕耿广锋许元富
孙亚薇,公海艳,曹善楠,刘鹏,朱海燕,耿广锋,许元富
细胞与分子生物学
靶向肿瘤坏死因子β小分子抑制剂的筛选及其功能鉴定
孙亚薇,公海艳,曹善楠,刘鹏,朱海燕,耿广锋,许元富△
目的通过计算机虚拟筛选和细胞活性筛选,获得能靶向抑制肿瘤坏死因子β(TNFβ)的细胞毒活性的小分子抑制剂。方法根据TNFβ与肿瘤坏死因子Ⅰ型受体(TNFR1)结合的复合晶体结构,采用计算机虚拟筛选方法初步选择对接结果较好的105个小分子化合物(C1~C105),并对其进行细胞活性筛选;MTT法检测小分子化合物抑制TNFβ对L929细胞的细胞毒性;流式细胞术测定小分子化合物对TNFβ引起的细胞凋亡的抑制作用;采用碘化丙啶(PI)单染和流式分析技术检测小分子化合物对L929细胞周期的影响;采用Western blot和双转盘激光共聚焦显微镜分析小分子化合物对TNFβ引起的下游Caspase 3活化的抑制作用。结果C35能有效抑制TNFβ引起的细胞毒作用,且这种抑制作用呈现剂量依赖性(半数抑制浓度=8.19 μmol/L);C35具有较低的细胞毒性,且对L929细胞周期无影响;C35能阻断TNFβ与其受体结合后引起的细胞凋亡通路,显著抑制TNFβ引起的L929细胞凋亡。结论成功筛选到一个TNFβ小分子抑制剂C35,其能阻断TNFβ引起的细胞凋亡通路,高效抑制TNFβ的细胞毒活性。
淋巴毒素α;受体,肿瘤坏死因子,Ⅰ型;细胞凋亡;细胞周期;肿瘤坏死因子β;小分子抑制剂;信号通路
肿瘤坏死因子(TNF)β,又名淋巴毒素α(lympho⁃toxin α,LTα),主要由激活的淋巴细胞分泌,能抑制恶性肿瘤细胞生长,与TNFα同属肿瘤坏死因子超家族[1]。TNF家族成员中被研究的较为广泛和深入的是TNFα,研究发现TNFα与类风湿性关节炎、强直性脊柱炎、炎症性肠炎、银屑病、多发性硬化、急性肝炎等疾病的发生具有重要关系[2-3];而关于TNFβ的研究较少,近年来研究发现TNFβ与许多疾病的发生发展具有重要的相关性,如移植物抗宿主病(graft-versus-host disease,GVHD)、类风湿性关节炎、高血钙症等[4]。目前市场上尚无针对TNFβ开发的特异性药物,只有极个别针对TNFα的大分子受体样药物可同时抑制TNFα和TNFβ的细胞毒性,如Etanercep(t伊纳西普)[4]。虽然大分子药物具有一些独特的优势,如靶向性强、半衰期长、临床疗效明显,但其也有一些难以克服的缺陷,如稳定性差、生产和治疗成本高、难以透过血脑屏障、不能口服使用、长期应用会导致中和性抗体的产生和药物的耐受等。因此,研制特异性抑制TNFβ的小分子抑制剂尤为重要。本研究基于TNFβ与肿瘤坏死因子Ⅰ型受体(TNFR1)结合的复合晶体结构,采用计算机虚拟筛选结合细胞活性筛选的方法,从已有的含有9万个小分子的化合物数据库中,筛选靶向TNFβ的特异性小分子抑制剂,以期为基础和临床研究TNFβ相关疾病提供实践经验和靶向药物。
1 材料与方法
1.1 材料
1.1.1 主要试剂RPMI-1640培养基干粉及胎牛血清(FBS)购自GIBCO公司;TNF β(1 μg/L)、TNF βAntibody(1 mg/L)购于Peprotech公司,放线菌素D(ActD,1 mg/L)、MTT、DMSO购于Sigma公司(CA,US);胰酶购自Hyclone公司;C35及其他小分子化合物购于Specs公司,纯度均大于99%。Annexinⅴ-PI细胞凋亡试剂盒和周期检测试剂盒购自BD公司;抗Caspase 8、Caspase 3、cleaved caspase 8、cleaved caspase 3、GAPDH的兔源一抗购自Cell Signal Tech⁃nology公司;辣根过氧化物酶(HRP)标记的羊抗兔二抗购自北京中山金桥生物技术有限公司;ECL免疫印迹底物、BCA蛋白定量试剂盒购自Pierce公司;PVDF膜购自Millipore公司;RIPA裂解液(中)、PMSF、柯达底片购自碧云天生物技术研究所。
1.1.2 主要仪器CO2孵箱购自美国Thermo Fisher公司;倒置显微镜购自日本OLYMPUS公司;流式细胞仪(LSRⅡ)购自BD公司;蛋白电泳仪以及转膜仪购自美国BIO-RAD公司;双转盘激光扫描共聚焦显微镜购自德国Leica公司。
1.1.3 细胞株小鼠的成纤维细胞株L929由本实验室保存。取对数生长期的L929细胞用于实验。
1.2 方法
1.2.1 C1~C105号小分子抑制剂的细胞活性筛选采用计算机虚拟筛选方法对含有约9万个小分子的三维数据库进行分子对接筛选,选择对接结果较好的105个小分子化合物进行生物活性筛选实验。取L929细胞以1×104个/孔细胞接种于96孔板中,于37℃5%CO2培养箱中培养24 h后,加入终浓度1 mg/L的ActD及1 μg/L的TNFβ,同时分别加入C1~C105号小分子化合物,均设0.4、4、20 μmol/L 3个浓度梯度。置于细胞培养箱中培养。20 h后取出,每孔加入20 μL MTT,继续培养4 h,弃上清,每孔加150 μL DMSO,充分溶解后在酶标仪测每孔光密度(OD)546的读数。计算细胞存活率=(ODActD+TNFβ+compound-ODblank)/(ODActD-ODblank)×100%。
1.2.2 MTT法检测C35对TNFβ介导的细胞毒作用取L929细胞以1×104个/孔细胞接种于96孔板中,于37℃5% CO2培养箱中培养24 h。将C35号小分子化合物与1 mg/L的ActD及1 μg/L的TNFβ室温共孵育30 min后加入其中,分别设C35号化合物的终浓度为100、25、6.4、1.6、0.4及0.1 μmol/ L,每个浓度设3个复孔。按1.2.1操作计算细胞存活率,并用Graghpad Prism5软件计算C35的半数抑制浓度(IC50)。
1.2.3 C35对TNFβ介导的细胞凋亡的抑制实验取L929细胞以1×106个/皿细胞接种于5个10 cm细胞培养皿中,于37℃5%CO2培养箱中培养24 h后加入不同药物组合,继续培养12 h后取出,倒置显微镜下观察各组细胞形态。实验设Control组(ActD)、TNFβ组(ActD+TNFβ)、TNFβ+A8组(阴性化合物对照组,ActD+TNFβ+A8)、TNFβ+C35组(ActD+TNFβ+ C35)、TNFβ+Antibody组(阳性对照组,ActD+TNFβ+anti-TNFβ Antibody)。收集各皿细胞制成单细胞悬液,按照BD公司Annexinⅴ-PI细胞凋亡试剂盒对各组细胞进行标记,后经滤网过滤后流式细胞仪测定各组细胞发生凋亡的百分数。
1.2.4 C35对L929细胞周期的影响采用碘化丙啶(PI)单染和流式分析技术检测小分子化合物对L929细胞周期的影响。取L929细胞以1×106个/皿细胞接种于5个10 cm细胞培养皿中,于37℃5%CO2培养箱中培养24 h后加入不同药物组合。实验设Blank组(不加任何药物处理)、ActD组、C35组、ActD+C35组、ActD+C35+TNFβ组。按照BD公司细胞周期检测试剂盒说明书测定各组细胞周期,用尼龙网过滤样品,流式细胞仪测定各组细胞的细胞周期。
1.2.5 C35对TNFβ下游Caspase 3活化的抑制实验(1)Western blot法。细胞接种培养和分组操作同1.2.3。细胞继续孵育2、8、12 h时收集细胞,RIPA裂解,离心后收集上清液,BCA法测定各组蛋白浓度,Western blot法分析各组蛋白表达情况。(2)免疫荧光法。取L929细胞以1×105个/皿细胞接种于共聚焦小皿中,分组操作同1.2.3。参照文献[5]的方法进行免疫荧光染色,置于双转盘激光共聚焦显微镜上检测。
1.3 统计学方法采用SPSS 17.0软件包进行数据分析,数据采用表示,组间比较采用单因素方差分析,组间多重比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 C1~C105号小分子抑制剂的细胞活性筛选结果C35化合物在20 μmol/L时对TNFβ有较好的抑制效果,细胞存活率可达90%以上,C27和C36在20 μmol/L时也有一定的抑制效果,细胞存活率分别为38.5%±2.38%和59.1%±8.24%,其余对TNFβ细胞毒性的抑制效果不明显或无抑制效果,见图1。
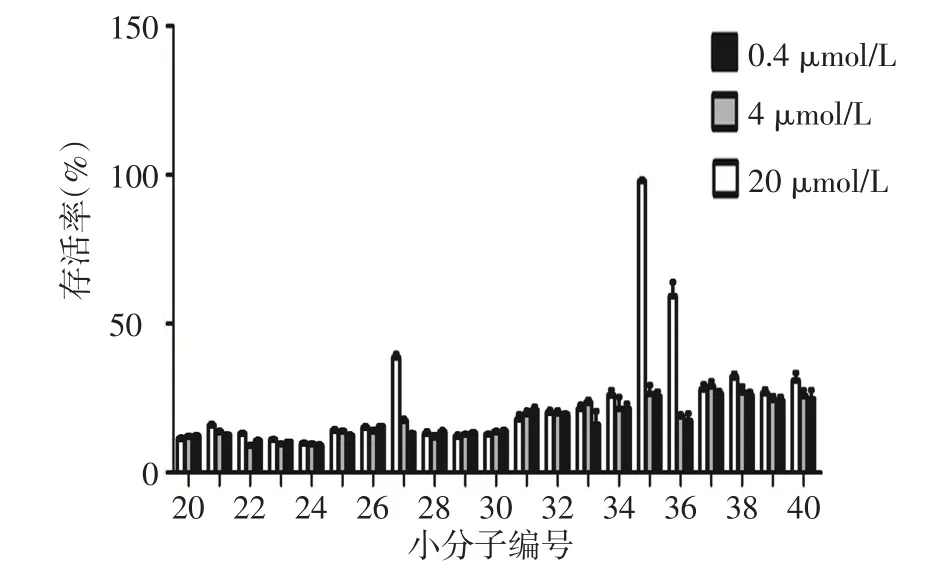
Fig.1 Biological activity screening for TNFβ small-molecule inhibitor图1 TNFβ小分子抑制剂的细胞活性筛选
2.2 C35对TNFβ介导的细胞毒作用的抑制实验结果C35浓度为0.1、0.4、1.6、6.4、25和100 μmol/L时,细胞存活率分别为(19.80±5.37)%、(19.18± 6.68)%、(24.74±0.23)%、(32.12±4.26)%、(97.74± 10.13)%和(95.73±4.42)%。由此可见,C35对TNFβ细胞毒性的抑制作用呈现剂量依赖性,且在100 μmol/L时未见C35自身的细胞毒性。IC50为8.19 μmol/L。
2.3 C35对TNFβ介导的细胞凋亡的抑制实验结果光镜下可见Control组细胞生长状态良好,多数细胞为梭形或三角形,边缘清晰;而TNFβ组和TNFβ+A8组细胞多数死亡,镜下可见很多细胞碎片;TNFβ+C35组和TNFβ+Antibody组细胞生长较好,细胞形态接近Control组,见图2。TNFβ+C35、TNFβ+Antibody组细胞存活率(92.03%±4.80%、91.10%±6.76%)均高于TNFβ组(27.57%±3.92%)和TNFβ+A8组(32.97%±9.05%),与Control组(94.33%±2.61%)差异无统计学意义;TNFβ+C35组与TNFβ+Antibody组、TNFβ+A8与TNFβ组间差异均无统计学意义(F=101.931,P<0.01),见图3。
2.4 C35对细胞周期的影响各组间L929细胞周期分布差异无统计学意义,见表1。
2.5 Western Blot检测结果与Control组相比,TNFβ刺激L929细胞8 h和12 h后,TNFβ组和TNFβ+A8组中均出现切割活化的Caspase 3片段,而TNFβ+C35组和TNFβ+Antibody组Caspase 3未出现切割活化,见图4。
2.6 免疫荧光检测结果Control组细胞轮廓清晰,状态良好,细胞骨架完整;与Control组相比,TNFβ刺激L929细胞8 h后,TNFβ组和TNFβ+A8组出现切割活化的Caspase 3蛋白,且细胞骨架被破坏;而TNFβ+C35组和TNFβ+Antibody组细胞状态良好,并未出现活化的Caspase 3蛋白,见图5。
Tab.1 Comparison of the L929 cell cycle distributions after different treatments between five groups表1 不同药物组处理后L929细胞周期分布的比较(n=3,%,)
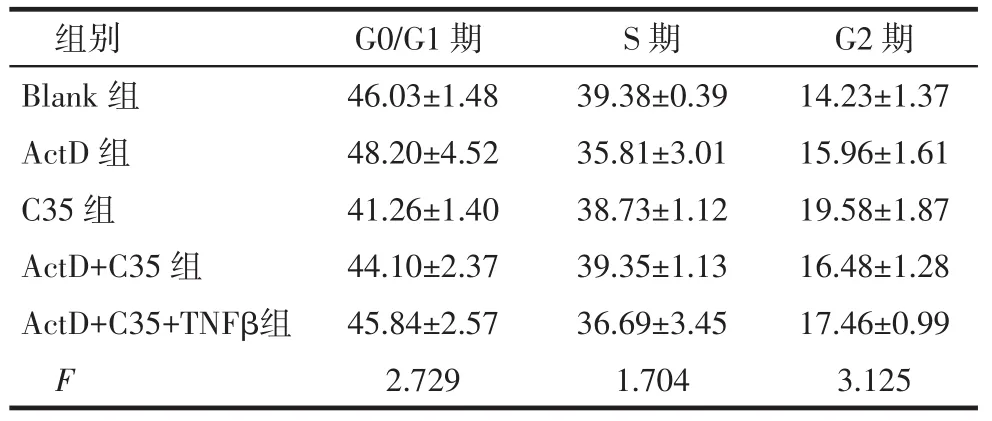
Tab.1 Comparison of the L929 cell cycle distributions after different treatments between five groups表1 不同药物组处理后L929细胞周期分布的比较(n=3,%,)
均P>0.05
组别Blank组ActD组C35组ActD+C35组ActD+C35+TNFβ组F G0/G1期46.03±1.48 48.20±4.52 41.26±1.40 44.10±2.37 45.84±2.57 2.729 S期39.38±0.39 35.81±3.01 38.73±1.12 39.35±1.13 36.69±3.45 1.704 G2期14.23±1.37 15.96±1.61 19.58±1.87 16.48±1.28 17.46±0.99 3.125
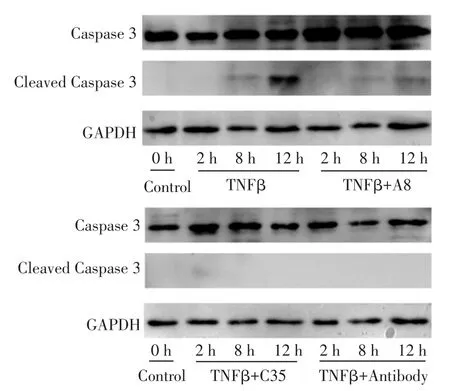
Fig.4 Western blot analysis of inhibitory effect of C35 on TNFβinduced activation of Caspase 3图4 C35抑制TNFβ介导的下游Caspase 3活化的Western blot检测结果
3 讨论
TNFβ主要是由激活的T和B淋巴细胞分泌的细胞因子,与TNFα具有相同的受体,即TNFR1和TNFR2,TNFα和TNFβ与受体结合后均能引起细胞凋亡、坏死及其下游炎症信号通路的活化[6]。近年来研究发现TNFβ参与类风湿关节炎和GVHD等多种疾病的发生发展,并且有报道采用TNFβ的单克隆抗体治疗二型胶原诱导的小鼠关节炎疗效显著[7]。Markey等[8]研究发现将TNFβ敲除的B6鼠的骨髓移植到BALB/c小鼠体内后发生GVHD的概率大大降低,提示供者来源细胞产生的TNFβ是GVHD发生的重要原因之一。目前,已有针对TNF受体下游信号通路中某些分子的小分子抑制剂的研究,如P38抑制剂、JNK抑制剂(tofacitinib)等[9],但其特异性较差,不良反应较大,而解决上述问题的可行方案之一就是研制直接靶向结合TNFβ的小分子抑制剂。
本研究根据已经获得的TNFβ与TNFR1结合的复合晶体结构,选择受体TNFR1蛋白第二结构域第二环中的一个七肽片段(RKEMGQV)作为分子对接(docking)的模板[10-11],采用计算机虚拟筛选方法对含有约9万个小分子的三维数据库进行分子对接筛选,选择对接结果较好的105个化合物进行初步的抑制TNFβ细胞毒活性的实验。结果表明,C35能较好地抑制TNFβ的细胞毒作用,并呈现剂量依赖性。流式细胞术分析显示,TNFβ+C35组细胞存活率明显高于TNFβ组,提示C35能够有效抑制TNFβ介导的L929细胞的凋亡。细胞周期实验结果显示,无论是单加C35还是与其他药物一起加入,其对L929细胞G1、S、G2期的影响均不明显,提示C35并不是通过促进细胞增殖来提高细胞存活率的。
TNFβ与TNFR结合后,可以激活促凋亡相关信号级联反应,最终引起下游Caspase 3的活化,导致细胞凋亡的发生[5]。本研究结果显示,TNFβ刺激L929细胞8 h后,TNFβ组和TNFβ+A8组Caspase 3出现切割活化,而TNFβ+C35组和TNFβ+Antibody组Caspase 3未活化,提示C35与TNFβ抗体均可有效地抑制TNFβ下游Caspase 3的切割活化。考虑到Western Blot检测的是细胞群体某一蛋白表达量的变化,并不能直观地反映到每个细胞的变化水平,因此本研究又采用共聚焦显微镜结合细胞免疫染色的方法,进一步从单细胞水平验证C35对TNFβ信号通路的抑制作用。结果显示,TNFβ刺激L929细胞8 h后,TNFβ组和TNFβ+A8组出现活化的Cas⁃pase 3蛋白片段,且完整的细胞骨架被破坏;而TNFβ+C35组和TNFβ+Antibody组细胞状态均良好,并未见活化的Caspase 3蛋白,提示C35可以在单细胞水平上较好地抑制TNFβ介导的下游Cas⁃pase 3的切割活化。
综上所述,本研究用计算机虚拟筛选结合细胞活性筛选得到的小分子化合物C35能与TNFβ靶向结合,较好地抑制TNFβ介导的细胞毒作用,同时有效阻断TNFβ下游级联信号通路的活化。C35模拟TNFR1蛋白第二结构域的第二Loop环的一个七肽片段(RKEMGQV,No.77-83),以此作为分子对接的模板,与TNFβ直接结合,具有高度特异性和原始创新性。目前本课题组正在进一步进行相关的体内试验,有望为今后靶向TNFβ的小分子抑制剂的研究提供理论基础和实践经验,为临床相关疾病的治疗提供新思路。
(图2、3、5见插页)
[1]Aggarwal BB,Gupta SC,Kim JH.Historical perspectives on tumor necrosis factor and its superfamily:25 years later,a golden journey[J].Blood,2012,119(3):651-665.doi:10.1182/blood-2011-04-325225.
[2]Davis JM,Colangelo J.Small-molecule inhibitors of the interaction between TNF and TNFR[J].Future Med Chem,2013,5(1):69-79. doi:10.4155/fmc.12.192.
[3]Buhrmann C,Shayan P,Aggarwal BB,et al.Evidence that TNFβ(lymphotoxinα)can activate the inflammatory environment in hu⁃man Chondrocytes[J].Arthritis Res Ther,2013,15(6):R202.
[4]Buch MH,Conaghan PG,Quinn MA,et al.True infliximab resis⁃tance in rheumatoid arthritis:a role for lymphotoxin alpha[J]?Ann Rheum Dis,2004,63(10):1344-1346.doi:10.1136/ard.2003. 014878.
[5]Ma L,Gong H,Zhu H,et al.A novel small-molecule tumor necrosis factor α inhibitor attenuatesinflammation in a hepatitis mouse model[J].J Biol Chem,2014,289(18):12457-12466.doi:10.1074/ jbc.M113.521708.
[6]Etemadi N,Holien JK,Chau D,et al.Lymphotoxin α induces apop⁃tosis,necroptosis and inflammatory signals with the same potency as tumour necrosis factor[J].FEBS J,2013,280(21):5283-5297. doi:10.1111/febs.12419.
[7]Saito H,Kojima T,Takahashi M,et al.A tumor necrosis factor re⁃ceptor loop peptide mimic inhibits bone destruction to the same ex⁃tent as anti-tumor necrosis factor monoclonal antibody in murine collagen-induced arthritis[J].Arthritis Rheum,2007,56(4):1164-1174.doi:10.1002/art.22495.
[8]Markey KA,Burman AC,Banovic T,et al.Soluble lymphotoxin is an important effector molecule in GVHD and GVL[J].Blood,2010,115(1):122-132.doi:10.1182/blood-2009-01-199927.
[9]Ho LJ,Lai JH.Small-molecule inhibitors for autoimmune arthri⁃tis:Success,failure and the future[J].Eur J Pharmacol,2015,747:200-205.doi:10.1016/j.ejphar.2014.08.031.
[10]Mukai Y,Nakamura T,Yoshikawa M,et al.Solution of the structure of the TNF-TNFR2 complex[J].Sci Signal,2010,3(148):ra83.doi:10.1126/scisignal.2000954.
[11]Takasaki W,Kajino Y,Kajino K,et al.Structure-based design and characterization of exocyclic peptidomimetics that inhibit TNF alpha binding to its receptor[J].Nat Biotechnol,1997,15(12):1266-1270.doi:10.1038/nbt1197-1266.
(2015-02-11收稿2015-04-14修回)
(本文编辑陈丽洁)
Screening and identification of a novel small-molecule TNFβ inhibitor
SUN Yawei,GONG Haiyan,CAO Shannan,LIU Peng,ZHU Haiyan,GENG Guangfeng,XU Yuanfu△
State Key Laboratory of Experimental Hematology,Institute of Hematology and Blood Diseases Hospital,Chinese Academy of Medical Sciences and Peking Union Medical College,Tianjin 300020,China△
ObjectiveTo explore a novel and highly specific small-molecule TNFβ inhibitor by using computer-aid⁃ed virtual screening and cell-based assays in vitro.MethodsComputer-aided drug design and virtual screening were used to design and identify chemical compounds that targeted TNFβ based on the crystal structure of the TNFβ-TNFR1 com⁃plex.The effect of the small-molecule compound against TNFβ-induced cytotoxicity of L929 cells was detected by MTT as⁃say,and the efficacy of the compound to inhibit TNFβ-induced apoptosis of L929 cells was determined by flow cytometry as⁃say.The impact of the compound on L929 cell cycle was examined by Propidium Iodide(PI)staining and flow cytometry,and the influence of the compound on TNFβ-triggered signal pathway was analyzed by Western blot assay and Ultra VIEW VOX 3D Live Cell Imaging System.ResultsNo.35 compound(named as C35 thereafter)could effectively inhibit TNFβ-induced cell death in a dose dependent manner,and the half-maximum inhibition concentration(IC50)was 8.19 μmol/L.Furthermore,C35 had lower cytotoxicity and minimal effect on L929 proliferation.Here we further revealed that C35 could affect TNFβinduced apoptotic pathway by blocking the activation of Caspase 3,and markedly reduce L929 cell apoptosis induced by TNFβ.ConclusionA novel TNFβ small-molecule inhibitor was identified by combining computer-aided virtual screening with functional assays,and which could block TNFβ-triggered apoptotic pathway and efficiently inhibit the cell death in⁃duced by TNFβ.
lymphotoxin-alpha;receptors,tumor necrosis factor,type I;apoptosis;cell cycle;TNFβ;small molecular inhibitor;signal pathway
R730.231;R730.1
A
10.11958/j.issn.0253-9896.2015.09.001
国家自然科学基金资助项目(31271484,31471116);天津市自然科学基金重点基金(12JCZDJC24600);北京协和医学院研究生创新基金(100023-0710-1013)
中国医学科学院,北京协和医学院血液病医院(血液学研究所),实验血液学国家重点实验室(邮编300020)
孙亚薇(1988),女,硕士在读,主要从事肿瘤坏死因子的小分子抑制剂的研究
△通讯作者E-mail:xuyf@ihcams.ac.cn
