α27基因特异性siRNA对单纯疱疹病毒Ⅱ型感染宿主细胞的影响
2015-11-15杨兆林赵少锋邵艳玲
杨兆林 陈 茵 汪 莉 赵少锋邵艳玲
广州医科大学附属广佛医院广东省佛山市南海区第二人民医院妇产科,广东佛山528251
α27基因特异性siRNA对单纯疱疹病毒Ⅱ型感染宿主细胞的影响
杨兆林 陈 茵 汪 莉 赵少锋▲邵艳玲
广州医科大学附属广佛医院广东省佛山市南海区第二人民医院妇产科,广东佛山528251
目的探讨在RNA干扰技术条件上,干扰α27基因表达对单纯疱疹病毒Ⅱ型(HSV-Ⅱ)宿主细胞的影响。方法体外合成四对α27基因特异性siRNA(R1、R2、R3、R4组)和阳性、阴性对照siRNA,用Lipofectamine2000转染Vero细胞后接种HSV-Ⅱ,感染后用MTT比色法分别于12、24、36、48、60、72 h测定细胞的存活情况。结果转染了特异性siRNA的细胞OD值较空白组高,细胞存活情况较好,其中R2和R4组存活情况更好。结论α27基因特异性siRNA对宿主细胞具有保护作用。按照同样设计原则合成的不同序列siRNA,其抑制效果存在明显差异。
α27基因;siRNA;RNA干扰;单纯疱疹病毒Ⅱ型;Vero细胞
生殖器疱疹(genital herpes,GH)是由单纯疱疹病毒(herpes simplex virus,HSV)感染生殖器和肛门部位皮肤、黏膜而引起的一种慢性、易复发的性传播疾病。GH的病原体90%为HSV-Ⅱ型[1]。HSV-Ⅱ基因组为一线性双链DNA分子,根据基因表达时序的不同,分为立即早期、早期、晚期基因,分别称为α、β、γ基因,分别编码立即早期蛋白、早期蛋白及晚期蛋白。立即早期基因的转录出现在病毒DNA复制之前,调节β、γ基因的表达。迄今为止,人们已知的HSV编码的立即早期蛋白有5个,它们被称为感染细胞多肽分子(infected cell polypeptides,ICPs),包括ICP0、ICP4、ICP22、ICP27和ICP47[2]。从位置上看,α27基因又称为UL54,它编码的ICP27具有复杂的调节作用,是唯一能在疱疹病毒的每个亚科找到其同源蛋白的α蛋白[3-5]。最近研究发现,ICP27能够通过调节宿主mRNA的代谢过程,抑制宿主细胞蛋白的合成,本研究利用RNA干扰技术,观察抑制α27基因表达对HSV-Ⅱ宿主细胞的影响,为保护宿主细胞提供新靶点。
1 材料与方法
1.1 病毒悬液及细胞株
所用病毒为临床株,经测定组织培养半数感染量(50%tissue culture infective dosage,TCID50)为10-5.166。Vero细胞株:非洲绿猴肾细胞,购自中山大学北校区动物实验中心,传代培养保存。
1.2 siRNA合成
由上海吉玛制药技术有限公司代为设计合成四对α27基因特异性siRNA(R1、R2、R3、R4组)和阳性对照组、阴性对照组siRNA。阳性对照为文献报道的针对UL29基因(编码一种DNA结合蛋白)有效的siRNA序列[6]。阴性对照和选中的siRNA序列有相同的组成,序列打乱,但是和该基因mRNA没有同源性。其中:阳性对照组:sense 5′-UU UCG CAA UCA AUU CCA ATT-3′,antisense 5′-UG GAA UUG AUU GCG AAA GTT-3′;阴性对照组:sense 5′-UUC UCC GAA CGU GUC ACG UTT-3′,antisense 5′-ACG UGA CAC GUU CGG AGA ATT-3′;荧光阴性对照:sense 5′-UUC UCC GAA CGU GUC ACG UTT-3′,antisense 5′-ACG UGA CAC GUU CGG AGA ATT-3′;R1组920:sense 5′-CGU CGG GUU UCC UGG GAA ATT-3′,Antisense 5′-UUU CCC AGG AAA CCC GAC GGG-3′;R2组1326:sense 5′-GCG UGU CGG AGA UCG ACU ATT-3′,antisense 5′-UAG UCG AUC UCC GAC ACG CCG-3′;R3组748:sense 5′-GGC GGU UCU GAG AUC CAU ATT-3′,antisense 5′-UAU GGA UCG CAG AAC CGC CCG-3′;R4组1405:sense 5′-GGC GGG UCU CAU UGA AAU ATT-3′,antisense 5′-UAU UUC AAU GAG ACC CGC CAT-3′。
1.3 细胞的培养
Vero细胞用10%胎牛血清的低糖DMEM培养基培养[7-8],用胰蛋白酶+EDTA消化后,以0.5×105/ml的密度接种于24孔板中,每孔加入500 μl无抗生素培养基,细胞长到融合率为50%~60%时进行转染,取0.5、1.0、1.2、1.5 μl/孔的Lipofectanmine2000及1.0、1.5、2.0、2.5 μl/孔的FAM-siRNA,进行两两组合,每种组合种4个复孔。通过荧光显微镜下观察和流式细胞仪检测各种组合转染效率,以最优转染效率的组合浓度进行下一步转染。
1.4 细胞的转染
将siRNA转染试剂混合液加入含有细胞及不含血清的培养液,共6组siRNA(阳性对照组、阴性对照组、R1组920、R2组1405、R3组748、R4组1326)。同时设空白组,即不加转染试剂及siRNA,同等条件下加入不含血清的培养液。
1.5 HSV-Ⅱ的接种
转染过的Vero细胞,每孔接种100个量的TCID50/ 100 μl HSV-Ⅱ,分别于12、24、36、48、60、72 h时观察细胞病变[9]。
1.6 MTT比色法测定细胞活力
按上述24孔板转染的浓度换算,96孔板中每孔加入0.25 μl/孔的Lipofectanmine2000及0.4 μl/孔的siRNA,每组种5个复孔,同时设空白组,接种HSV-Ⅱ后每隔12 h用MTT比色法测定各孔细胞比色值,并绘制细胞生长曲线图。
1.7 统计学方法
采用统计软件SAS 8.0对实验数据进行分析,计量资料数据以均数±标准差(x±s)表示,多组间比较采用方差分析,两两比较采用LSD-t检验。计数资料以率表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 siRNA的转染率
在荧光显微镜下观察发现,1 μl/孔Lipofectamine 2000、2 μl/孔siRNA(40 nmol/L)的转染孔中荧光效果最好(图1、2)。流式细胞仪检测发现其转染率为76.27%~90.66%(图3、4)。
图1 转染后荧光显微镜下的细胞(×200)

图2 同一视野下的细胞(×200)

图3 FAM-siRNA转染结果(转染率为90.66%)
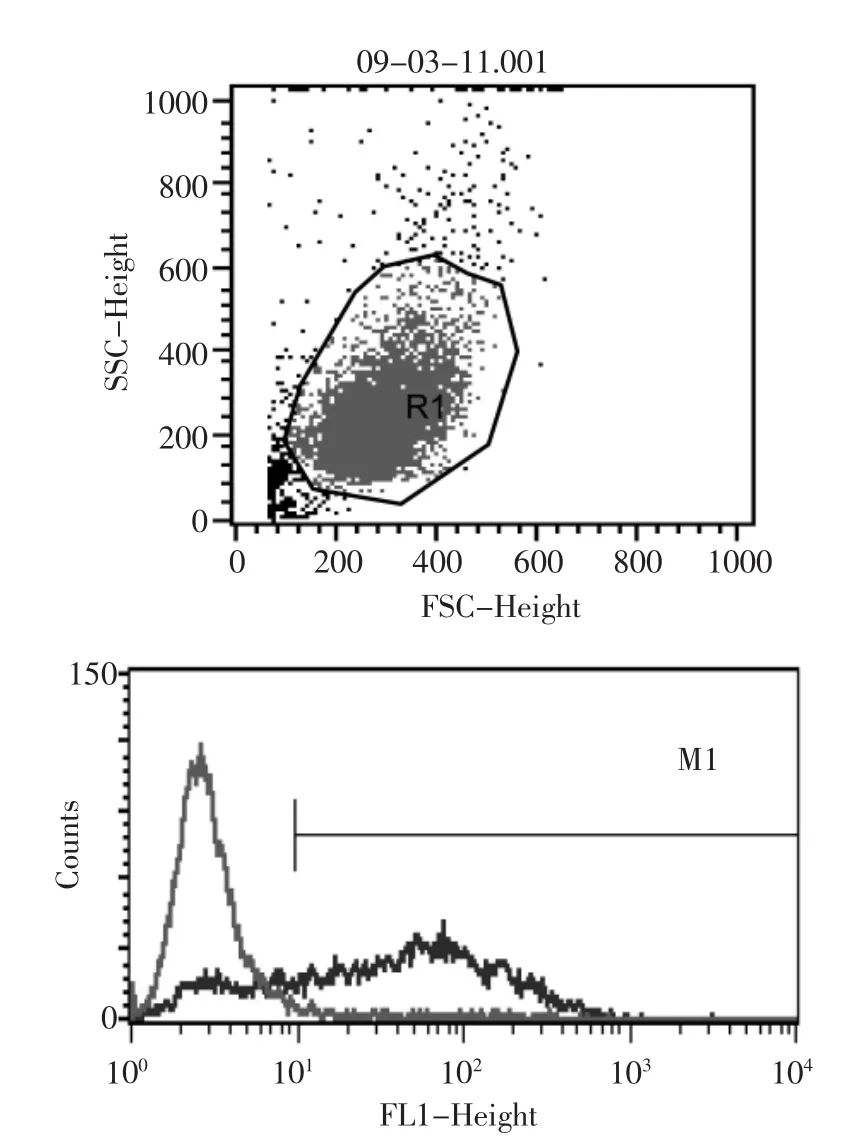
图4 FAM-siRNA转染结果(转染率为76.27%)
2.2 病毒感染后细胞的病变情况
60~72 h时,各转染组所测OD值均较空白组高(P<0.05)。R2组和R4组在24 h之后(除48 h),所测得OD值明显高于空白组,差异均有统计学意义(P<0.05)。而R1组、R3组和阳性对照组在12~48 h所测得OD值与空白组比较,差异均无统计学意义(P>0.05)。阴性对照组在12、60、72 h时所测OD值均高于空白组(P<0.05),在其他时间所测的OD值均与空白组相当(P>0.05)。MTT比色法测得各时间点各组细胞活力情况见表1。各组数据进行随机区组方差分析,结果见表2。以时间点为横轴,OD值的平均值为纵轴,绘制细胞生长曲线图,见图5,各组细胞由于病毒的感染,细胞均逐渐出现病变,曲线呈现缓慢的下滑趋势。R2组、R4组和阳性对照组的细胞生长曲线总体高于空白组,而其他组的生长曲线介于上述各组与空白组之间。

表1 各组在各个时间点的细胞活力(OD值,x±s)

表2 随机区组方差分析表
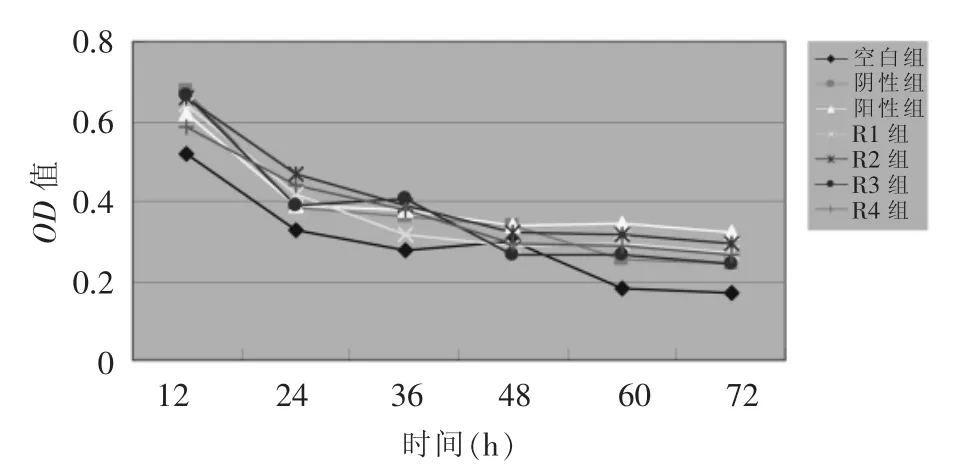
图5 MTT法测定下细胞生长曲线
3 讨论
HSV-Ⅱ在与宿主细胞相互作用的过程中,ICP27通过抑制宿主细胞原始RNA的剪接和加尾等成熟过程,与UL41基因编码的病毒宿主关闭蛋白(virion host shutoff protein,VHS蛋白)共同调节宿主mRNA的代谢过程,抑制宿主细胞蛋白的合成[10-11]。RNA干扰(RNA interference,RNAi)技术具有高度的序列特异性,作用效果类似于基因敲除,是近年来用于研究基因筛选、功能鉴定以及基因治疗的先进技术[12-15]。
本研究表明,利用RNAi干扰技术特异性干扰HSV-Ⅱ病毒α27基因编码的ICP27合成,可阻断ICP27干扰的宿主细胞mRNA代谢,干扰其对宿主蛋白合成的抑制,明显抑制宿主细胞的病变,从而起到保护宿主细胞的作用。
在实验过程中发现4对针对α27基因的特异性siRNA,虽然按照同样的设计原则进行设计,然而作用效果存在明显差异,R2和R4组干扰效果比其他两组好,分析其可能的原因有:RNAi的过程可能存在更为复杂的作用机制;某些靶序列存在蛋白结合位点,或者某些siRNA序列容易形成茎环结构,阻止了siRNA与特异性mRNA的结合;某些特异性序列的siRNA更为不稳定,容易被RNA酶降解[16-20]等,这些有待今后进一步研究。
总之,本研究构建了针对HSV-Ⅱ型病毒α27基因的特异性siRNA,筛选出了有效的、可特异性抑制α27基因表达的siRNA,证实了α27基因的特异性siRNA可保护HSV-Ⅱ型感染的宿主细胞,为临床筛选抗HSV-Ⅱ药物新靶点提供了理论基础。
[1]王侠生,廖康煌.杨国亮皮肤病学[M].上海:上海科学技术文献出版社,2005:375-377.
[2]Song B,Yeh KC,Liu J,et al.Herpes simplex virus gene Products required for viral inhibition of expression of G1phase functions[J].J Virol,2001,290(2):320-328.
[3]Baumeister J,Klupp BG,Mettenleiter TC.Pseudorabies virus and equine herpes simplex virus 1 share a non-essential gene,which is absent in other herpesviruses and located adjacent to a highly conserved gene cluster[J].J Virol,1995,69(2):5560-5567.
[4]McCarthy AM,McMahan L,Schaffer PA.Herpes simplex virus type 1 ICP27 deletion mutants exhibit altered pattetns of transcription and are DNA deficient[J].J Virol,1989,63(1):18-27.
[5]Jean S,LeVan KM,Song B,et al.Herpes simplex virus 1 ICP27 is required for transcription of two viral late(gamma 2)genes in infected cells[J].J Virol,2001,283(5):273-284.
[6]Palliser D,Chowdhury D,Wang QY,et al.A siRNA-based microbicide protects mice fromlethal herpes simplex virus 2 infection[J].Nature,2006,439(9):89-94.
[7]田克恭.实验动物病毒性疾病[M].北京:农业出版社,1992:373-380.
[8]房廉洁,吕晓萍,董丽华.Vero细胞培养特性的研究[J].白求恩医科大学学报,2000,26(3):258-259.
[9]Brinker JP,Herrmann JE.Comparison of three monoclonal antibody-based enzyme immunoassays for detection of herpers simplex virus in clinical specimens[J].Clin Microbil Infect Dis,1995,14(4):314-317.
[10]Hardy WR,Sandri-Goldin RM.Herpes simplex virus inhibits host cell splicing and regulatory protein ICP27 is required for this effect[J].J Virol,1994,68(12):7790-7799.
[11]Smith IL,Hardwicke MA,Sandi-Goldin RM.Evidence that the herpes simplex virus early protein ICP27 acts post-transciptionally during infection to regulate gene expression[J].J Virol,1992,186(1):74-86.
[12]Khvorova A,Reynolds A,Jayasena SD.Functional siRNAs and miRNAs exhibit strand bias[J].Cell,2003,115(2):209-216.
[13]Schwarz DS,Hutvagner G,Du T,et al.Asymmetry in the assembly of the RNAi enzyme complex[J].Cell,2003,115(2):199-208.
[14]Hannon GJ.RNA interference[J].Nature,2002,418(6894):244-251.
[15]Bernstein E,Caudy AA,Hammond SM,et al.Role for a bidentate ribonuclease in the initiation step of RNA interference[J].Nature,2001,409(6818):363-366.
[16]Saxena S,Jonsson ZO,Dutta A.Small RNAs with imperfect match to endogenous mRNA repress translation.Implications for off-target activity of small inhibitory RNA in mammalian cells[J].J Biol Chem,2003,278(45):44312-44319.
[17]Amarzguioui M,Holen T,Babaie E,et al.Tolerance for mutations and chemical modifications in a siRNA[J].Nucleic Acid Res,2003,31(2):589-595.
[18]Lewis DL,Hagstrom JE,Loomis AG,et al.Efficient delivery of siRNA for inhibition of gene expression in postnatal mice[J].Nat Genet,2002,32(1):107-108.
[19]Patzel V,Rutz S,Dietrich I,et al.Design of siRNAs producing unstructured guide-RNAs results in improved RNA interference efficiency[J].Nat Biotechnol,2005,23(11):1440-1444.
[20]McManusMT,SharpPA.Genesilencinginmammalsbysmall interfering RNAs[J].Nat Rev Genet,2002,3(10):737-747.
Effect of α27-specific siRNA on host cells infecting by herpes simplex virus typeⅡ
YANG Zhao-linCHEN YinWANG LiZHAO Shao-feng▲SHAO Yan-ling
Department of Gynaecology and Obstetrics,Guangfo Hospital Affiliated to the Guangzhou University of Medical Science the Second People's Hospital of Nanhai District in Foshan City,Guangdong Province,Foshan528251,China
Objective To determine the effect of α27-specific siRNA on host cells infecting by herpes simplex virus typeⅡ(HSV-Ⅱ).Methods Four α27-specific siRNAs(R1,R2,R3,R4 group)and the positive,negative control siRNAs were synthesized in vitro by chemical process.The Vero cells were transfected with siRNAs using Lipofectamine2000 followed by HSV-Ⅱinfecting.The activity of the cells were measured at 12,24,36,48,60,72 h by MTT.Results Groups with α27-specific siRNA had higher OD values by MTT colorimetric assay than blank cells,with better survive situation.R2 and R4 group had better survival than other groups.Conclusion α27-specific siRNA can protect host cells of HSV-Ⅱ.There are obvious differences of inhibition effect of siRNA which are synthesized in accordance with the same priciples.
α27 gene;siRNA;RNAi;HSV-Ⅱ;Vero cell
Q936
A
1674-4721(2015)05(b)-0007-04
2015-01-18本文编辑:卫轲)
广东省科技计划项目(2010B031600177)
▲通讯作者
