低剂量纳米银暴露致小鼠巨噬细胞RAW264.7的应激反应
2015-11-15琳陈瑞龙鼎新陈陈春英
赵 琳陈 瑞龙鼎新陈 锋▲陈春英
1.南华大学公共卫生学院,湖南衡阳421001;2.国家纳米科学中心中国科学院纳米生物效应与安全性重点实验室,北京100190
低剂量纳米银暴露致小鼠巨噬细胞RAW264.7的应激反应
赵 琳1,2陈 瑞2龙鼎新1陈 锋1▲陈春英2
1.南华大学公共卫生学院,湖南衡阳421001;2.国家纳米科学中心中国科学院纳米生物效应与安全性重点实验室,北京100190
目的探讨纳米银(AgNPs)对小鼠巨噬细胞RAW264.7毒性效应的影响,为AgNPs生物安全性的研究提供依据。方法将不同浓度的AgNPs(0、6.25、12.5、25、50、60、80 μg/ml)和RAW264.7共同培养,8、24 h后采用甲基噻唑基四唑比色法(MTT)测定各组细胞的活力,选取2.5、5 μg/ml两个无明显细胞毒性的浓度进行后续研究,检测应激相关基因和蛋白表达的变化;采用酶联免疫吸附试验(ELISA)检测细胞培养液中炎症因子TNF-α和IL-6的表达。结果用2.5、5 μg/ml的AgNPs处理细胞,24 h后相差显微镜下可见AgNPs进入细胞内,且5 μg/ml组的细胞形态有明显改变;8、24 h后ELISA结果显示,IL-6无明显变化,在5 μg/ml的24 h处理组TNF-α表达有显著升高,内质网应激相关的基因和蛋白在5 μg/ml的24 h处理组表达明显上调。结论RAW264.7细胞暴露于低剂量的AgNPs后表现出明显的应激反应,并且与暴露剂量和作用时间呈正相关。低剂量AgNPs能够干扰细胞的正常生理功能,长期暴露可能产生不可逆的损伤,应引起高度关注。
纳米银;低剂量;毒性;内质网应激
随着对纳米技术领域的研究与日俱增,纳米材料被广泛应用于几乎所有的领域,目前市场上的应用已超过1000种纳米相关产品[1]。由于纳米银颗粒(AgNPs)具有良好的抗菌性能,在抗菌敷料、涂料、化妆品和医疗设备等方面应用十分广泛,AgNPs相关产品在应用中通过与人体密切接触或环境释放,均可经呼吸道、皮肤或
消化道等途径进入血液循环对人体健康产生危害[2]。巨噬细胞是机体免疫的一道重要防线,它具有吞噬、清除异物和保护功能,因此,研究AgNPs对巨噬细胞的影响,对评价纳米物质的毒性具有十分重要的意义。
研究发现,AgNPs毒性呈剂量依赖性[3-5],Tiwari等[6]研究AgNPs对大鼠毒性影响的结果发现,在40 mg/kg组表现出明显遗传毒性,并认为AgNPs剂量<10 mg/kg是安全的,可以用于生物医学;当剂量>20 mg/kg显示明显毒性。在日常生活中所接触到的产品中AgNPs含量都较低,许多高剂量暴露的实验室数据并不能很好地阐述实际暴露情况,因而,研究较低剂量,非急性毒性发生剂量时AgNPs的安全性更具有现实意义。
1 材料与方法
1.1 材料与仪器
材料:小鼠腹腔巨噬细胞(RAW264.7)来自北京协和细胞资源中心。AgNPs(NM-300K)由欧盟第七框架协议项目提供,储存于稳定剂中。其成分为7%硝酸铵、4%聚氧乙烯甘油三油酸酯和4%Tween 20。RPMIDMEM,胎牛血清(FBS)购自Gibco公司;0.25%胰酶(Typsin)购自Hyclone;甲基噻唑基四唑(methyl thiazolyl tet-razolium)MTT试剂盒购自同仁化学研究所;ELISA试剂盒购自eBioscience公司;引物由上海生工生物工程技术服务有限公司设计;抗体购自Santa Cruz公司;ECL蛋白条带发光液购自Thermo Scientific公司;TRIzol及PCR相关的酶类购自Invitrogen公司,其他化学试剂均为国产分析纯。
仪器:倒置荧光显微镜(Olympus,Japan);CO2培养箱(Sanyo,Japan);超净工作台(Esco,Singapore);TEM(JEM-200CX,JEOL,Japan);离心机(Thermo,USA);酶标仪Infinite M200 microplate reader(Tecan,Durham,USA);Real Time PCR仪(Eppendorf,Germany)等。
1.2 纳米银表征
将AgNPs溶于无菌超纯水中,浓度为1 mg/ml,以100W超声30min,用超纯水稀释至适宜浓度(5~20μg/ml),利用透射电子显微镜(TEM)进行材料表征分析。
1.3 细胞培养及活力检测
取对数生长期细胞,设试验组(AgNPs暴露)、阴性对照组(无AgNPs)和空白对照组(无细胞),均设6个副孔。待细胞贴壁,弃去培养液,将试验组每孔加入100 μl不同浓度(0、3.125、6.25、12.5、25、50、60、80 μg/ml)的AgNPs培养液,继续培养8或24 h。弃上清液,加培养基100 μl/孔,PBS洗一次,轻轻震荡3 min后倾弃。每孔加入50 μl 2mg/ml的MTT溶液,4 h后终止培养。吸除上清液,每孔加入150 μl二甲基亚砜(DMSO)振荡10 min,使结晶颗粒充分溶解。酶标仪490 nm进行吸光度检测。根据MTT实验结果,选用对细胞活性无明显毒性的AgNPs浓度(分别为2.5、5 μg/ml)作为后续实验用的浓度。
1.4 细胞形态和细胞内吞
将盖玻片置于浓硫酸中浸泡并过夜,次日用自来水冲洗,置于无水乙醇中浸泡6 h,用三蒸水冲洗,置于玻璃培养皿中烘干后高压消毒,将培养皿转入烘箱烤干。将盖玻片放入六孔板中,胰酶消化细胞后重悬细胞于完全培养基,细胞计数后将细胞铺于六孔板。待细胞贴壁后,分别加入含有不同浓度(0、2.5、5 μg/ml)的AgNPs培养基。24 h后去除培养基取出盖玻片,PBS洗3次,乙醇梯度脱水后固定。荧光倒置显微镜的明场下观察细胞形态,暗场观察细胞摄入AgNPs的情况。
1.5 酶联免疫吸附试验(ELISA)
取对数生长期细胞,胰酶消化,调整细胞密度按1×106个/孔接种于六孔培养板上。待细胞生长稳定后将培养基更换为含有不同浓度(0、5、10 μg/ml)AgNPs的培养基,以1 μg/ml的脂多糖(LPS)处理细胞2 h作为阳性对照,以上各溶液每孔加2 ml,每组3复孔,37℃,5%CO2培养箱内培养24 h。收集细胞培养液,1500 r/min离心5 min,取上清液待测。按ELISA试剂盒说明书测定培养液中TNF-α和IL-6含量。
1.6 荧光定量PCR
细胞处理同上,8或24 h后,用PBS洗细胞3次,每孔中加入1 ml的Trizol,分光光度计测定RNA浓度后,将一定量RNA反转录成cDNA,进行实时荧光定量PCR(SYBR Green)的分析检测。利用Primer Premier 5.0软件设计引物,引物序列如表1。

表1 PCR引物序列
1.7 免疫蛋白印迹(Western blot)
细胞处理同上,8或24 h后,弃去上清,用PBS洗3遍细胞,再加入1 ml PBS,收集细胞后加入适量的细胞RIPA裂解液(50~100 μl),约30 min细胞裂解后进行蛋白定量。将定量后的蛋白样品与2×上样缓冲液按1∶1混匀,金属浴95℃加热10 min,冷却后12 000 r/min离心3 min,取上清待用。蛋白样品在10%SDS-PAGE凝胶上电泳分离,并转移到硝酸纤维素膜上后,将膜用5%脱脂牛奶室温封闭2 h,以1∶1000稀释Actin、HSP70、BiP、chop、PERK、p-PERK、IRE-1、p-IRE-1、ATF-6α抗体,4℃孵育过夜,相对应的二抗以1∶5000稀释,室温孵育2 h,ECL化学发光液使条带显影,照相分析。
1.8 统计学处理
采用Origin 9.0软件将实验数据统计分析,计量资料以±s表示,采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 AgNPs电镜观察结果
图1示电镜检测结果,AgNPs为类球形,分散均匀,无团聚现象,平均粒径为(21.8±4.8)nm。

图1 AgNPs透射电镜(F20)表征
2.2 不同浓度AgNPs对细胞活力的影响
RAW264.7细胞经不同浓度AgNPs处理8、24 h后,细胞活性结果显示:加入AgNPs后细胞活力受到不同程度抑制,AgNPs浓度为0~10 μg/ml,细胞毒性较小,随着AgNPs浓度增加(≥10 μg/ml),细胞活性出现显著性降低;24 h组细胞活性下降结果较8 h组更为明显,AgNPs对RAW264.7毒性存在明显的时间-剂量效应关系(图2)。

图2 不同浓度AgNPs对细胞活力的影响
2.3 细胞内吞AgNPs作用及形态学变化
图3A、3B、3C为AgNPs进入细胞的光镜观察结果,在特定实验浓度下,AgNPs进入细胞内的量随着时间的延长而增加,细胞形态也由于AgNPs不断进入而发生改变。荧光倒置显微镜下观察(图3D、3E),5 μg/ml的暴露组细胞呈现不规则多边形,细胞内黑色颗粒增多,细胞间距离变大,细胞数量有所减少。

图3 细胞内吞AgNPs作用及形态学变化(光镜、相差显微镜×250)A.正常RAW264.7细胞;B.AgNPs 2.5 μg/ml组;C.AgNPs 5 μg/ml组;D.AgNPs 2.5 μg/ml组;E.AgNPs 5 μg/ml组
2.4 不同组别炎症因子变化的比较
图4所示,LPS阳性对照组的TNF-α和IL-6表达与对照组比均明显上调,差异有高度统计学意义(TNF-α:t=27.01,P<0.01;IL-6:t=7.979,P=0.001)。2.5 μg/ml的AgNPs处理24 h后可见TNF-α明显上升,差异有统计学意义(t=-3.138,P=0.035);5 μg/ml处理24 h后可见TNF-α明显上升,差异有高度统计学意义(t=11.327,P<0.01)。各浓度AgNPs组IL-6表达变化都不明显,与对照组比差异无统计学意义(P>0.05)。

图4 不同组别炎症因子变化的比较A.TNF-α;B.IL-6;与对照组比较,*P<0.05、**P<0.01
2.5 不同组别各基因表达水平的比较
根据RT-PCR数据统计分析,结果见表2:2.5 μg/ml AgNPs处理细胞24 h后,内质网应激相关基因xbp-1s(t=4.672,P=0.01)、CHOP(t=15.922,P<0.01)表达上调;5 μg/ml的AgNPs处理24 h后,xbp-1s(t=5.959,P=0.004)、CHOP(t=17.041,P<0.01)表达差异有统计学意义。AgNPs暴露组的炎症相关基因IL-6、TNF-α表达无明显变化(P>0.05)。HO1的mRNA表达在5 μg/ml组的24 h表达明显上调,差异有统计学意义(t=10.333,P=0.005)。
表2 不同组别各基因表达水平的比较(±s)
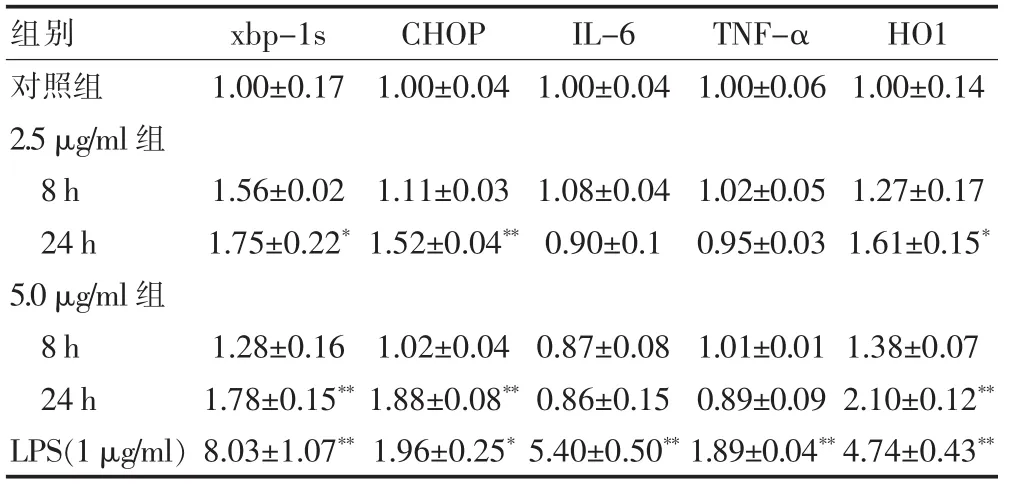
表2 不同组别各基因表达水平的比较(±s)
与对照组比较,*P<0.05、**P<0.01
?
2.6 AgNPs对内质网应激相关蛋白表达的影响
图5为AgNPs暴露后内质网应激相关蛋白BiP、PERK、p-PERK、IRE-1、p-IRE-1、ATF-6和Caspase-12的变化情况与对照比较,LPS阳性对照ERS的现象最为显著,AgNPs暴露组内质网应激效应水平随着处理浓度和时间的增加而升高。

图5 内质网应激相关蛋白的表达分析结果
3 讨论
近年来,纳米毒理学的研究结果显示,一旦物质尺寸降至纳米尺度将可能产生新的生物效应并对人体健康产生危害,具有潜在的风险[7]。研究表明,颗粒物粒径越小越难以被巨噬细胞清除。巨噬细胞清除外来异物的能力降低,其吞噬能力也会降低,进而对细胞结构和功能造成影响,对机体的免疫系统产生损伤[8]。AgNPs已经广泛应用在各类生活用品中,例如烧伤敷料等医疗产品,评估AgNPs接触或进入人体后的安全性是当前预防医学研究的一个重要方向。
MTT试验是检测细胞活性和生长状况的常用方法,本实验发现随着染毒浓度的增加,RAW264.7细胞活性逐渐下降,呈浓度依赖关系。8、24 h组分别在≥50 μg/ml,≥25 μg/ml毒性最为明显,说明AgNPs能够能降低RAW264.7细胞的活性,抑制其生长。为评估低剂量AgNPs对小鼠巨噬细胞的影响,根据MTT结果,选取2.5、5 μg/ml这两个无明显毒性的浓度进行后续研究。
细胞暴露于纳米材料后会引起形态学改变[4],AgNPs处理RAW264.7细胞24 h后,光学显微镜下观察到对照组细胞无明显的形态学变化,在5 μg/ml AgNPs处理组部分细胞出现紧贴玻片底部生长,出现细胞变形、细胞间隙变大等形态学改变。细胞对纳米颗粒的摄取通常有三种机制:吞噬、胞饮、受体介导的内吞作用[9]。很多研究证实AgNPs和RAW264.7细胞共培养后,AgNPs会被细胞膜包裹、吞噬进入细胞质以及部分进入溶酶体[10-12],通过内吞作用进入细胞后,
AgNPs与胞内的重要生物大分子(如蛋白质、DNA)或细胞器(如线粒体、细胞核)相互作用引发一系列变化。本研究利用相差显微镜观察显示,暴露于AgNPs 24 h后,2.5、5 μg/ml组AgNPs都进入细胞,暗场可见RAW264.7的细胞轮廓,提示AgNPs在细胞内蓄积。Park等[13]的研究发现,AgNPs对RAW264.7细胞损害,其主要的毒性机制归于细胞对AgNPs的摄取,随后释放出银离子而对细胞产生损害。有研究表明,AgNPs在细胞内释放离子的速度比水中快约50倍[11]。
目前对于AgNPs产生细胞毒性的机制推测主要存在两个方面,一是AgNPs直接通过释放银离子对细胞产生毒性作用[14],另一方面是AgNPs可以通过细胞融合或是细胞吞噬作用进入细胞内激活细胞的信号转导通路,导致细胞功能紊乱,最终引起细胞凋亡,甚至坏死[15-16]。炎症因子作为炎症反应的调节者,在细胞信号转导过程中发挥着重大作用[8],本次研究中基因水平IL-6和TNF-α未见明显上调趋势,抗氧化基因HO1明显上调。ELISA结果显示,IL-6未见有明显变化,而TNF-α在24 h的2.5、5 μg/ml都有明显上调,说明RAW264.7细胞暴露于低剂量的AgNPs后可产生较微弱的炎症反应。RAW264.7细胞暴露于AgNPs后,在两个浓度的24 h组发现,ERS相关的xbp-1s基因有上调的趋势,在5 μg/ml组还发现促凋亡的基因CHOP的表达明显上调;在蛋白水平也有同样发现,AgNPs暴露组ERS效应相关蛋白BiP、PERK、p-PERK、IRE-1、p-IRE-1、ATF-6、Caspase-12等随着浓度和时间的增加而表达明显上调。表明AgNPs能使BiP活化,并激活PERK、IRE-1、ATF6三条信号通路,最终引起凋亡相关蛋白Caspase-12、CHOP的表达。AgNPs能诱导细胞的ERS,最终引发细胞自噬、凋亡或坏死[17-19]。传统的毒性学指标大多是细胞损伤终末期的评判标准,而在AgNPs的应用中不能只关注损伤,更应该重视前期应激水平的变化。ERS作为细胞毒性的指标,已应用于AgNPs诱导人源细胞和斑马鱼毒性的评价中[20-22],最近ERS已被作为生物应激相关的细胞毒理学早期评价指标[23]。本项研究结果也证实ERS可用作AgNPs暴露后早期敏感的生物学评价指标。
总之,低剂量的AgNPs与巨噬细胞共培养后,RAW264.7吞噬AgNPs入胞,随后产生氧化应激,在两个剂量的24 h组,均引起了轻微的炎症反应以及ERS,特别是5 μg/ml组ERS尤为明显。RAW264.7细胞作为免疫系统天然屏障中起重要作用的细胞,MTT实验显示2.5、5 μg/ml对细胞未见明显毒性影响,但分子水平的研究却证实,低剂量暴露仍会引起细胞的应激反应,导致细胞功能紊乱,在长时间暴露时可能导致细胞形成不可逆的损伤,因而在AgNPs被广泛应用的同时应关注其可能存在的安全问题。
[1]Arora S,Rajwade JM,Paknikar KM.Nanotoxicology and in vitro studies:the need of the hour[J].Toxicol Appl Pharmacol,2012,258(2):151-165.
[2]Chen X,Schluesener HJ.Nanosilver:a nanoproduct in medical application[J].Toxicol Lett,2008,176(1):1-12.
[3]Zhang W,Yao Y,Sullivan N,et al.Modeling the primary size effects of citrate-coated silver nanoparticles on their ion release kinetics[J].Envir Sci Technol,2011,45(10):4422-4428.
[4]Hashimoto M,Toshima H,Yonezawa T,et al.Responses of RAW264.7 macrophages to water-dispersible gold and silver nanoparticles stabilized by metal-carbon σ-bonds[J]. J Biomed Mater Res A,2014,102(6):1838-1849.
[5]Albers CE,Hofstetter W,Siebenrock KA,et al.In vitro cytotoxicity of silver nanoparticles on osteoblasts and osteoclasts at antibacterial concentrations[J].Nanotoxicology,2013,7(1):30-36.
[6]Tiwari DK,Jin T,Behari J.Dose-dependent in-vivo toxicity assessment of silver nanoparticle in Wistar rats[J].Toxicol Mechan Methods,2011,21(1):13-24.
[7]Service RF.American Chemical Society meeting.Nanomaterials show signs of toxicity[J].Science,2003,300(5617):243-247.
[8]Zhang Q,Kusaka Y,Sato K,et al.Differences in the extent of inflammation caused by intratracheal exposure to three ultrafine metals:role of free radicals[J].J Toxicol Environ Health A,1998,53(6):423-438.
[9]Lorenz MR,Holzapfel V,Musyanovych A,et al.Uptake of functionalized,fluorescent-labeled polymeric particles in different cell lines and stem cells[J].Biomaterials,2006,27(14):2820-2828.
[10]Greulich C,Diendorf J,Simon T,et al.Uptake and intracellular distribution of silver nanoparticles in human mesenchymal stem cells[J].Acta Biomater,2011,7(1):347-354.
[11]Singh RP,Ramarao P.Cellular uptake,intracellular trafficking and cytotoxicity of silver nanoparticles[J].Toxicol Lett,2012,213(2):249-259.
[12]Lee JK,Sayers BC,Chun KS,et al.Multi-walled carbon nanotubes induce COX-2 and iNOS expression via MAP kinase-dependentand-independent mechanisms in mouse
RAW264.7 macrophages[J].Part Fibre Toxicol,2012,9(1):14.
[13]Park EJ,Yi J,Kim Y,et al.Silver nanoparticles induce cytotoxicity by a Trojan-horse type mechanism[J].Toxicol In Vitro,2010,24(3):872-878.
[14]Poon VK,Burd A.In vitro cytotoxity of silver:implication for clinical wound care[J].Burns,2004,30(2):140-147.
[15]Kim S,Choi JE,Choi J,et al.Oxidative stress-dependent toxicity of silver nanoparticles in human hepatoma cells[J]. Toxicol In Vitro,2009,23(6):1076-1084.
[16]汤京龙,周国凤,王硕,等.纳米银颗粒对神经元的细胞毒性研究[J].药物分析杂志,2013,33(7):1104-1108.
[17]Park EJ,Choi DH,KimY,et al.Magnetic iron oxide nanoparticles induce autophagy preceding apoptosis through mitochondrial damage and ER stress in RAW264.7 cells[J]. Toxicol In Vitro,2014,28(8):1402-1412.
[18]Ali D.Oxidative stress-mediated apoptosis and genotoxicity induced by silver nanoparticles in freshwater snail Lymnea luteola L.[J].Biol Trace Elem Res,2014,162(1-3):333-341.
[19]Foldbjerg R,Olesen P,Hougaard M,et al.PVP-coated silver nanoparticles and silver ions induce reactive oxygen species,apoptosis and necrosis in THP-1 monocytes[J]. Toxicol Lett,2009,190(2):156-162.
[20]Zhang R,Piao MJ,Kim KC,et al.Endoplasmic reticulum stress signaling is involved in silver nanoparticles-in-duced apoptosis[J].Int J Biochem Cell Biol,2012,44(1):224-232.
[21]Christen V,Capelle M,Fent K.Silver nanoparticles induce endoplasmatic reticulum stress response in zebrafish[J]. Toxicol Appl Pharmacol,2013,272(2):519-528.
[22]Simard JC,Vallieres F,de Liz R,et al.Silver nanoparticles induce degradation of the endoplasmic reticulum stress sensor activating transcription factor-6 leading to activation of the NLRP-3 inflammasome[J].J Biol Chem,2015,290(9):5926-5939.
[23]Chen R,Huo L,Shi X,et al.Endoplasmic reticulum stress induced by zinc oxide nanoparticles is an earlier biomarker for nanotoxicological evaluation[J].ACS Nano,2014,8(3):2562-2574.
Stress response of mice macrophage RAW264.7 cell exposed to low dose of silver nanoparticles
ZHAO Lin1,2CHEN Rui2LONG Ding-xin1CHEN Feng1▲CHEN Chun-ying2
1.School of Public Health,University of South China in Hengyang City of Hunan Province,Hengyang421001,China;2.CAS Key Lab for Biomedical Effects of Nanomaterials and Nanosafety,National Center for Nanoscience&Technology of China,Beijing100190,China
Objective To investigate the toxicity of silver nanoparticles(AgNPs)on mice macrophage cell line RAW264.7 and provide the data for understanding their biosafety.Methods Cell viability was determined by the MTT method in RAW264.7 cells after incubation with AgNPs(0,6.25,12.5,25,50,60,80 μg/ml).The dose of 2.5,5 μg/ml did not cause significant cytotoxicity to RAW264.7 cells,which were used for the following cell treatment to observe the cellular morphology and to determine the protein expression of the stress-related biomarker.The level of TNF-α and IL-6 in the culture medium were determined by ELISA.Results When the RAW264.7 cells were treated with 2.5 and 5 μg/ml of AgNPs for 24-h,the AgNPs were found to be internalized into the cells and cellular morphology were changed apparently in the 5 μg/ml group.The expression of IL-6 did not change after AgNPs treatement for 8 and 24 hours,but the expression of TNF-α was increased in the group after AgNPs treatement for 24-h.Further,the endoplasmic reticulum stress response maker and oxidative-stress protein were upregulated significantly in RAW264.7 cells after 5 μg/ml Ag-NPs treatement for 24-h.Conclusion RAW264.7 cells after exposure to low dose of AgNPs show obvious stress reaction,which is positively correlated with exposure dose and effect time.Low dose AgNPs exposure can disturb the normal cellular physiological function on RAW264.7 cells.Prolonged exposure may cause irreversible damage,should arouse attention.
AgNPs;Low dose;Toxicity;Endoplasmic reticulum stress
R122
A
1674-4721(2015)05(a)-0016-06
2015-04-07 本文编辑:李亚聪)
国家自然科学基金(21477029)
赵琳(1989-),女,2012级硕士研究生,主要研究方向为纳米材料的生物效应与安全性
▲通讯作者
