乙肝表面抗原在酿酒酵母中的异源表达
2015-11-11邱玲钱俊佳康振陈坚
邱玲,钱俊佳,康振,陈坚
(1.江南大学工业生物技术教育部重点实验室,江苏无锡214122;2.江南大学生物工程学院,江苏无锡214122;3.希森美康生物科技无锡有限公司,江苏无锡214028;4.江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡214122)
乙肝表面抗原在酿酒酵母中的异源表达
邱玲1,2,钱俊佳3,康振1,2,陈坚*2,4
(1.江南大学工业生物技术教育部重点实验室,江苏无锡214122;2.江南大学生物工程学院,江苏无锡214122;3.希森美康生物科技无锡有限公司,江苏无锡214028;4.江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡214122)
乙肝表面抗原HBsAg是乙肝疫苗的主要组分。从转录水平、翻译水平以及翻译后水平对其进行优化,实现了HBsAg在重组酿酒酵母中的高效异源表达。与组成型启动子TEF1、TDH3、HXT7、ADH1相比,诱导型启动子GAL1可大幅度提高HBsAg的表达;与GCCACC和AAAAAA相比,kozak序列TACACA最有利于HBsAg的翻译表达;而共表达二硫键异构酶pdi对HBsAg的活性表达具有显著的促进作用。通过3种水平的优化,HBsAg活性从最初的8.87 IU/g提高至151.08 IU/g;最终,利用Ni柱亲和层析成功获得纯化的HBsAg,活性为3.32 IU/mL。
酿酒酵母;乙肝表面抗原;启动子;kozak序列;共表达
乙型肝炎病毒(Hepatitis B virus,HBV)属致癌性病毒,严重危害人类的健康,HBV感染会引起急、慢性病毒性肝炎,其感染性强、携带率高、流行面广、慢性化倾向严重,更有部分感染者会发生肝硬化和肝细胞癌[1]。目前尚无特异性药物可完全控制其传染和流行暴发,预防和控制乙肝病毒感染最有效的方法是接种乙肝疫苗[2-4]。乙肝疫苗的主要有效成分为乙肝表面抗原(Hepatitis B virus surface antigen,HBsAg),HBsAg由HBV S基因编码[5],是在HBV增殖过程中产生的包膜蛋白质,是HBV的主要特征抗原,具有与天然病毒相近的抗原表位,可以刺激机体产生保护性中和抗体而预防HBV感染。
乙型肝炎疫苗的研制先后经历了血源性疫苗和基因工程疫苗阶段,血源性乙肝疫苗因血源供应有限且具有潜在的危险性,已逐步被基因工程疫苗所取代。目前基因工程乙肝疫苗技术已相当成熟,而酿酒酵母生物安全性好,具有真核细胞的翻译后修饰功能,工艺成熟,成本低,因而非常适合重组蛋白质的生产,已成为制备重组乙肝疫苗的主要系统之一。早在1981年美国科学家Rutter首先在酿酒酵母中成功表达了rHBsAg[6]。随后1982年Valenzuela等[7]利用酵母乙醇脱氢酶(ADH)启动子成功实现了adw亚型的HBsAg基因在酿酒酵母中的表达。近年来,已有很多酿酒酵母表达乙肝疫苗的研究报道,但酿酒酵母表达HBsAg的水平并不高。因此,研究有效提高HBsAg表达水平的方法,具有重要的实际应用价值。
一般来说,外源基因在酵母中的表达与基因的转录水平有密切的关系,所以选择转录活性较优、强度较高的启动子对基因的高效表达十分重要。酿酒酵母表达系统常用的启动子分为组成型和诱导型两种,这两种启动子各有利弊,针对不同的目标产物和表达体系,选择适配的启动子需要进一步的探究。Yocum等[8-9]研究表明,诱导型启动子GAL1的调控活性强于GAL10。Siavash Partow等[10]通过检测β-半乳糖苷酶的表达量考察了酿酒酵母中较常见的组成型和诱导型的启动子(TEF1、TPI1、HXT7、 PGK1、PYK1、GAL1、GAL10、TDH3、ADH1)的强度和活力,发现启动子TEF1、TDH3在发酵培养基中葡萄糖尚未耗尽时调控强度最大,葡萄糖耗尽时TEF1、HXT7的调控强度最大,而启动子ADH1适合高葡萄糖浓度下的调控。本研究中选用酿酒酵母中较为常见的4种组成型强启动子(TEF1、TDH3、HXT7、ADH1)及广泛应用的诱导性强启动子GAL1来分别表达HBsAg并进行比较。
蛋白质的翻译也是基因表达过程中的关键步骤。Kozak序列是存在于真核生物mRNA上AUG侧翼的一段序列,能够被核糖体识别并作为翻译起始位点,对应于原核生物的SD序列。因此在酵母中表达基因时,一般可在基因的N端添加kozak序列[11-12],以增强基因的翻译效率,有效提高基因的表达。参照Kozak[13]提出的真核生物偏好的转移起始密码子周边序列,本研究中选取GCCACC序列(记为k)通过引物添加于HBsAg序列上游的-1到-6位;根据Robert Hamilton针对酿酒酵母kozak序列的报道[14],另选用TACACA序列(记为yk)及AAAAAA序列(记为kk),从而考察不同kozak序列对HBsAg表达的影响。
对于大多数蛋白质,多肽链翻译后还要进行不同方式的加工修饰才具有生理功能,其中,二硫键的形成是蛋白质折叠过程中的限速步骤,对稳定蛋白质的空间结构和保持其活性功能有极其重要的作用[15]。蛋白质二硫键异构酶(protein disulfide isomerase,PDI)是真核生物内质网腔中的一种多功能蛋白质,能催化蛋白质二硫键的形成、还原或异构化,还具有抑制错误折叠蛋白质聚集的分子伴侣活性[16]。PDI在蛋白质折叠和分泌的过程中起重要的作用,Freedman等认为,PDI通过形成正确的链内、链间二硫键,进而使蛋白质正确地折叠,形成正确的空间构象[15,17]。Robinson等[17]发现,过量表达pdi可以使人血小板导出生长因子B二聚体在酿酒酵母中的分泌量提高10倍。Smith等[18]在酿酒酵母中表达葡萄糖苷酶时发现,利用基因工程手段增加内质网内的分子伴侣BIP和PDI的量,可以提高表达量。研究表明,酵母中pdi的过量表达能大幅度提高外源蛋白质的表达水平及分泌量,尤其是含较多二硫键的蛋白质。而HBsAg是具有8对二硫键的复杂蛋白质,故本研究中将pdi和HBsAg进行共表达。
本研究中利用组成型启动子TEF1在酿酒酵母中成功表达乙型肝炎病毒表面抗原,并通过筛选强启动子、优化kozak序列及共表达二硫键,辅助蛋白质PDI分别从转录水平、翻译水平及翻译后加工水平有效提高HBsAg的表达。
1 材料与方法
1.1菌株与质粒
相关质粒和菌株见表1,Escherichia coli JM109用于重组质粒的保存和增殖,Saccharomyces cerevisiae INVscI作为HBsAg表达的宿主。

表1 菌株和质粒Table 1 Strains and plasmids used in this study
1.2试剂
PCR引物(见表2),由生工生物上海有限公司合成;质粒提取试剂盒,购自生工生物上海有限公司;Prime Star DNA聚合酶,T4 DNA连接酶,限制性内切酶,DNA相对分子质量标准,DNA凝胶回收试剂盒,感受态制备试剂盒,均购自宝生物大连有限公司;蛋白质相对分子质量标准,购自碧云天(Beyotime)公司;酵母基因组提取试剂盒,购自上海杰美基因(GENMED)公司。YNB、半乳糖、氨苄青霉素、卡那霉素、咪唑及其他常用试剂,均为国产分析纯。

表2 引物Table 2 Primers used in this study
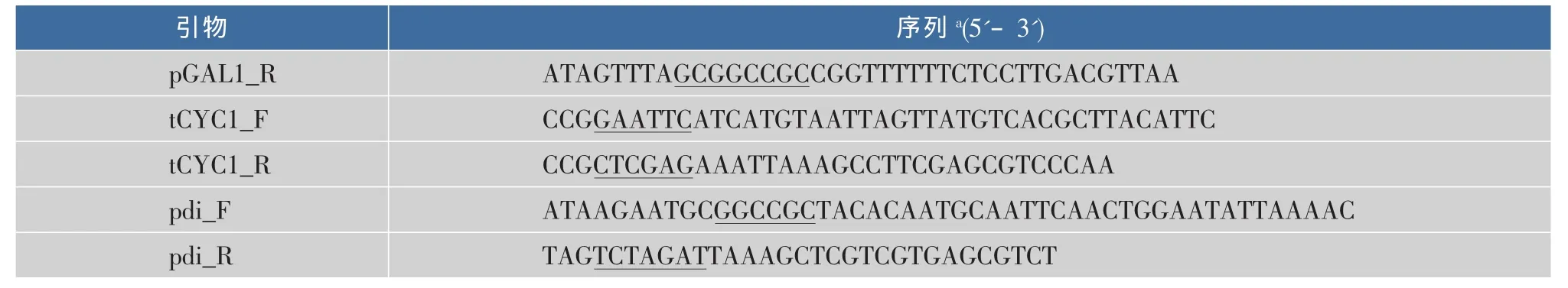
续表2
1.3培养基
LB(Luria-Bertani Medium)培养基(g/L):酵母粉5,胰蛋白胨10,氯化钠10;pH 7.0~7.2。制备固体培养基时添加质量分数2%琼脂粉。
YNB(Yeast Nitrogen Base)选择性培养基(g/L):葡萄糖20,硫酸铵1.7,YNB 5;pH 5.5。添加过滤除菌的亮氨酸、组氨酸、色氨酸至终质量浓度为50 μg/mL。
YPDG(Yeast Extract Peptone Dextrose Galactose)发酵培养基(g/L):酵母粉10,胰蛋白胨20,葡萄糖20,半乳糖33;pH 5.5。
1.4HBsAg重组表达载体的构建
HBsAg主蛋白质由S区编码,由226个氨基酸组成。按照酵母密码子偏好性对S区基因序列(Genbank:AF504292.1)进行密码子优化并合成基因(金斯瑞生物科技),所得质粒pUC57-sAg含有完整的HBsAg编码序列(681 bp),在其C端添加有6×His纯化标签,并在上下游分别添加BamHI和EcoRI酶切位点。
用BamHI和EcoRI酶切质粒pUC57-sAg得sAg片段,经PCR纯化试剂盒纯化后,分别与经相同酶切及纯化的载体pTEF1、pTDH3、pHXT7、pADH1及pYES2进行连接,连接产物转化E.coli JM109感受态细胞,涂布含有氨苄青霉素的LB平板,经菌落PCR筛选阳性转化子,提取质粒,再经酶切验证及上海生工生物公司测序验证,获得含有不同启动子的重组质粒pTEF1-sAg、pTDH3-sAg、pHXT7-sAg、pADH1-sAg及pGAL1-sAg。如图1所示。
使用引物(ksAg_F、yksAg_F、kksAg_F及sAg_R)分别克隆出含不同kozak序列的ksAg、yksAg及kksAg片段,经BamHI和EcoRI双酶切及纯化后,与经相同酶切及纯化的载体pYES2进行连接,连接产物转化E.coli JM109感受态细胞,涂布含有氨苄青霉素的LB平板,经菌落PCR筛选阳性转化子,提取质粒,再经酶切及测序验证,获得含有不同kozak序列的重组质粒pGAL1-ksAg、pGAL1-yksAg、pGAL1-kksAg。

图1 BamHI和EcoRI双酶切验证重组质粒Fig.1 Confirmation of recombinant plasmids by BamHI and EcoRI digestion
在质粒pGAL1-yksAg的基础上构建共表达质粒(见图2),利用引物pGAL1_F、pGAL1_R和tCYC1_F、tCYC1_R从质粒pYES2克隆获得pGAL1(474 bp)和tCYC1(259 bp)片段,连接至pGAL1-yksAg获得具有两个表达框的二价表达载体pGAL1-yksAg-PT。使用引物pdi_F、pdi_R从P.pastoris GS115基因组扩增得二硫键异构酶基因pdi,经NotI和XbaI双酶切及PCR纯化试剂盒纯化,与经相同酶切及纯化的载体pGAL1-yksAg-PT进行连接,连接产物转化E.coli JM109感受态细胞,涂布含有氨苄青霉素的LB平板,经菌落PCR筛选阳性转化子,提取质粒,再经酶切及测序验证,获得pdi共表达质粒pGAL1-yksAg-pdi。
1.5酵母转化及重组菌发酵
按照Invitrogen公司提供的LiAc/SS-DNA/PEG法制作酿酒酵母感受态细胞,并进行重组质粒的转化,涂布于含所需氨基酸的YNB选择性平板,获得的酵母转化子经菌落PCR检验。50 μL反应体系如下:Taq DNA聚合酶1 μL,10×loading buffer 5 μL,mix dNTP 4 μL,上下游引物各1 μL,ddH2O至50 μL。反应条件为:95℃预变性5 min;95℃1 min,55℃1 min,72℃1 min,30个循环;72℃延伸10 min。

图2 共表达质粒pGAL1-yksAg-pdi的构建Fig.2 Construction of pGAL1-yksAg-pdi for co-expression
挑取菌落PCR呈阳性的酵母转化子接种于YNB液体培养基,于30℃200 r/min培养36~39 h,按体积分数10%接种量转接至YPD(含启动子TEF1、TDH3、HXT7、ADH1的重组菌)或YPDG(含诱导启动子GAL1的重组菌)培养基,28℃200 r/ min培养70 h[19]。发酵液于4℃、8 000 r/min离心10 min,收集菌体,经洗涤后悬浮于PBS缓冲液(pH 7.5),在低温条件下利用玻璃珠进行酵母细胞破碎,于4℃、8 000 r/min离心10 min,取上清液即为胞内样品,加入PMSF至终浓度为1 mmol/L,以防止蛋白质水解酶降解,4℃保存。
1.6HBsAg活性检测及HBsAg的纯化
使用希森美康生物科技(无锡)有限公司的Sysmex HISCL-2000i全自动免疫分析仪和配套试剂测定HBsAg活性。所用HISCL HBsAg校准品溯源至WHO standard 00/588。
重组HBsAg在C端添加有6×His纯化标签,可采用Ni柱亲和层析进行初步纯化。镍离子柱His_Trap_FF_crude,1 mL Global(90 μm),按Novagen公司Ni.NTAHis·BindResin说明书提供的方法进行纯化。纯化后的蛋白质样品液进行HBsAg活性检测和SDS-PAGE分析。
2 结果与讨论
2.1重组表达载体的鉴定及重组菌构建
重组表达质粒pTEF1-sAg、pTDH3-sAg、pHXT7-sAg、pADH1-sAg、pGAL1-sAg经BamHI和EcoRI双酶切,均获得约0.7 kb大小片段,对应于sAg片段的大小(图1(a))。重组表达质粒pGAL1-ksAg、pGAL1-yksAg、pGAL1-kksAg经BamHI和EcoRI双酶切,均获得约0.7 kb大小片段,对应于ksAg、yksAg、kksAg片段的大小(图1(b))。重组表达质粒pGAL1-yksAg-pdi(构建过程见图2)经NotI和XbaI双酶切,获得约1.6 kb大小片段,对应于pdi片段的大小(图2(c))。结果表明,HBsAg的重组表达质粒均构建成功。
重组表达质粒pTEF1-sAg、pTDH3-sAg、pHXT7-sAg、pADH1-sAg、pGAL1-sAg转化进入酿酒酵母感受态细胞,获得相应重组菌,分别命名为TEF1-sAg、TDH3-sAg、HXT7-sAg、ADH1-sAg、GAL1-sAg。将重组质粒pGAL1-ksAg、pGAL1-yksAg、pGAL1-kksAg成功转化酿酒酵母感受态细胞,获得相应重组酵母菌,分别命名为ksAg、yksAg及kksAg。共表达质粒pGAL1-yksAg-pdi转化酿酒酵母获得重组菌,命名为yksAg-pdi。
2.2筛选启动子强化HBsAg表达
Partow的报道中,启动子TEF1的调控强度大而且稳定,本研究中将启动子TEF1应用于HBsAg的表达。TEF1-sAg重组菌经发酵细胞干质量达9.14 g/L(pTEF1空质粒对照菌株干质量为9.96 g/ L),可见表达HBsAg对菌株生长有一定的不利影响。TEF1-sAg重组菌发酵样品HBsAg活性为8.87 IU/g,表明在酿酒酵母中,采用启动子TEF1能成功表达HBsAg,且产物具有免疫活性。
基因最终的表达效果直接受启动子的强弱及适配性的影响,因此选择合适的强启动子至关重要。为了筛选适合表达HBsAg的启动子,将启动子TEF1、TDH3、HXT7、ADH1及GAL1进行比较。TEF1-sAg、TDH3-sAg、HXT7-sAg、ADH1-sAg及GAL1-sAg重组菌的HBsAg活性分别为8.87、43.25、12.94、10.61 IU/g及46.45 IU/g(图3)。表明在酿酒酵母中采用TEF1、TDH3、HXT7、ADH1及GAL1 5种启动子均能成功表达HBsAg,且产物具有免疫活性。其中,采用诱导型启动子GAL1时 HBsAg活性最高(46.45 IU/g),较TEF1启动子提高了4.23倍;其次为组成型启动子TDH3,较TEF1提高了3.87倍。
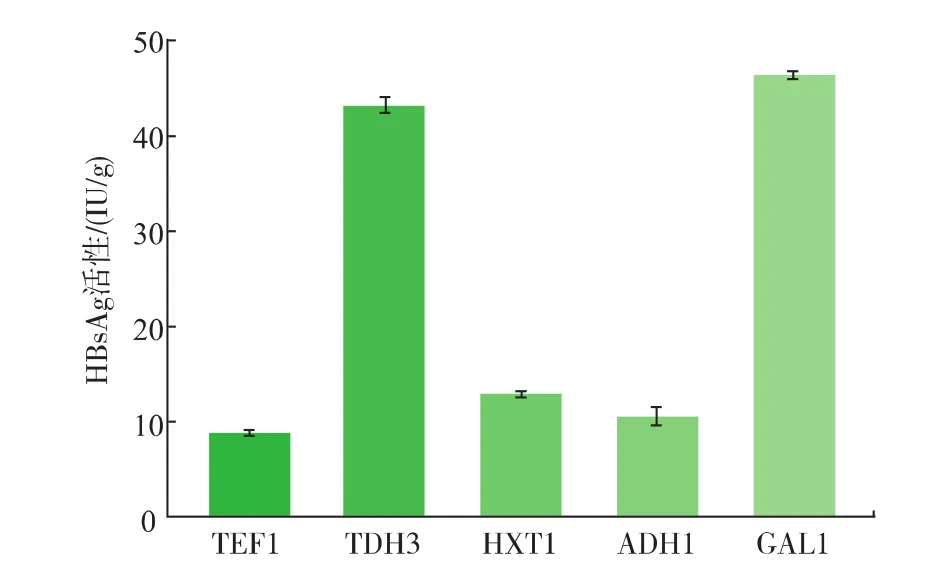
图3 采用不同启动子表达HBsAgFig.3 Expression of HBsAg under different promoters
本研究中,采用诱导型启动子GAL1来表达HBsAg相对更为适合,因为产物HBsAg对细胞生长会产生一定不利影响,而诱导表达系统可将细胞生长与产物积累分开,即在GAL1启动子关闭时细胞利用葡萄糖正常生长,当葡萄糖耗尽时启动子被激活开始表达下游基因,而此时细胞已生长到一定密度,产物HBsAg对酵母细胞生长的影响已经不明显,从而避免了产物积累对细胞原有代谢平衡及细胞生长的不利影响。Siavash Partow[10]在以β-半乳糖苷酶为报告基因的研究中,启动子TEF1与TDH3在葡萄糖尚未耗尽时的调控强度大体相同;在Sun等[20]的研究中,启动子的强度TEF1>TDH3;本研究中,在表达HBsAg时,启动子强度GAL1>TDH3>HXT1>ADH1>TEF1,启动子TDH3较TEF1提高了3.87倍。可见,对于不同的目标产物及表达体系,适配的启动子不能一概而论。
2.3优化kozak序列提高HBsAg表达
Kozak序列是能提高基因在真核细胞中表达的一个上游调控元件,它的存在将有利于翻译的起始。因此通过添加不同的kozak序列改变AUG周边序列组成,可以影响基因的翻译,从而调控基因的表达。本研究中选取了GCCACC(k)、TACACA(yk)及AAAAAA(kk)3种kozak序列添加至HBsAg基因上游,构建不同重组表达载体及相应重组菌。
将ksAg、yksAg及kksAg重组菌株进行发酵后,HBsAg活性分别为58.05、63.67 IU/g及59.47 IU/g(图4),表明GCCACC(k)、TACACA(yk)以及AAAAAA(kk)3种kozak序列均能促进HBsAg的表达,分别使HBsAg活性提高了25%、37%及28%(与GAL1-sAg对照菌株相比),可见TACACA(yk)序列最有利于HBsAg的表达。

图4 不同kozak序列对HBsAg表达的影响Fig.4 Expression of HBsAg with different kozak sequences
2.4共表达pdi促进HBsAg表达
HBsAg共有14个半胱氨酸残基(Cys),并以Cys的二硫键形成复杂的空间结构[21],故加速二硫键的形成对HBsAg的折叠及活性都极为重要。而蛋白质二硫键异构酶PDI能催化蛋白质分子中二硫键的形成。本研究中从酵母基因组克隆得pdi基因与HBsAg进行共表达。
将yksAg-pdi重组菌进行发酵后,HBsAg活性达151.08 IU/g(图5),与yksAg对照菌相比提高了1.37倍,表明共表达pdi能明显促进HBsAg的表达。Inan等[22]发现,共表达pdi能使Na-SPl在毕赤酵母中的表达量显著提高。Moralejo等[23]研究表明,甜蛋白质分泌表达量与pdi基因的表达水平存在相关性,当pdi表达水平提高2~4倍,甜蛋白质产量提高5倍。
yksAg-pdi重组菌综合了启动子、kozak序列以及PDI的有利影响,使HBsAg的表达活性提高了16倍。基于C端的6×His纯化标签,对此菌株表达的重组HBsAg进行Ni柱亲和层析,在含300 mmol/L咪唑的洗脱条件下获得电泳纯的样品(HBsAg活性3.32 IU/mL)。图5(b)所示纯化的蛋白质相对分子质量约35 000,较HBsAg的24 000未糖基化形式及27 000糖基化形式[24]都偏大;但酿酒酵母作为宿主易使表达的外源蛋白质过度糖基化,而HBsAg糖基化位点在第146位的天冬酰胺(Asn)残基,分析35 000处蛋白质即为过糖基化的目的产物HBsAg。

图5 共表达pdi对HBsAg表达的影响Fig.5 Co-expression of pdi and HBsAg
3 结语
在酿酒酵母中,采用组成型启动子TEF1成功表达乙肝表面抗原,活性为8.87 IU/g。为了从转录水平提高HBsAg的表达,比较了组成型强启动子ADH1、HXT7、TEF1、TDH3及诱导型强启动子GAL1。结果表明,采用后者使HBsAg活性提高了4.23倍(46.45 IU/g)。为了增强HBsAg的翻译,促进表达,考察了GCCACC、TACACA及AAAAAA 3种kozak序列对HBsAg表达的影响。结果表明,3种序列均有利于HBsAg的表达,TACACA序列效果最明显(63.67 IU/g),使HBsAg表达提高了37%。为了从翻译后水平促进HBsAg的表达,将二硫键异构酶pdi与HBsAg进行共表达,使得HBsAg活性进一步提高1.37倍(151.08 IU/g)。
综上所述,通过筛选启动子、优化kozak序列,以及共表达pdi,分别从转录水平、翻译水平、翻译后水平进行优化,使HBsAg活性由8.87 IU/g提高至151.08 IU/g,提高了16倍。本研究结果表明,选择合适的启动子对HBsAg的表达至关重要,而共表达二硫键异构酶pdi的促进作用也很明显,因为HBsAg富含二硫键。利用其他的二硫键辅助蛋白质促进HBsAg表达,则有待进一步深入研究。
[1]Miyanohara A.Expression of hepatitis B surface antigen gene in yeast[J].Proc Natl Acad Sci USA,1983,80(1):1-5.
[2]Liu R.Optimization of fermentation conditions for maximal recombinant hepatitis B surface antigen particle production in Pichia pastoris[J].Bioengineering,2008,24(12):98-105.
[3]Tiollais P,Buendia M A.Hepatitis B virus[J].Sci Am,1991,264(4):116-123.
[4]成军,杨守纯.现代肝炎病毒分子生物学[M].北京:人民军医出版社,1997:25-42.
[5]Krugman S,Giles J P,Hammond J.Hepatitis virus:Effect of heat on the infectivity and antigenicity of the MS-1 and MS-2 strains[J].J Infect Dis,1970,122(5):432-436.
[6]Rutter W J.Control of transcription in eukaryotes:summary[J].Prog Nucleic Acid Res Mol Biol,1981,26:171-178.
[7]Valenzuela P.Synthesis and assembly of hepatitis B virus surface antigen particles in yeast[J].Nature,1982,298(5872):347-350.
[8]Yocum R R.Use of lacZ fusions to delimit regulatory elements of the inducible divergent GAL1-GAL10 promoter in Saccharomyces cerevisiae[J].Mol Cell Biol,1984,4(10):1985-1998.
[9]West R,Jr W.GAL1-GAL10 divergent promoter region of Saccharomyces cerevisiae contains negative control elements in addition to functionally separate and possibly overlapping upstream activating sequences[J].Genes Dev,1987,1(10):1118-1831.
[10]Partow S.Characterization of different promoters for designing a new expression vector in Saccharomyces cerevisiae[J].Yeast,2010,27(11):955-964.
[11]Outten C E,Culotta V C.Alternative start sites in the Saccharomyces cerevisiae GLR1 gene are responsible for mitochondrial and cytosolic isoforms of glutathione reductase[J].Journal of Biological Chemistry,2004,279(9):7785-7791.
[12]Stuart J A.Physiological levels of mammalian uncoupling protein 2 do not uncouple yeast mitochondria[J].Journal of Biological Chemistry,2001,276(21):18633-18639.
[13]Kozak M.Structural features in eukaryotic mRNAs that modulate the initiation of translation[J].J Biol Chem,1991,266(30):19867-19870.
[14]Hamilton R,Watanabe C K,de Boer H A.Compilation and comparison of the sequence context around the AUG startcodons in Saccharomyces cerevisiae mRNAs[J].Nucleic Acids Res,1987,15(8):3581-3593.
[15]Freedman R B.Protein disulfide isomerase:Multiple roles in the modification of nascent secretory proteins[J].Cell,1989,57(7):1069-1072.
[16]Wilkinson B,Gilbert H F.Protein disulfide isomerase[J].Biochim Biophys Acta,2004,1699(1-2):35-44.
[17]Robinson A S,Hines V,Wittrup K D.Protein disulfide isomerase overexpression increases secretion of foreign proteins in Saccharomyces cerevisiae[J].Biotechnology,1994,12(4):381-384.
[18]Smith J D,Robinson A S.Overexpression of an archaeal protein in yeast:secretion bottleneck at the ER[J].Biotechnol Bioeng,2002,79(7):713-723.
[19]Kim E J.Expression of hepatitis B surface antigen S domain in recombinant Saccharomyces cerevisiae using GAL1 promoter[J].J Biotechnol,2009,141(3-4):155-159.
[20]Sun J.Cloning and characterization of a panel of constitutive promoters for applications in pathway engineering in Saccharomyces cerevisiae[J].Biotechnol Bioeng,2012,109(8):2082-2092.
[21]Wampler D E.Multiple chemical forms of hepatitis B surface antigen produced in yeast[J].Proc Natl Acad Sci USA,1985,82(20):6830-6834.
[22]Inan M.Enhancement of protein secretion in Pichia pastoris by overexpression of protein disulfide isomerase[J].Biotechnol Bioeng,2006,93(4):771-778.
[23]Moralejo F.A defined level of protein disulfide isomerase expression is required for optimal secretion of thaumatin by Aspergillus awamori[J].Molecular Genetics and Genomics,2001,266(2):246-253.
[24]李河民,汪和睦.基因工程乙肝新型疫苗(汉逊酵母表达系统)的开发[J].微生物学免疫学进展,2001,29(3):47-54.
LI Hemin,WANG Hemu.Development of new hepatitis vaccine for gene engineering[J].Progress in Microbiology and Immunology,2001,29(3):47-54.(in Chinese)
Heterologous Expression of HBsAg in Saccharomyces Cerevisiae
QIU Ling1,2,QIAN Junjia3,KANG Zhen1,2,CHEN Jian2,4
(1.Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China;2.School of Biotechnology,Jiangnan University,Wuxi 214122,China;3.Sysmex Biotech Co.,Ltd.in Wuxi,Wuxi214028,China;4.NationalEngineeringLaboratoryforCerealFermentationTechnology,Jiangnan University,Wuxi 214122,China)
Hepatitis B surface antigen(HBsAg)is a major component of the hepatitis B vaccine.In the present work,we achieved its high efficient heterologous expression in the recombinant Saccharomycescerevisiaebyoptimizationatthreelevels:transcription,translationand post-translation.Compared with the constitutive promoters TEF1,TDH3,HXT7 and ADH1,the inducible promoter GAL1 substantially increased the expression of HBsAg.Moreover,compared with GCCACC and AAAAAA,the kozak sequence TACACA is more beneficial to the translation and active expression of HBsAg.More importantly,co-expression of protein disulfide isomerase(PDI)also significantly increased the expression of HBsAg.Through three levels of optimizations,the activity of recombinant HBsAg was increased from 8.87 IU/g CDW to 151.08 IU/g CDW. Finally,applying the Ni column affinity chromatography,we successfully obtained the purifiedHBsAg with an activity of 3.32 IU/mL.
Saccharomyces cerevisiae,HBsAg,promoter,kozak sequence,co-expression
Q 753
A
1673—1689(2015)09—0906—08
2014-02-28
国家863计划重点项目(2011AA100905);教育部长江学者和创新团队发展计划项目(IRT1135);国家博士后基金面上项目(2013 M540414);江苏省优势学科项目。
陈坚(1962—),男,江苏无锡人,工学博士,教授,博士研究生导师,主要从事酶技术、发酵过程优化与控制研究。E-mail:jchen@jiangnan.edu.cn
