NaCl胁迫对二倍体马铃薯叶绿素含量和抗氧化酶活性的影响
2015-11-11
NaCl胁迫对二倍体马铃薯叶绿素含量和抗氧化酶活性的影响
张景云1, 2,缪南生1,白雅梅2,万新建1,吕文河2*
(1.江西省农业科学院蔬菜花卉研究所,南昌330200;2.东北农业大学农学院,哈尔滨150030)
摘要:为研究离体条件下盐胁迫对二倍体马铃薯富利亚(Solanum phureja, PHU)和窄刀薯(S. stenotomum, STN)杂种(PHU-STN)无性系相关生理指标变化。以6项生长参数筛选出的耐盐、中耐盐、感盐无性系各5份为试验材料,建立耐盐程度不同的3个组,包括四倍体耐盐品种Bintje和感盐品种Mainechip,用浓度为30 mmol·L-1的NaCl进行不同天数胁迫,测定叶绿素含量、超氧化物歧化酶(SOD)和过氧化物酶(POD)活性变化。随着盐胁迫天数的延长,叶绿素含量、SOD、POD活性相对值均呈降低趋势;二倍体马铃薯组间叶绿素含量、SOD和POD差异极显著。因此,叶绿素含量、SOD和POD活性与二倍体马铃薯耐盐性有关。
关键词:马铃薯;盐胁迫;生理指标
网络出版时间2015-1-12 9:54:36
[URL]http://www.cnki.net/kcms/detail/23.1391.S.20150112.0954.014.html
张景云,缪南生,白雅梅,等. NaCl胁迫对二倍体马铃薯叶绿素含量和抗氧化酶活性的影响[J].东北农业大学学报, 2015, 46(1): 6-12.
马铃薯作为重要经济作物,具有耐旱、耐寒、耐瘠薄、适应性广等特点,全国大部分地区的土壤及气候条件均能适于种植马铃薯,土壤盐渍化严重,不利于马铃薯种植。
植物耐盐性是多种机制综合作用结果[1],涉及多种生理生化指标。由于不同植物其耐盐方式和耐盐机理不同,其组织或细胞内的生理代谢和生化变化不同[2],造成植物耐盐能力差异大。有关马铃薯耐盐性生理研究多集中在四倍体栽培种(Sola⁃num tuberosum L.)[3-5],而对二倍体马铃薯耐盐性生理指标研究较少。
本研究以5份耐盐、5份中耐盐、5份感盐的二倍体马铃薯富利亚(S. phureja, PHU)和窄刀薯(S. stenotomum, STN)杂种(PHU-STN)无性系为试验材料,以四倍体马铃薯品种Bintje为耐盐对照,Mainechip为感盐对照,用浓度为30 mmol·L-1的NaCl进行不同天数胁迫,测定叶绿素含量、SOD 和POD活性,旨在探索盐胁迫下二倍体马铃薯耐盐的生理变化,为马铃薯耐盐新品种选育及耐盐机制研究提供理论基础。
1 材料与方法
1.1材料
根据植株性状在盐胁迫条件下的表现,从45份二倍体马铃薯富利亚和窄刀薯杂种(PHU-STN)无性系中选出的5份耐盐无性系、5份中耐盐无性系、5份感盐无性系[6],材料及编号见表1。由于筛选二倍体材料时,以四倍体马铃薯品种Bintje为耐盐对照,Mainechip为感盐对照[7],在研究NaCl胁迫对二倍体马铃薯叶绿素含量和抗氧化酶活性的影响时,亦包括这两个四倍体品种。

表1 不同耐盐性的二倍体马铃薯无性系及编号Table 1 Diploid potato hybrid clones withdifferent salt tolerance and their codes
1.2设计
1.2.1基础苗培养
取二倍体马铃薯脱毒试管苗,切成带1片叶的小茎段,插入装有MS培养基的100 mL三角瓶中(每瓶装培养基40 mL),每瓶插10个茎段,置于温度(25±2)℃,光照2 000~3 000 lx,每日光照16 h条件下培养。
1.2.2不同盐胁迫天数下马铃薯试管苗生理指标的测定
取20 d苗龄的试管苗,剪茎段约1 cm长,带有一个叶,插入含有30 mmol·L-1NaCl的MS培养基的100 mL三角瓶中(每瓶装有培养基40 mL),每瓶插10个茎段,培养条件同1.2.1。采用完全随机试验设计,3次重复。在胁迫0、20、40 d(20 d时继代1次)、60 d(20、40 d时分别继代1次)后取材,测定各项生理指标。
1.3测定方法
1.3.1叶绿素含量测定
参照郝再彬等方法略作修改[8]。称取待测样品0.2 g,剪碎,装入具塞刻度试管中,加入95%乙醇-丙酮混合液(1ϑ1,V/V)10 mL使叶片完全浸入液体中,加盖,30~40℃温箱中暗培养,当叶片完全变白时即可在663、646和470 nm比色。
1.3.2抗氧化物酶活性的测定
SOD活性测定:取直径相同试管,分别加入3 mL反应混合液,包括:1.5 mL磷酸缓冲液、0.3 mL MET、0.3 mL NBT、0.3 mL EDTA、0.3 mL核黄素溶液和粗酶液0.05 mL,再加蒸馏水0.25 mL,对照和空白加0.05 mL磷酸缓冲液,在光照培养箱内照光(8 000 lx),照光10 min后立即避光,迅速测定A560值[8]。
POD活性测定:反应体系包括2.9 mL磷酸缓冲液,1.0 mL H2O2,1.0 mL愈创木酚和0.1 mL酶液。反应体系加入酶液后,立即于37℃水浴中保温15 min,然后迅速冷却,并加入2 mL三氯乙酸终止反应,以加热煮沸的酶液为对照,470 nm波长下每隔1 min记录1次吸光值,共读4次,然后以每分钟内A470变化为1个酶活性单位(U)[8]。
1.4数据分析
原始数据整理采用Microsoft Excel(Office 2003)软件完成;方差分析及差异显著性测验采用DPS 7.05数据处理系统完成[9],按照Gomez和Gomez[10]方法进行组间(Between-group comparison)和组内(Within-group comparison)比较。以公式RV(%)= (Xs/Xc)×100%计算供试品种(系)每个生理指标的相对值,其中Xs为所测指标在盐胁迫下每次重复的平均值,Xc是所测指标在对照条件下的平均值,利用相对值进行数据分析。
2 结果与分析
2.1盐胁迫对二倍体马铃薯叶绿素含量的影响
在盐浓度为30 mmol·L-1胁迫下,处理20、40 和60 d后叶绿素含量差异均极显著。将处理间的变异进一步分解,发现耐盐和感盐四倍体间差异不显著,二倍体组间在盐胁迫20、40和60 d后叶绿素含量差异均极显著,组内除中耐盐组在盐胁迫20 d和感盐组在盐胁迫20、40 d差异不显著外,其他各无性系差异均显著或极显著,说明二倍体马铃薯不同无性系间受盐胁迫后的表现存在较大差异(见表2)。受盐胁迫后,四倍体和二倍体马铃薯均随着盐胁迫天数的延长叶绿素含量相对值呈降低趋势。感盐对照品种Mainechip在不同盐胁迫天数下其叶绿素含量相对值低于耐盐对照品种Bintje,但未达到显著水平。在盐胁迫20、40、60 d后感盐组极显著低于耐盐组;胁迫20 d,中耐盐组和感盐组无显著差异,但胁迫40 d,二者有显著差异(感盐组显著低于中耐盐组),胁迫60 d,有极显著差异(感盐组极显著低于中耐盐组)。说明根据盐胁迫条件下植株性状的表现建立的不同组,其生理性状叶绿素含量也会随之不同。然而,耐盐程度不同的组在盐胁迫相同天数后极差大多数有相互重叠现象(见表3)。
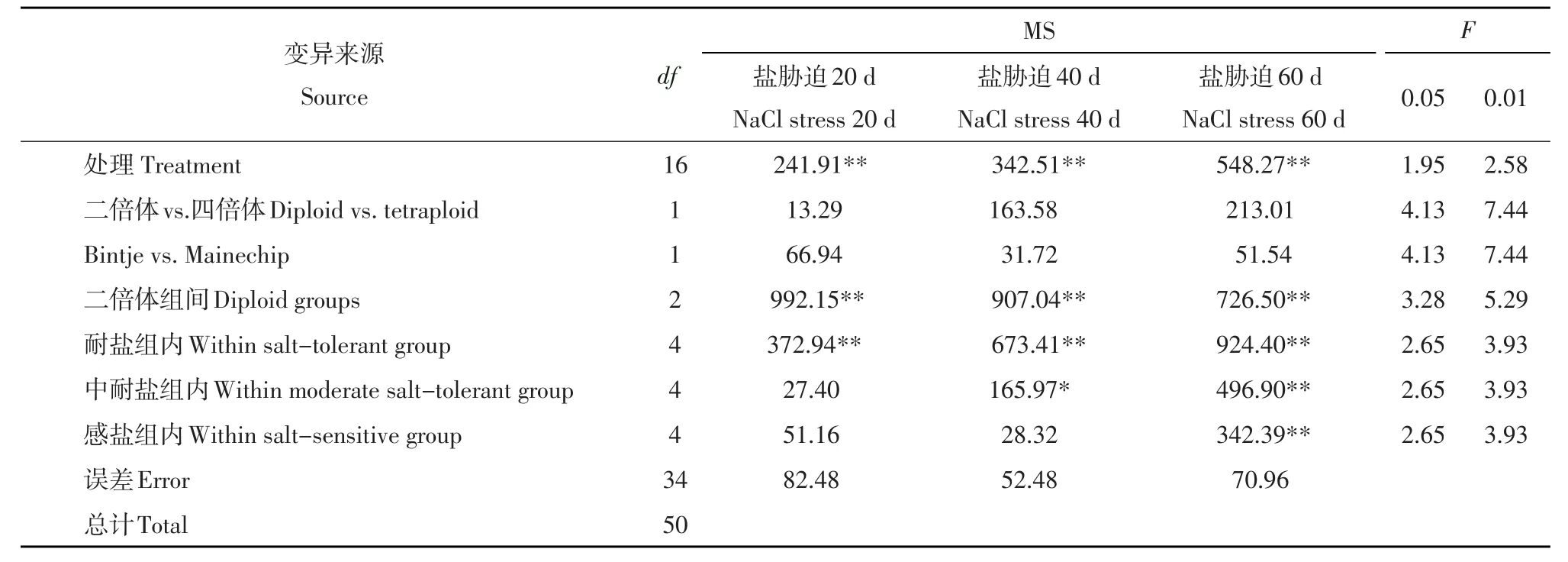
表2 PHU-STN二倍体马铃薯和四倍体对照在30 mmol·L-1盐胁迫下不同天数叶绿素含量的方差分析Table 2 Analysis of variance on chlorophyll content for diploid PHU-STN clones and tetraploid control varieties at different days after salt stress of 30 mmol·L-1

表3 盐胁迫下四倍体对照及二倍体马铃薯组间叶绿素含量Table 3 Chlorophyll content of tetraploid control varieties and diploid potato groups under salt stress
2.2盐胁迫对二倍体马铃薯SOD活性的影响
各处理在盐胁迫20、40和60 d后SOD活性差异均极显著。将处理间变异进一步分解,发现耐盐和感盐四倍体品种间,以及二倍体组间在盐胁迫20、40和60 d后SOD活性差异均极显著,组内除感盐组在盐胁迫40 d后5个无性系差异不显著外,其他各无性系差异均极显著或显著(见表4)。
受盐胁迫后,四倍体和二倍体马铃薯均随胁迫天数的延长,表现为SOD活性相对值呈降低趋势。感盐对照品种Mainechip在不同盐胁迫天数下,其SOD活性相对值均极显著低于耐盐对照品种Bintje。在盐胁迫20、40、60 d后感盐组SOD活性极显著低于耐盐组,胁迫20 d时,中耐盐组和感盐组有显著差异(感盐组显著低于中耐盐组),盐胁迫40和60 d,二者有极显著差异(感盐组极显著低于中耐盐组)。这说明根据植株性状在盐胁迫条件下的表现所建立的不同组,其生理性状叶片SOD活性也会随之不同。然而,耐盐程度不同的组在盐胁迫相同天数后极差有相互重叠现象(见表5)。

表4 PHU-STN二倍体马铃薯和四倍体对照在30 mmol·L-1盐胁迫下不同天数叶片SOD活性的方差分析Table 4 Analysis of variance on leaf SOD activity for diploid PHU-STN clones and tetraploid control varieties at different days after salt stress of 30 mmol·L-1

表5 不同浓度盐胁迫下四倍体对照及二倍体马铃薯组间SOD活性Table 5 Leaf SOD activity of tetraploid control varieties and diploid potato groups under salt stress
2.3盐胁迫对二倍体马铃薯过氧化物酶活性的影响
在盐浓度为30 mmol·L-1胁迫下,各处理组在胁迫20、40和60 d后POD活性差异均极显著。将处理间的变异进一步分解,发现耐盐和感盐四倍体品种间在胁迫20、60 d时差异极显著或显著,二倍体组间在胁迫20、40和60 d后POD活性差异均极显著,组内除耐盐组、中耐盐组、感盐组在盐胁迫60 d后5个无性系差异不显著外,其他各无性系差异均极显著或显著(见表6)。
受盐胁迫后,四倍体和二倍体马铃薯均随着盐胁迫天数延长,POD活性相对值呈下降趋势。感盐对照品种Mainechip在盐胁迫20、60 d时,其叶片POD活性相对值均极显著或显著低于耐盐对照品种Bintje。在盐胁迫20、40、60 d后,感盐组POD活性相对值极显著低于耐盐组、感盐组极显著低于中耐盐组,说明根据植株性状在盐胁迫条件下的表现建立的不同组,其生理性状POD活性也会随之不同。然而,耐盐程度不同的组,在盐胁迫相同的天数后极差有相互重叠现象(见表7)。
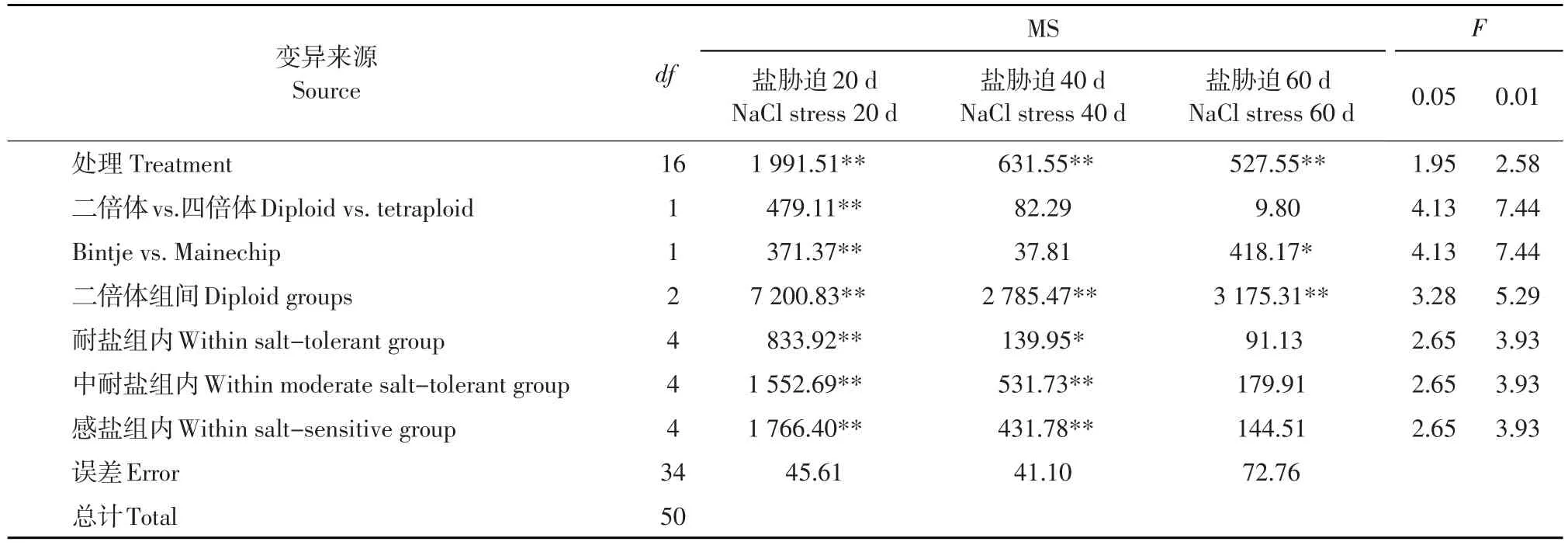
表6 PHU-STN二倍体马铃薯和四倍体对照在30 mmol·L-1盐胁迫下不同天数叶片POD活性的方差分析Table 6 Analysis of variance on leaf POD activity for diploid PHU-STN clones and tetraploid control varieties at different days after salt stress of 30 mmol·L-1

表7 盐胁迫下四倍体对照及二倍体马铃薯组间POD活性Table 7 Leaf POD activity of tetraploid control varieties and diploid potato groups under salt stress
3 讨 论
3.1材料的选择
传统方法研究马铃薯耐盐性进行生理指标测定材料较少[3, 11-13]。而本试验使用耐盐、中耐盐、感盐各5个无性系,增加样本容量,可以考查耐盐、中耐盐、感盐组内各无性系在盐胁迫条件下生理指标的不同反应。
3.2叶绿素与耐盐性
叶绿素和植物光合作用密切相关,其含量在一定程度上体现植物光合能力大小。光合性能影响作物生长、产量和质量。光合色素含量稳定有利于幼苗在盐胁迫下维持正常的光合作用,从而增强幼苗对盐胁迫的耐受能力[14]。研究表明,盐胁迫下植物叶片中叶绿素含量下降[3, 15-19],主要原因是盐胁迫提高叶绿素酶活性,促进叶绿素降解,同时叶绿素合成受到抑制[20]。Strogonov对几种非盐生植物研究表明,盐胁迫可显著提高叶绿素含量[21]。王素平等采用营养液水培法研究不同耐盐性黄瓜品种叶片光合色素变化,结果表明,盐胁迫下,黄瓜幼苗功能叶片chla、chlb、chl、car含量随胁迫时间延长呈先升高后降低趋势[22]。本试验中,随着盐胁迫天数延长,各组叶绿素总含量呈降低趋势,二倍体组间差异极显著,其中耐盐组中267-1品系在盐胁迫20 d时叶绿素含量相对值为118.80,大于100,说明经过20 d处理的267-1品系叶绿素含量比对照(处理0 d)升高,表明短期盐胁迫能够刺激耐盐组中267-1品系光合色素合成,长时间胁迫则提高叶绿素酶活性,使光合色素合成减少、分解增加,叶绿素含量明显降低,这与其他研究结果[23-25]一致。
3.3抗氧化酶活性与耐盐性
盐胁迫下植物容易产生活性氧,活性氧如果不及时清除,会引发脂质过氧化和蛋白的交联,进而损害细胞膜结构和功能的完整性[26],对植物细胞产生氧化毒害[27]。SOD和POD是清除活性氧的关键酶[28]。许帼英等研究得出,随着盐胁迫时间延长,木地肤SOD活性呈先升后降趋势,POD活性则变化较缓慢[29];钟新榕等对盐胁迫黄瓜的研究表明,POD活性随胁迫时间延长先增后降[30];研究表明,盐胁迫下植物的抗氧化酶活性下降[31-33]。本试验中,随着盐胁迫天数延长,马铃薯SOD、POD活性呈降低趋势,二倍体组间差异极显著,与前人研究结果一致。
4 结论
本试验中,通过叶绿素含量,SOD、POD活性的测定,二倍体组间这三项生理指标差异极显著,与植株性状表型具有一致性。因此,叶绿素含量、SOD和POD活性可作为二倍体马铃薯耐盐性鉴定生理指标。
[参考文献]
[1]郭蓓,邱丽娟,李向华.植物盐诱导基因的研究进展[J].农业生物技术学报, 1997, 7(4): 401-408.
[2]肖雯,贾恢先,蒲陆梅.几种盐生植物抗盐生理指标的研究[J].西北植物学报, 2000, 20(5): 818-825.
[3]张俊莲,陈勇胜,武季玲,等.盐胁迫下马铃薯耐盐相关生理指标变化的研究[J].中国马铃薯, 2002, 16(6): 323-327.
[4]崔焱森,张俊莲,李学才,等.马铃薯试管苗对盐胁迫的生理反应[J].中国马铃薯, 2007, 21(1): 1-5.
[5]张瑞玖. NaCl胁迫下马铃薯生理生化特性及氮素调控研究[D].呼和浩特:内蒙古农业大学, 2007.
[6]张景云,缪南生,白雅梅,等.二倍体马铃薯耐盐材料的离体筛选[J].中国农学通报, 2013, 29(4): 62-75.
[7]Khrais T, Leclerc Y, Danielle J D. Relative salinity tolerance of potato cultivars assessed by in vitro screening[J]. Am J Potato Res, 1998, 75(5): 207-210.
[8]郝再彬,苍晶,徐仲.植物生理实验技术[M].哈尔滨:哈尔滨工业大学出版社, 2002.
[9]唐启义. DPS数据处理系统[M].第2版.北京:科学出版社, 2010: 77-79.
[10]Gomez K A, Gomez A A. Statistical procedure for agricultural re⁃search[M]. 2nd ed. New York: John Willey and Sons, 1984.
[11]崔焱森,张俊莲,李学才,等.马铃薯试管苗对盐胁迫的生理反应[J].中国马铃薯, 2007, 21(1): 1-5.
[12]李会珍,张志军,许玲,等.离体条件下盐胁迫对马铃薯试管苗叶绿素含量,脯氨酸累积和抗氧化酶活性的影响[J].浙江大学学报:农业与生命科学版, 2006, 32(3): 300-306.
[13]梁春波.马铃薯新型栽培种轮回选择材料耐盐性研究[D].哈尔滨:东北农业大学, 2007.
[14]段九菊,郭世荣.外源亚精胺对NaCl胁迫下黄瓜幼苗耐盐性的影响[J].中国蔬菜, 2005(12): 8-10.
[15]翁森红,蒋尤泉.牧草耐盐性鉴定指标和方法的初步研究[J].中国草地, 1992(1): 30-34.
[16]刁丰秋,章文华,刘友良.盐胁迫对大麦叶片类囊体膜脂组成和功能的影响[J].植物生理学报, 1997, 23(2): 105-110.
[17]陈沁,刘友良,陈亚华.盐胁迫下大麦叶片的活性氧伤害与液泡膜H+-ATPase活性的关系[J].南京农业大学学报, 1998, 21 (3): 21-25.
[18]王仁雷,华春,刘友良.盐胁迫对水稻光合特性的影响[J].南京农业大学学报, 2002, 25(4): 11-14.
[19]史庆华,朱祝军, Khalida Al-aghabary,等.等渗Ca(NO3)2和NaCl胁迫对番茄光合作用的影响[J].植物营养与肥料学报, 2004, 10(2): 188-191.
[20]张其德.盐胁迫对植物及其光合作用的影响[J].植物杂志, 2000(1): 28-29.
[21]Strogonov B P. Structure and function of plant cell in saline habi⁃tats[M]. New York: Halsted Press, 1973: 78-83.
[22]王素平,郭世荣,胡晓辉,等.盐胁迫对黄瓜幼苗叶片光合色素含量的影响[J].江西农业大学学报, 2006, 28(1): 32-38.
[23]冯志红,闫立英,王久兴,等. Na2SO4和CaCl2胁迫对不同黄瓜品种种子萌发和幼苗生长的影响[J].河北农业科学, 2004, 8(4): 47-51.
[24]郭文忠,刘声锋,李丁仁,等.硝酸钙和氯化钠不同浓度对番茄苗期光合生理特性的影响[J].中国农学通报, 2003, 19(5): 28-31.
[25]王宝增,赵可夫.低浓度NaCl对玉米生长的效应[J].植物生理学通讯, 2006, 42(4): 628-632.
[26]宋士清,刘微,郭世荣,等.化学诱抗剂诱导黄瓜抗盐性及其机理[J].应用生态学报, 2006, 17: 1871-1876.
[27]Zhang Q F, Li Y Y, Pang C H, et al. NaCl enhances thyla⁃koid-bound SOD activity in the leaves of C3halophyte Suaeda Sal⁃sa L. [J]. Plant Science, 2005, 168(2): 423-430.
[28]Gomez J M, Jimenez A, Olmos E, et al. Location and effects of long-term NaCl stress on superoxide dismutase and ascorbate per⁃oxidase isoenzymes of pea (Pisum sativum cv. Puget) chloroplasts [J]. Journal of Experimental Botany, 2004, 394 (55): 119-130.
[29]许帼英,李柱,安沙舟.木地肤幼苗细胞膜透性和酶系统对盐胁迫的适应性研究[J].草业科学, 2008, 25(12): 51-55.
[30]钟新榕,郁继华,张国斌. NaCl胁迫及外源ABA和GA3对黄瓜幼苗抗氧化酶活性的影响[J].甘肃农业大学学报, 2005, 8(4): 467-470.
[31]Hemandez J A. Corpass F J, Gome M. et al. Salt-induced oxida⁃tive stress mediated by active oxygen species in pen leaf mito⁃chondria[J]. Physiol Plant, 1993, 89: 103-110.
[32]Liang Y C , Chen Q, Liu Q, et al. Exogenous silicon (Si) increases antioxidant enzyme activity and reduces lipid peroxidation in roots of salt-stressed barley (Hordeum vulgare L.) [J]. Journal of Plant Physiology, 2003, 160(10): 1157-1164.
[33]Lutts S, Kinet J M, Bouharmont J. NaCl-induced senescence in leaves of rice (Oryza sativa L.) cultivars differing in salinity resis⁃tance[J]. Annals of Botany. 1996, 78(3): 389-398.
Zhang Jingyun, Miao Nansheng, Bai Yamei, et al. Effect of NaCl stress on chlorophyll content and antioxidase activity of in vitro diploid potato plantlets[J]. Journal of Northeast Agricultural University, 2015, 46(1): 6-12. (in Chinese with English abstract)
Effect of NaCl stress on chlorophyll content and antioxidase activity of
in vitro diploid potato plantlets
/ZHANG Jingyun1,2, MIAO Nansheng1, BAI Yamei2, WAN Xinjian1, LV Wenhe2
(1. Institute of Vegetable and Flower, Jiangxi Academy of Agricultural Sciences, Nanchang 330200, China; 2. School of Agriculture, Northeast Agricultural University, Harbin 150030, China)
Abstract:The purpose of this research was to study the change in relative physiological traits of hybrid clones (PHU-STN) of Solanumphureja (PHU) and S. stenotomum(STN) in vitro under salt stress. Five salt tolerant, five medium salt tolerant and five salt susceptible PHU-STN clones, which were selected based on six growth parameters, were established, and tetraploid variety Bintje (salt tolerant) and Mainehcip (salt susceptible) were also included in this experiment. These plant materials were exposed to NaCl stress at 30 mmol·L-1, and chlorophyll content, SOD and POD activities were measured at various days after salt stress. Chlorophyll content, SOD, POD activity decreased with days after salt stress; highly significant difference was found among groups with various salt tolerances for chlorophyll content, and SOD and POD activities. Therefore, chlorophyll content, SOD and POD activities are associated to salt tolerance of diploid potatoes.
Key words:potato; salt stress; physiological index
*通讯作者:吕文河,教授,博士生导师,研究方向为马铃薯遗传育种。E-mail:whlu@neau.edu.cn
作者简介:张景云(1980-),女,助理研究员,博士,研究方向为蔬菜遗传育种。zhangjingyun0108@126.com
基金项目:“十一五”国家863项目(2006AA100107)
收稿日期:2014-09-05
文章编号:1005-9369(2015)01-0006-07
文献标志码:A
中图分类号:S532
