玉米苗期室内菌土接种丝黑穗病菌侵染条件的优化
2015-11-11
玉米苗期室内菌土接种丝黑穗病菌侵染条件的优化
王振华,孙培元,李宁宁,邸宏,王禹贺,刘显君,张林,于滔
(东北农业大学农学院,哈尔滨150030)
摘要:研究以高感丝黑穗病玉米自交系黄早四为材料,模拟大田环境在室内研究温度、土壤湿度、菌土浓度等因素对玉米苗期丝黑穗病菌侵染效果的影响。采用正交试验设计,借助PCR检测技术分析9种不同条件下病菌侵染率,通过多重比较筛选出最优侵染条件;在优化的侵染条件下室内接种已知不同抗性级别的20份玉米自交系,并移栽到田间验证侵染效果。结果表明,室内接种丝黑穗病菌最佳侵染条件为土壤湿度20%,菌土浓度1%,20℃光照培养8 h和15℃暗培养16 h变温培养;20份玉米自交系室内接种后移入田间发病率均高于历年田间直接接种发病率,两者呈极显著正相关。研究优化并验证玉米苗期丝黑穗病菌室内侵染条件,可为研究该病室内快速鉴定方法奠定基础。
关键词:玉米;丝黑穗病;室内接种;侵染条件
网络出版时间2015-1-12 9:53:17
[URL]http://www.cnki.net/kcms/detail/23.1391.S.20150112.0953.010.html
王振华,孙培元,李宁宁,等.玉米苗期室内菌土接种丝黑穗病菌侵染条件的优化[J].东北农业大学学报, 2015, 46(1): 1-5.
玉米丝黑穗病菌病原菌为玉米丝轴黑粉菌(Sporisorium reilianum f. sp. zeae),担子菌属。该病是世界性的重要玉米病害[1],最有效的防治方法是培育和利用抗病品种[2],而抗丝黑穗病资源鉴定是培育抗病玉米新品种基础。传统资源评价方式为田间菌土接种法,该法存在鉴定周期长、用地量多、鉴定群体大、受环境影响较大等缺点[3],因此建立室内接种技术尤为重要。檀国庆研究表明,人工室内接种效果主要受培养温度、土壤湿度和菌土浓度等多因素影响[4]。Kispatic等认为病原菌最佳侵染温度为24℃[5],张志德则认为22℃为玉米丝黑穗病菌最佳侵染温度[6],而吴新兰等研究认为最佳侵染温度为25℃[7];刘惕若等研究认为25%土壤含水量条件下发病率最高[8],张志德认为15.5%时发病率最高[6];菌土浓度对玉米丝黑穗病发病率的影响,研究者多认为,菌含量增加发病率随之提高,到达一定浓度后,菌土浓度升高而发病率保持平衡[4,9-10]。上述报道均以单个影响因素为研究对象,而关于丝黑穗病菌侵染条件的多因素分析却鲜见报道。
本研究以高感(HS)玉米自交系黄早四为材料,通过室内模拟田间环境,采用PCR技术检测侵染率与正交试验设计相结合的方法,优化玉米丝黑穗病菌室内最佳侵染条件。同时以20份已知发病率不同的玉米自交系为材料,采用优化的最佳侵染条件接种后移入大田调查发病率,验证接种条件正确性,为探究室内快速鉴定方法提供依据。
1 材料与方法
1.1试验材料
本研究所用高感丝黑穗病玉米自交系黄早四和20份不同抗性级别玉米自交系由东北农业大学玉米研究所提供,自交系田间发病率及抗病等级数据来源于东北农业大学王振华教授、甘肃农业科学院植物保护研究所郭满库、吉林大学高树仁等[11-13]及东北农业大学玉米研究所历年田间鉴定数据。试验用菌为2012年秋季在东北农业大学香坊实验实习基地(哈尔滨)从典型病株上采集病瘿,风干后装布袋内通风处越冬,使用前将病瘿上的菌粉抖落,用40目铜筛筛出冬孢子。试验用黑钙土来自于东北农业大学香坊实验实习基地(哈尔滨)10年内未种植玉米的地块,土壤经2 mm×2 mm筛子筛出后,105℃烘箱内灭菌4~6 h备用。
1.2试验设计
试验以玉米自交系黄早四为材料,采用正交试验设计(见表1),对影响玉米丝黑穗病发病的主要条件土壤湿度、菌土浓度和培养温度3个条件的3个不同水平进行研究,其中高温时光照8 h,低温时暗培养16 h,试验共9个处理,每个处理设置4次重复,每次重复100粒种子。

表1 L9(34)正交试验设计Table 1 L9(34) orthogonal design
1.3室内接种
选取籽粒饱满、大小一致玉米自交系种子,蒸馏水清洗3次后,用浓度为1%次氯酸钠消毒20 min,蒸馏水清洗5次。在发芽盒(长ϑ宽ϑ高=18 cmϑ 14 cmϑ12 cm)内放入600 g高温灭菌土,加水配置成绝对含水量为15%、17%和20%的湿土,种胚朝下将消毒后种子摆在土壤上,每盒播种50粒;用0.5%、1%和3%菌土覆盖在种子上,每粒种子覆盖2 g,厚度约1 cm;再用200 g上述绝对含水量的湿菌土覆盖,摊平不要压实,盖上盖子保湿。发芽盒在人工气候箱中培养,三种不同培养条件见表1。待幼苗长至3叶期时开盖,每盒加入50 mL水,20℃持续光照恒温培养,防止开盖后水分大量蒸发导致苗干旱死亡。
1.4 PCR检测
根据实验室前期研究结果,待每株玉米幼苗长到三叶期时取第3叶叶鞘,用含70%酒精棉擦拭表面,并用含灭菌水的棉花擦拭清除残留酒精,用CTAB小量法提取全部幼苗第3叶叶鞘总DNA。由上海生工合成Xu等所设计的SSR引物SR3[7],序列为5' GCAGCCTCAGCATTACTC 3',5' ATACAC CTGTGACGGCTG 3',PCR反应总体积为30 μL,PCR反应程序为94℃3 min;94℃30 s,56℃40 s,72℃1 min,循环37次;最后72℃延伸5 min。反应产物用1%琼脂糖凝胶电泳检测。
侵染率(%)=PCR检测阳性株数/检测总株数× 100%。
1.5最优室内侵染条件验证
将20份玉米自交系在优化后的玉米丝黑穗病室内最佳侵染及培养条件下接菌种植,当幼苗至3叶期时,将其移栽到哈尔滨市东北农业大学香坊实验实习基地。设置接菌处理与不接菌对照两组处理,采用随机区组设计,每个自交系种植3次重复,处理与对照组同为双行区,每行21株,株距25 cm,行距70 cm,行长5 m。正常田间管理,至乳熟末期,调查其丝黑穗病发病率。
发病率(%)=(发病株数/调查总株数)×100%
与其历年平均发病率进行回归分析,采用邓肯氏新复极差法进行数据差异显著性检测。数据处理和统计分析采用SAS 9.1.3软件和Excel 2010。
2 结果与分析
2.1 PCR技术检测玉米自交系黄早四苗期丝黑穗病菌侵染率
以SSR引物SR3对玉米自交系黄早四人工接种后三叶期时第3叶叶鞘DNA进行PCR检测,部分样品检测结果见图1。
其中,阳性对照和病原菌侵染的样品能够扩增出680 bp特异条带,阴性对照和水对照未扩增出特异条带,说明可以用PCR检测的阳性率作为病原菌侵染率。
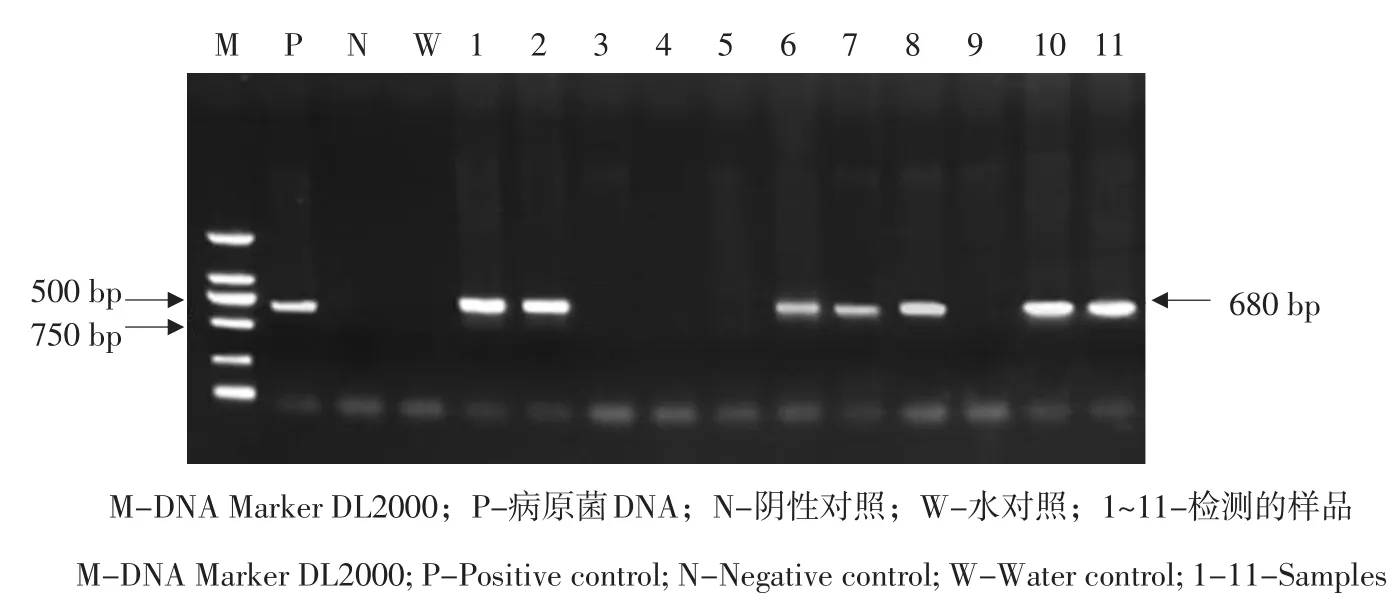
图1 玉米丝黑穗病菌侵染率的PCR检测Fig. 1 PCR result of infection rate of maize head smut
2.2在不同接种培养条件下的病原菌侵染率差异分析
对正交试验9个处理4次重复病原菌对玉米自交系黄早四侵染率的结果进行邓肯氏多重比较,结果见表2。9个处理中处理8和处理1与其他处理差异极显著,其中病原菌侵染率最高的为处理8,即土壤湿度20%、菌土浓度1%、培养温度20℃/15℃变温,其次为处理1;病原菌侵染率最低的为处理4,即土壤湿度17%、菌土浓度0.5%、培养温度25℃/15℃变温条件,侵染率为42.00%。
试验中还发现土壤湿度影响幼苗死亡率,土壤湿度为15%时幼苗死亡率达到14.42%,远高于土壤湿度为17%(死亡率6.92%)和20%(死亡率3.33%)。处理8土壤湿度为20%,在9个处理中平均侵染率最高,同时苗稳定性最优,死亡率也最低。因此本研究确定室内最优的玉米丝黑穗病菌侵染条件为处理8。

表2 不同侵染条件下病原菌侵染率的多重比较Table 2 Multiple comparison results of infection rateunder different treatments
2.3玉米丝黑穗病菌室内接种最优侵染条件的田间验证
本研究对20份不同抗性玉米自交系在上述筛选出的室内最优病原菌侵染条件下接种,3叶期移栽至田间,乳熟期调查发病率,结果见表3。20份自交系人工室内接种后田间平均发病率为38.09%,其中发病率最高的玉米自交系为京七,发病率为94.83%,发病率最低的为齐319,发病率为2.46%。4份高抗玉米自交系人工接种后田间平均发病率为3.87%ϐ发病率最高的为丹9046 (6.12%)ϐ发病率最低的为齐319(2.46%);4份抗病玉米自交系平均发病率为9.93%,发病率最高的为龙抗11(17.03%),发病率最低的为Mo17(3.76%);4份中抗玉米自交系平均发病率为14.56%,发病率最高的为铁7922(23.55%),发病率最低的为郑58 (8.19%);4份感病玉米自交系平均发病率为32.88%,发病率最高的为东237(51.26%),发病率最低的为81162(20.18%);4份高感玉米自交系平均发病率为91.11%,发病率最高的为京七(94.83%),发病率最低的为U8112(83.60%)。
通过差值比较发现,在室内人工接种条件下不同抗性级别自交系室内接种后田间发病率均高于历年田间接种发病率,其中高抗、抗病、中抗、感病和高感玉米自交系两种接种方法发病率平均差值分别为3.71%、7.30%、6.11%、13.41%和12.46%。说明优化后的玉米丝黑穗病室内人工接种侵染方法优于传统田间接种方法。
20份玉米自交系室内接种田间鉴定发病率与20份自交系田间接种鉴定发病率作回归分析(见图2)。
图2结果表明,二者呈极显著正相关,方程为y=1.0894x+6.8184,相关系数r=0.9753(P<0.01)。且随着田间接种鉴定发病率提高,室内接种田间鉴定发病率也随着升高。
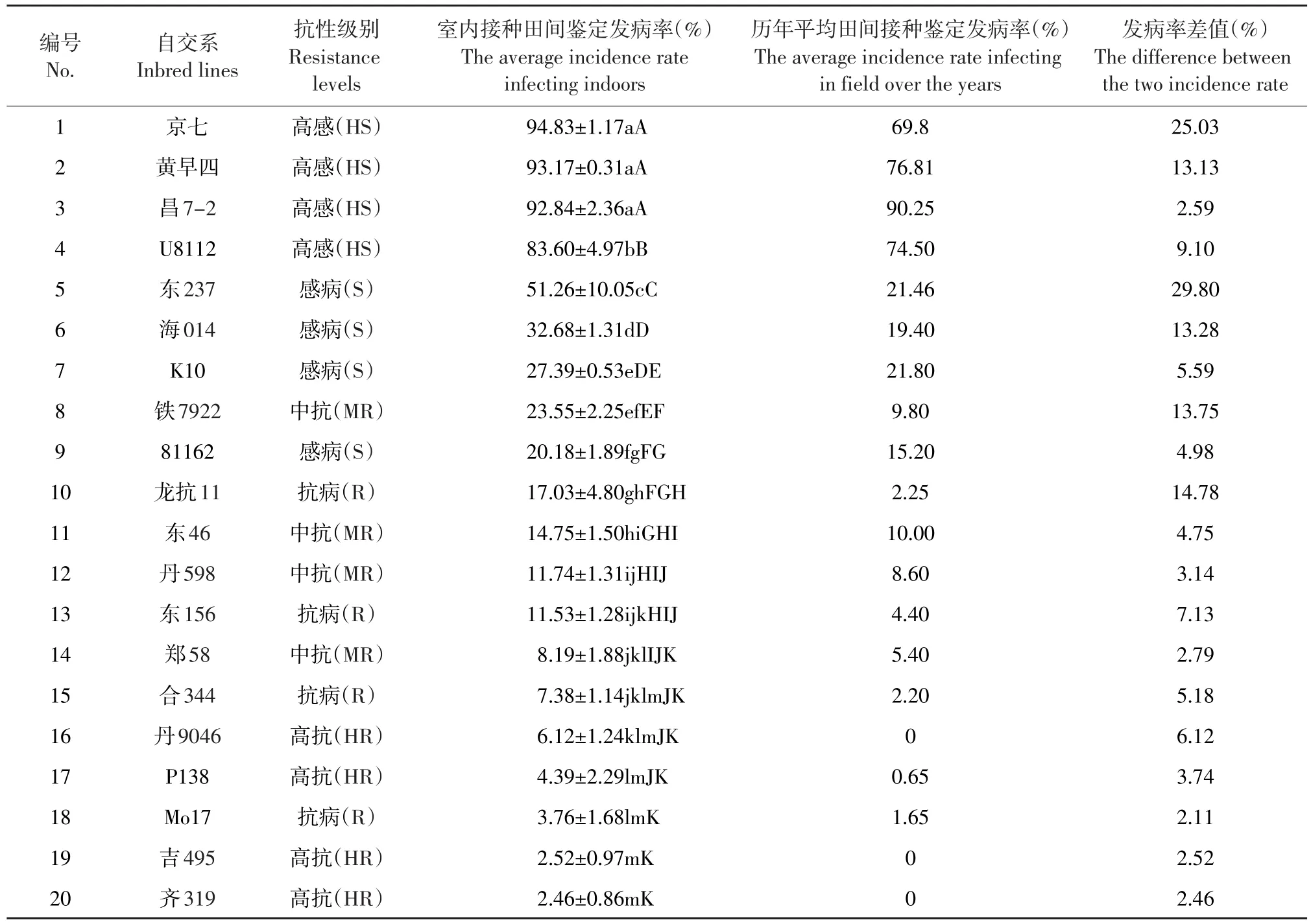
表3 20份不同抗性级别自交系室内接种田间平均发病率与历年田间发病率的比较Table 3 Incidence rate of 20 maize inbred lines between infecting indoor and infecting in field over the years

图2 20份自交系室内接种田间鉴定发病率与历年田间接种鉴定发病率的回归分析Fig. 2 Regression analysis of incidence rate of 20 maize inbred lines between infecting indoor and infecting in field over the years
3 讨论与结论
玉米丝黑穗病病菌主要在种子萌发至7叶期侵染中胚轴、胚根和胚芽等。在根系中以胚根侵染率最高,菌丝侵染幼苗后出现一个潜伏期,伴随玉米生长过程,苗期一些植株叶片会出现褪绿斑点,进入开花期后,在雄穗或雌穗上显症,出现充满孢子堆的病瘿。由于潜伏期长且菌丝伴随植株生长,常规田间菌土接种鉴定方法须等到植株花期显症后,方能进行发病率调查。研究表明,菌丝生长不局限于生殖器官,临近发病器官的茎和叶片以及苗期叶片、叶鞘等均能检测到菌丝存在,且有些时期和部位在抗感材料中存在显著差异[14-15],这为玉米苗期丝黑穗病侵染率的检测提供可能。
目前研究者已将PCR应用到玉米丝黑穗病研究中,开发多个针对玉米丝黑穗病菌检测SSR标记,其中标记SR3[16]主要用于病菌侵染效果的检测,而标记oJS31[17]、AS15[18]主要用于病原菌遗传多样性等方面研究。病原菌侵染后检测取样部位主要为生长点,但取样后玉米幼苗则失去生长能力。本研究前期对不同取样部位进行比较研究,结果发现无论抗病和感病玉米自交系生长点的PCR检测阳性率均较高,无法辨别材料间抗性差异,而在人工接种后取玉米三叶期第3叶叶鞘进行检测,抗感材料间差异大,分辨效果好。因此本研究采用此取样部位进行PCR检测,用以明确不同侵染条件下黄早四发病率差异,筛选出室内接种丝黑穗病菌的最佳侵染条件为土壤湿度20%、菌土浓度1%、20℃光照培养8 h和15℃暗培养16 h的变温培养。通过20份抗性不同的玉米自交系室内接种后移栽到田间的发病率与多年田间接种发病率的关系验证侵染条件可靠性,结果表明在室内人工接种条件下不同抗性级别玉米自交系室内接种后的田间发病率均高于历年田间直接接种发病率,说明玉米丝黑穗病菌室内最优侵染条件下接种,相对于田间接种鉴定,排除侵染时期环境因素的影响,充分证明本试验确定的玉米丝黑穗病菌室内接种条件可靠性,为今后苗期快速评价玉米资源对该病抗性提供可靠方法。
[参考文献]
[1]Pacheco A C, Dittrich R C. Resistance of commercial maize hy⁃brids to head smut[J]. Agropecuaria Catarinense, 1999, 12(2): 44-45.
[2]王振华,姜艳喜,王立丰,等.玉米丝黑穗病研究进展[J].玉米科学, 2002, 10(4): 61-64.
[3]Baggett J R, Koepsell P A. Field inoculation of sweet corn with the head smut pathogen[J]. Hort Science, 1983, 18(1): 37-39.
[4]檀国庆,邢跃先,徐明良,等.玉米丝黑穗病带菌现象的发现与验证[J].玉米科学, 2009, 17(3): 120-123.
[5]Kispatic J, Lusin V. Head smut of maize[J]. Rev Appl Mycol, 1954, 33(5): 291-292.
[6]张志德.玉米丝黑穗病菌侵染的研究[J].西北农林科技大学学报:自然科学版, 1980, 8(4): 67-78.
[7]吴新兰,庞志超,田立民,等.玉米丝黑穗病菌侵染条件与栽培防病措施的研究[J].植物保护学报, 1981, 8(1): 41-46.
[8]刘惕若,薛国兴.玉米丝黑穗病的防治研究[J].黑龙江八一农垦大学学报, 1982(1): 47-48.
[9]董怀玉,姜钰,徐秀德,等.玉米丝黑穗病接种浓度与发病关系研究[J].玉米科学, 2007, 15(5): 139-141.
[10]刘长华,王振华.玉米丝黑穗病田间接种浓度与发病率关系的研究[J].玉米科学, 2008, 16(1): 119-121.
[11]王振华,刘长华,张林,等.玉米丝黑穗病苗期快速鉴定方法[J].植物保护, 2009, 35(6): 99-103.
[12]高树仁.玉米抗丝黑穗病遗传分析及数量性状基因定位[D].长春:吉林大学, 2005.
[13]郭满库,刘永刚,王晓鸣.玉米自交系及群体材料抗丝黑穗病鉴定与评价[J].玉米科学, 2007, 15(5): 30-33.
[14]刘惕若.黑粉菌与黑粉病[M].北京:农业出版社, 1984.
[15]董金皋.农业植物病理学北方本[M].北京:中国农业出版社, 2001.
[16]Bulat S A, Lübeck M, Mironenko N V, et al. UP-PCR analysis and ITS1 ribotyping of Trichoderma and Gliocladium fungi[J]. My⁃col Res, 1998, 102: 933-943.
[17]Schirawski J, Heinze B. Mating type loci of Sporisorium reilianum: Novel pattern with three a and multiple b specificities[J]. Eukary⁃otic Cell, 2005(4): 1317-1327.
[18]张小飞,高增贵,庄敬华,等.利用UP-PCR, ISSR和AFLP标记分析玉米丝黑穗病菌遗传多样性[J].植物保护学报, 2010, 36(3): 241-248.
Wang Zhenhua, Sun Peiyuan, Li Ningning, et al. Indoors infecting factors optimization of maize head smut under seedling stage[J]. Journal of Northeast Agricultural University, 2015, 46(1): 1-5. (in Chinese with English abstract)
Indoors infecting factors optimization of maize head smut under seed⁃
ling stage
/WANG Zhenhua, SUN Peiyuan, LI Ningning, DI Hong, WANG Yuhe, LIU Xianjun,ZHANG Lin, YU Tao
(School of Agriculture, Northeast Agricultural University, Harbin 150030, China)
Abstract:In this study, a high sensitive maize inbred line Huangzao4 was used to check indoors inoculation factors of maize head smut under seedling stage. Using the orthogonal design and PCR technology, we analyzed nine infection treatments and selected the best one based on multiple comparison results. Then the optimized method was identified in 20 maize inbred lines under indoor and field condition. The results showed that the optimized infection conditions of maize head smut fungus were that 20% soil moisture, 1% soil bacteria concentration, and culture condition was 8 h light at 20℃and 16 h dark at 15℃. The incidence of 20 inbred lines showed a significant positive correlation between infecting indoors and in field in several years using regression analysis. The results provided a powerful support to develop the rapid identification method indoor under seedling stage in maize.
Key words:maize; head smut; infecting indoors; inoculation factors
*通讯作者:王振华(1965-),男,教授,博士,博士生导师,研究方向为玉米遗传育种。E-mail:zhenhuawang_2006@163.com
基金项目:国家自然科学基金项目(31371634)
收稿日期:2014-10-30
文章编号:1005-9369(2015)01-0001-05
文献标志码:A
中图分类号:S435.131
