转录因子AtOFP4影响拟南芥表皮细胞的伸长
2015-11-11
转录因子AtOFP4影响拟南芥表皮细胞的伸长
常缨1,张微1,李宏玲1,王鹤萌1,董士嘉2
(1.东北农业大学生命科学学院,哈尔滨150030;2.东北农业大学农学院,哈尔滨150030)
摘要:为分析拟南芥中转录因子AtOFP4在植物生长发育过程中的功能,对拟南芥OVATE基因家族中第I亚组的Atofp4缺失突变体进行筛选与表型分析,对35S:HA-OFP4转基因植株进行表型分析。结果表明,与野生型相比,Atofp4突变体植株表型没有显著变化;而35S:HA-OFP4转基因植株各器官形态结构出现多效畸变,进一步分析发现因地上器官表皮细胞在长轴上显著缩短导致植株各器官形态结构发生变化。GA3处理35S:HA-OFP4转基因植物幼苗,结果表明,GA3对下胚轴生长具有明显补偿作用,说明转录因子AtOFP4与GA3相关。在正常生长条件下,AtOFP4基因过量表达可抑制表皮细胞伸长,影响转基因植物生长发育。
关键词:AtOFP4基因;拟南芥;表型分析;GA3
网络出版时间2015-3-13 15:24:00
[URL]http://www.cnki.net/kcms/detail/23.1391.S.20150313.1524.014.html
常缨,张微,李宏玲,等.转录因子AtOFP4影响拟南芥表皮细胞的伸长[J].东北农业大学学报, 2015, 46(3): 50-58.
Chang Ying, Zhang Wei, Li Hongling, et al. Effect of transcription factor AtOFP4 on epidermal cells elongation in Arabidopsis thaliana[J]. Journal of Northeast Agricultural University, 2015, 46(3): 50-58. (in Chinese with English abstract)
转录因子(Transcription factor)是一种具有特殊结构、行使调控基因表达功能的蛋白质分子,亦称反式作用因子。植物中的转录因子分为两种,一种是非特异性转录因子,可非选择性调控基因的转录表达;另一种为特异型转录因子,能够选择性调控某种或某些基因的转录表达。典型的转录因子含有DNA结合区(DNA- binding domain)、转录调控区(Activation domain)、寡聚化位点(Oligo⁃merization site)以及核定位信号(Nuclear localiza⁃tion signal)等功能区域,这些功能区域决定转录因子的功能和特性[1]。转录因子在调控植物生长发育与器官形态建成,抵御外界生物胁迫与非生物胁迫等方面具有重要调控作用[2]。OVATE基因首次在番茄中被鉴定出,该试验结果表明OVATE基因突变可导致番茄果实由圆形转变成梨形。OVATE基因编码的蛋白内含一个核定位信号,其C端约70个氨基酸序列在植物中是保守的,这个保守区域被称为OVATE结构域,进而,包含这个结构域的蛋白被鉴定为OVATE家族蛋白(OFPs)[3]。Hack⁃busch等提出一个与TALE蛋白相互作用的蛋白网络模型,在这个模型中包含一个从未被鉴定的植物家族蛋白[Arabidopsis thaliana ovate family pro⁃teins(AtOFPs)]。并证明,这些蛋白质控制着TALE蛋白的细胞内定位,对植物发育起重要调节作用。拟南芥AtOFPs是一类新型的、植物特有的转录因子[4]。在拟南芥基因组中可以编码含有OVATE结构域的蛋白基因共有18个[5]。根据拟南芥AtOFPs转基因植株产生的表型类型可将其分为三个亚组:Ⅰ类亚组(AtOFP1、AtOFP2、AtOFP4、AtOFP5和AtOFP7)、Ⅱ类亚组(AtOFP6和AtOFP8)和Ⅲ类亚组(AtOFP13、AtOFP15、AtOFP16和AtOFP18),其他AtOFP基因超表达体未观察到明显的表型[6]。Wang等仅对AtOFP1进行初步研究,研究中发现AtOFP1在拟南芥芽、根、茎、叶、花、花序和角果中均有表达。确定AtOFP1定位在细胞核中,推测是一个活性转录抑制因子,抑制细胞伸长。染色质免疫沉淀试验结果表明AtOFP1直接调控AtGA20ox1表达,而AtGA20ox1是编码GA合成过程中的关键酶基因,通过外源添加GA3能够部分恢复35S:HA-AtOFP1转基因植株的表型[7]。对于在光下生长的植物来说,GA能够促进下胚轴和茎的细胞延长。已有研究表明,在拟南芥中,乙烯、生长素、芸苔素能和GA一起共同促进细胞延伸和下胚轴延长[8-10]。Pagnussat等报道,AtOFP5在早期胚囊发育中,对BLH1- KNAT3起复杂的负调控作用[11]。
最近,研究发现AtOFP4通过与KNAT7相互作用参与调节次生细胞壁形成[5]。由于AtOFP4与 AtOFP1同属Ⅰ类亚组,并且,二者转基因植株表型很相近。那么,AtOFP4在调节植物生长和发育过程中是否也与GA3有关?为研究Ⅰ类亚组中AtOFP4基因在植物生长发育中的功能,本文从三个方面探究:首先对AtOFP4基因缺失突变体进行筛选与鉴定,并进行表型分析;同时对AtOFP4转基因植株进行表型分析;最后通过外源添加GA3试验来探究AtOFP4转基因植株所产生的表型是否与GA有关。本研究通过分析AtOFP4转基因植株对植物生长发育产生的影响,例如使植株矮化、叶片形态改变、果型变化等,探索该基因在植物生长发育过程中的功能,推测整个蛋白家族在植物生长发育中可能行使的功能和相应机制,对研究观赏植物、经济作物生长具有重要意义。
1 材料与方法
1.1材料
野生型拟南芥Columbia(Col)及35S:HA-OFP4转基因植物等由加拿大大不列颠哥伦比亚大学(UBC)植物系陈金桂博士和王树才博士提供。TDNA插入突变体订购自T-DNA插入突变种子库ABRC(Arabidopis biological resource center)。
1.2方法
1.2.1拟南芥培养
所用拟南芥试验材料均为哥伦比亚Columbia (Col)生态型,分别为:野生型(Col)、Atofp4缺失突变体、35S:HA-OFP4转基因植株。将种子放在1.5 mL EP管中,用移液枪加入1 mL 80%酒精,7 000 r·min-1离心2 min,弃酒精;再加1 mL 2.5%次氯酸钠,离心2 min,弃次氯酸钠;最后加1 mL无菌水离心1 min(5次)。种子经消毒后,加入0.5 mL无菌水于EP管中悬浮种子;用移液枪将种子吸到已灭菌含有1%琼脂和3%蔗糖的1/2 MS固体培养基上,将种子铺均匀;用移液枪吸干水,在超净台上用无菌风吹干残留在培养基上的水;点好种子的培养皿用封口膜封好;放到组培架上,垂直光照培养。培养室光周期14 h /10 h(光照/黑暗),光照强度5 000 lx,培养温度为(22±2)℃。7~10 d后,打开培养皿,用镊子把拟南芥幼苗移种到由Hoagland营养液润湿的土壤培养基中(土ϑ蛭石= 1ϑ1),培养条件不变。每天浇水,每3 d浇1次Hoagland营养液。
为最大程度上保证植株生长的微环境相同,进而准确对比分析Col野生型拟南芥与Atofp4缺失突变体、35S:HA-OFP4转基因植株间生长和发育差异,在5×10的育苗穴盘中均匀分布种植野生型、Atofp4缺失突变体、35S:HA-OFP4转基因拟南芥。
1.2.2拟南芥AtOFP4的T-DNA插入缺失突变体的筛选与鉴定
采用CTAB法制备拟南芥基因组DNA。从T-DNA插入突变种子库ABRC订购到SALK_ 022396可能带有T-DNA插入的突变体,利用PCR方法确认其T-DNA插入情况,待T-DNA插入确认后将利用测序法确定其精确的插入位点,并利用RT-PCR验证其基因表达情况,筛选出基因表达缺失性突变体(见表1)。
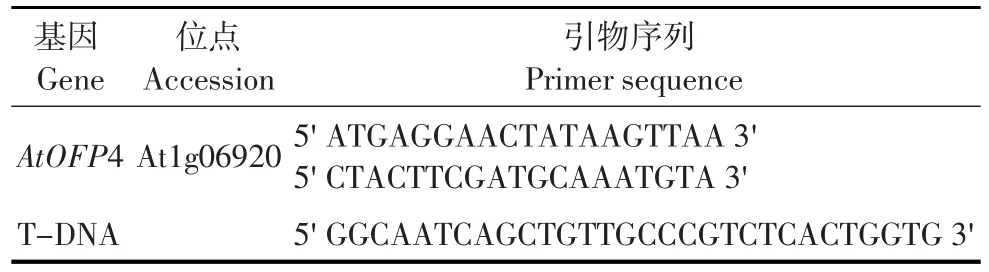
表1 引物序列Table 1 Primer sequence of gene
1.2.3扫描电子显微镜样品制备
对7周龄Col野生型拟南芥及35S:HA-OFP4转基因拟南芥茎、叶、花进行大量取材,将材料避开叶脉切成5 mm×10 mm长方形小块,编号,快速置于改良的50% FAA固定液中,室温下固定24 h以上。用0.1 mol·L-1pH 6.8磷酸缓冲液冲洗3次,每次10 min。分别用浓度为50%、70%、80%、90%乙醇进行脱水,每次10~15 min;100%乙醇脱水3次,每次10 min。100%乙醇ϑ叔丁醇=1ϑ1;叔丁醇各1次,每次15 min。ES-2030(HITACHI)型冷冻干燥仪对样品进行干燥。大约需4 h。将样品用导电胶带粘贴在扫描电子显微镜样品台上。E-1010 (HITACHI)型离子溅射镀膜仪在样品表面镀一层15 nm厚金属膜(金或铂膜)。置于S-3400N(Hita⁃chi)型扫描电子显微镜下进行观察并照像。
1.2.4 GA3处理试验
将Col野生型拟南芥与35S:HA-OFP4转基因拟南芥种子播种到含有0、0.1、1、10 μmol·L-1GA3的1/2MS培养基上(方法见拟南芥培养)。培养条件为21℃,光周期14 h/10 h(光照/黑暗),光照强度5 000 lx。7 d后,观察拟南芥生长情况,测量下胚轴长度。
1.2.5 Col野生型、Atofp4缺失突变体与35S:HAOFP4转基因植株表型观察
对生长在培养室的Col野生型拟南芥、Atofp4缺失突变体、35S:HA-OFP4转基因植株进行观察,拍照。Col野生型拟南芥和35S:HA-OFP4转基因植株生长50 d时,观察植株花序及完全开放的单朵花并拍照。
2 结果与分析
2.1拟南芥AtOFP4基因缺失突变体筛选、鉴定及表型分析
2.1.1 Atofp4-1功能缺失突变体T-DNA插入位置
在NCBI上查询到AtOFP4基因CDS区长度为948 bp,CDS区全部为外显子,编码产物为315个氨基酸的蛋白。其蛋白序列C末端251~307 aa位置为OVATE结构域(DUF623)。在TAIR上查询到类型为T-DNA插入突变,插入位置在外显子上,插入位点在109 bp处,插入旁侧序列长度为333 bp,型号为SALK_022396的Atofp4突变体,命名为Atofp4-1。
2.1.2拟南芥Atofp4-1功能缺失突变体筛选与鉴定
经PCR检测筛选出AtOFP4 T-DNA插入突变体(见图1)。

图1 Atofp4-1缺失突变体鉴定Fig. 1 Identification of Atofp4-1 mutant
以Col野生型拟南芥为阳性对照,以内参基因Actin2为参照,进行RT-PCR鉴定,由图2可以看AtOFP4在突变体中没有表达,说明T-DNA插入Atofp4后阻断该基因的转录翻译,即需要的基因敲除突变体植株,收集突变体Atofp4-1种子,用于下一步表型分析。
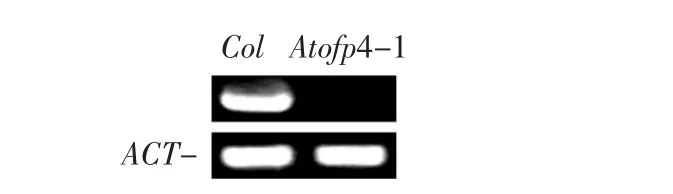
图2 RT-PCR分析AtOFP4在缺失突变体中的表达Fig. 2 RT-PCR analysis of AtOFP4 expression in Atofp4-1mutant
2.1.3拟南芥Atofp4-1缺失突变体的表型分析
经过对子叶、莲座叶,茎生叶、花朵、角果等观察发现Atofp4-1缺失突变体表型与Col野生型拟南芥表型无明显差异,在这里仅以25 d株龄植株作代表加以说明(见图3)。

图3 25 d龄Col野生型拟南芥与Atofp4-1突变体表型Fig. 3 Phenotypes of 25-day-old Col and Atofp4-1 mutant plants
2.2拟南芥35S:HA-OFP4转基因植株的表型分析
2.2.1拟南芥35S:HA-OFP4转基因植株子叶表型分析
在培养基中生长7 d时,Col野生型拟南芥子叶叶片平展光滑,子叶呈卵形(见图4A),而35S: HA-OFP4子叶呈肾型(见图4B)。

图4 Col野生型拟南芥与35S:HA-OFP4植株子叶形态Fig. 4 Cotyledon phenotypes of Col and 35S:HA-OFP4 plants
由于35S:HA-OFP4植株子叶表型发生较大变化,因此进一步观察子叶表皮细胞变化。结果表明,35S:HA-OFP4植株子叶上表皮细胞形态与Col野生型拟南芥上表皮细胞无明显差别,细胞形状均不规则;但在细胞大小上差异明显,35S:HA-OFP4植株上表皮细胞明显小于Col野生型拟南芥,细胞表面积约为Col野生型拟南芥上表皮细胞的80%(见图5)。2.2.2拟南芥35S:HA-OFP4转基因植株莲座叶表型分析
根据对Col野生型和35S:HA-OFP4转基因植株的观察发现两种植株形态不同,35S:HA-OFP4植株小于Col野生型,主要体现在35S:HA-OFP4转基因植株叶柄明显短于Col野生型(见图6)。两种植株叶片大小相似,但其形状不同,Col野生型拟南芥叶片为卵圆形(见图6A),而35S:HA-OFP4转基因植株叶片仍为肾形(见图6B)。

图5 Col野生型拟南芥与35S:HA-OFP4植株子叶上表皮细胞Fig. 5 Epidermal cell of cotyledon of Col and35S:HA-OFP4 plants

图6 Col野生型拟南芥与35S:HA-OFP4植株幼苗表型Fig. 6 Phenotype of seedling in Col and 35S:HA-OFP4 plants
2.2.3拟南芥35S:HA-OFP4转基因植株茎表型分析
2.2.3.1拟南芥35S:HA-OFP4转基因植株株高分析
拟南芥株龄40 d时,35S:HA-OFP4植株形态与Col野生型相比,生长较慢,植株较矮(见图7)。对生长40 d时Col野生型和35S:HA-OFP4转基因拟南芥随机各取30棵植株,对植株株高进行测量,结果表明35S:HA-OFP4转基因植株株高比野生型低约20%(见图8)。
2.2.3.2拟南芥35S:HA-OFP4转基因植株茎表皮细胞分析
观察植株生长时,注意到35S:HA-OFP4植株生长缓慢,植株较矮。即对生长40 d时35S:HAOFP4植株茎表皮细胞进行扫描观察,结果显示35S:HA-OFP4植株细胞沿长轴方向缩短。因此可以推测35S:HA-OFP4植株变矮由细胞延长轴方向缩短引起(见图9)。

图7 Col野生型拟南芥与35S:HA-OFP4植株40 d龄植株形态Fig. 7 Phenotype of 40-day-old Col and 35S:HA-OFP4 plants

图8 Col野生型与35S:HA-OFP4植株40 d龄植株株高Fig. 8 Aerial height of 40-day-old Col and 35S:HA-OFP4 plants

图9 Col野生型拟南芥与35S:HA-OFP4植株40 d时茎表皮细胞形态Fig. 9 Phenotype of epidermal cell of 40-day-oldCol and 35S:HA-OFP4 plants
2.2.4拟南芥35S:HA-OFP4转基因植株花表型分析
Col野生型与35S:HA-OFP4植株培养过程中,注意到35S:HA-OFP4植株花序发育时间晚于Col野生型。因此,对生长45 d的植株顶端花序表型进行观察(见图10A、B),结果显示与Col野生型相比35S:HA-OFP4花序中花柄长度明显缩短,花蕾数目多,花朵数目少。对两种植株单朵花进行观察,结果显示Col野生型拟南芥花蕾正常开放,花瓣伸出萼片,萼片呈椭圆形(见图10C)。与Col野生型相比,35S:HA-OFP4转基因植株萼片变短,整个花朵变小(见图10D)。
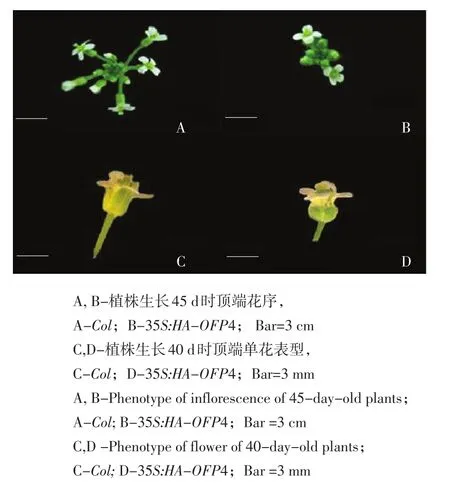
图10 Col野生型拟南芥与35S:HA-OFP4植株花表型Fig. 10 Phenotype of flower of Col and 35S:HA-OFP4 plants
2.2.4.1拟南芥35S:HA-OFP4转基因植株雌蕊表型分析
Col野生型拟南芥柱头表皮细胞沿纵轴明显呈长形,细胞表面有褶皱,柱头乳突细胞较多(见图11A)。35S:HA-OFP4柱头表皮细胞与Col野生型拟南芥柱头表皮细胞相似,细胞沿纵轴方向明显呈长形,细胞长度与Col野生型拟南芥表皮细胞近相等,柱头乳突细胞与Col野生型表型相似(见图11B)。

图11 Col野生型拟南芥与35S:HA-OFP4植株柱头表型Fig. 11 Phenotype of stigma of Col and 35S:HA-OFP4 plants
2.2.4.2拟南芥35S:HA-OFP4转基因植株雄蕊花药表型分析
对35S:HA-OFP4植株雄蕊进行观察,随着花器官发育,Col野生型拟南芥与35S:HA-OFP4植株雄蕊也发生很大变化。Col野生型拟南芥花药呈背着生,花粉囊呈心形,且正常纵裂释放花粉粒(见图12A)。35S:HA-OFP4雄蕊形态与Col野生型拟南芥有显著差异,花粉囊缩短,背面观呈肾型;花药壁增厚,背着药,纵裂释放花粉粒(见图12B)。拟南芥花粉粒能够与柱头细胞进行识别,一旦花粉粒被柱头识别,水合过程很快进行。成熟花粉粒长形,三沟,花粉表面具网状纹饰;花粉水合后近乎球形。对所取材料进行观察,这里仅例举水合后花粉粒形态,观察结果表明35S:HA-OFP4转基因植株花粉粒与Col野生型拟南芥花粉粒形态相似,水合后都呈球形,具三沟,花粉表面具网状纹饰(见图13)。

图12 Col野生型拟南芥与35S:HA-OFP4植株雄蕊表型Fig. 12 Phenotype of stamen of Col and 35S:HA-OFP4 plants

图13 Col野生型拟南芥与35S:HA-OFP4植株花粉粒表型Fig. 13 Phenotype of pollen grain of Col and 35S:HA-OFP4 plants
2.2.5拟南芥35S:HA-OFP4转基因植株果实表型分析
35S:HA-OFP4植株结实后,对其角果进行观察,发现野生型拟南芥角果为正常饱满的长角果,与野生型相比,35S:HA-OFP4转基因植株角果大小形态发生明显变化(见图14A)。35S:HA-OFP4转基因植株角果长度明显减小,饱满程度下降。为探究如此瘦小的角果中可否产生正常种子,进一步对其角果内种子形态进行观察,结果发现35S: HA-OFP4转基因植株种子与野生型种子相比其大小形态并未发生明显改变,均为椭圆形饱满种子(见图14B)。

图14 b Cola野 生型拟南芥与35S:HA-OFP4植株果实形态Fig. 14 Phenotype of fruit of Col and 35S:HA-OFP4 plants
2.3 GA3梯度处理对35S:HA-OFP4植株表型的影响
对在未添加外源GA3的1/2MS培养基上生长7 d时的拟南芥幼苗进行观察,发现在没有外源GA3处理时,Col野生型拟南芥下胚轴正常生长。与野生型相比,35S:HA-OFP4转基因植株下胚轴生长较慢,下胚轴较粗,较短。两者子叶叶柄长度也发生变化,Col野生型拟南芥叶柄较长,而35S: HA-OFP4子叶叶柄较短(见图15A)。
为探究其下胚轴变短原因,对35S:HA- OFP4植株下胚轴进行显微镜观察。结果表明,35S: HA-OFP4下胚轴表皮细胞在长轴方向上缩短,表明在单位长度上细胞数量无明显增加,表明35S: HA- OFP4下胚轴变短因表皮细胞变短所致。进一步观察到35S:HA-OFP4下胚轴表皮细胞长度仅为Col野生型拟南芥表皮细胞1/2(见图16);
正常条件下,7 d龄Col野生型拟南芥下胚轴最长可以达到2.3 mm,而35S:HA-OFP4转基因植株下胚轴最长为1.7 mm,长度约为野生型的74%。随着GA3浓度增加,无论野生型还是35S:HA-OFP4转基因植株下胚轴生长均加快,下胚轴长度均增加(见图15)。

图15 GA3对Col野生型拟南芥与35S:HA-OFP4植株下胚轴表型的影响Fig. 15 Effect of GA3on hycopotyls of Col and 35S:HA-OFP4 plants
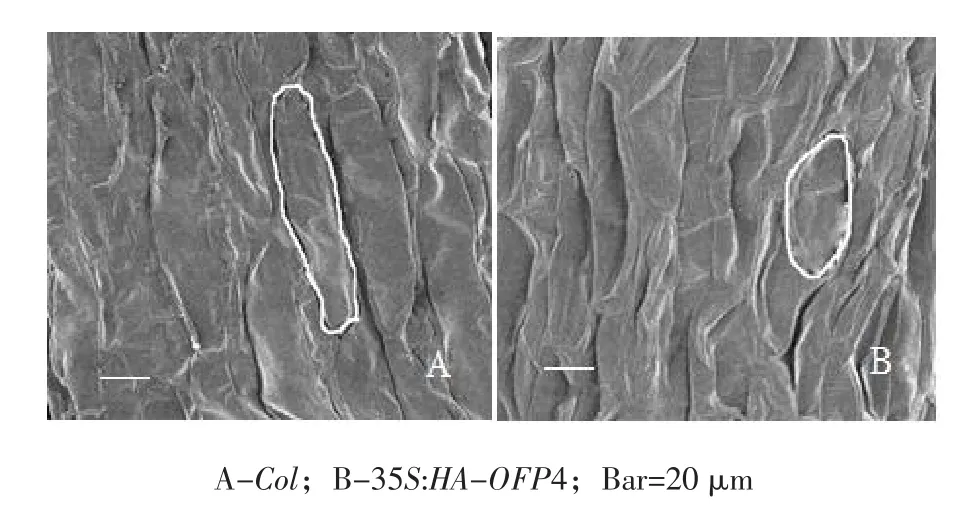
图16 Col野生型拟南芥与35S:HA-OFP4植株下胚轴表皮细胞Fig. 16 Epidermic cell of hycopotyls of Col and35S:HA-OFP4 plants
在GA3浓度为0.1 μmol·L-1时,野生型下胚轴长度约增加6%,而35S:HA-OFP4转基因植株下胚轴约增加21%(见图17);在GA3浓度为1 μmol·L-1时,野生型下胚轴长度约增加14%,而35S: HA-OFP4转基因植株下胚轴约增加37%,此时,35S:HA-OFP4转基因植株下胚轴长度均值约为2.3 mm(见图17),与自然状态下野生型下胚轴长度基本相等,即在1 μmol·L-1GA3浓度下可使35S: HA-OFP4转基因植株下胚轴长度恢复正常;在GA3浓度为10 μmol·L-1时,两种植株下胚轴仍然可以伸长,只是伸长长度不很明显。此时,35S: HA-OFP4转基因植株下胚轴仍短于Col野生型,长度约为Col野生型的84%(见图17)。相比较而言,35S:HA-OFP4转基因植株下胚轴生长加快幅度大于野生型拟南芥。即GA3对35S:HA-OFP4转基因植株下胚轴伸长的影响更为明显。

图17 GA3对Col野生型拟南芥与35S:HA-OFP4植株下胚轴的影响Fig. 17 Effect of GA3on length of hypocotyls of Col and 35S:HA-OFP4 plants
3 讨论
转录水平调控是指一类称为转录因子的蛋白质特异地结合到靶基因调控区的顺式作用元件上,或调节基因表达强度,或控制靶基因的时空特异性表达,或应答外界激素和环境胁迫[12]。AtOFPs转录因子是植物中特有的调控蛋白。AtOF⁃Ps转录因子以蛋白家族的形式存在于拟南芥中,其蛋白家族包括18个成员。Wang等发现拟南芥AtOFPs基因家族中,基因成员之间存在功能冗余现象,将其分成3个亚组[6]。近年学者主要集中于对第Ⅰ亚组成员AtOFP1的研究,已证实AtOFP1为转录抑制因子,定位于细胞核中,通过调控赤霉素合成酶中一个关键基因AtGA20ox1的表达抑制细胞伸长[7]。AtOFP4与AtOFP1同属于第Ⅰ亚组,AtOFP4通过与KNAT7相互作用参与调节次生细胞壁的形成[5]。由于GA和细胞伸长有关联,而且已有研究表明,AtOFP1与GA相关,对野生型与35S: HA-OFP4转基因植株进行不同浓度GA3处理,探究AtOFP4与GA3关系。认为比较传统但最具有说服力研究基因功能的方法是利用基因敲除技术或转基因技术[13]。本试验采取基因敲除与转基因技术研究转录因子AtOFP4在植物生长发育过程中的功能。结果表明经基因敲除获得的缺失突变体表型与野生型很相似,几乎无特殊表型,再次验证AtOFPs基因家族中各基因之间功能冗余。而35S: HA-OFP4转基因植株表型发生很大变化。
3.1拟南芥AtOFP4基因对细胞长度的调控
子叶在传统研究中被作为种子的一部分,近年来植物发育生物学研究结果表明,子叶形态构建是由不同基因控制的建成过程,与种子发育过程调控基因不一致。例如拟南芥Leafy cotyledon1 (lec1)突变体子叶失去储藏养分的功能,在形态上表现出真叶的特征,但幼胚加以适当培养仍可发育成正常植株[14-16]。因此本试验认为子叶形态调控与营养叶形态调控应属同一范畴。
根据35S:HA-OFP4转基因植株可使拟南芥子叶由卵圆形转变成肾型,推测AtOFP4是子叶形态建成的相关基因。经过对表皮细胞的观察,结果发现表皮细胞在长轴方向上缩短导致细胞排列形态发生改变,子叶长宽比显著降低,宏观表现为子叶肾型。对35S:HA-OFP4植株莲座叶进行表型观察,结果显示叶面积变小,叶片发生褶皱。通过分析推测35S:HA-OFP4植株莲座叶形态改变由细胞长宽比例改变引起。因此推测AtOFP4可能通过改变细胞长宽比影响子叶及叶片形态建成。
植物细胞长度增加是植物茎伸长原因之一,赤霉素最显著作用是促进茎伸长[17]。根据植物矮化突变体对外源施加激素表现,将其分为激素缺陷型和激素不敏感型两类[18]。本研究中35S:HA-OFP4转基因植株与野生型相比,出现明显矮化现象,转基因植株表现出来的这种矮化表型,对外源添加的激素能够产生哪种反应呢?GAs是一类生长促进物质,对其功能的研究主要体现在突变体表型上,当把GAs生物合成过程中有关基因敲除或过表达之后,会呈现出相应短或长的下胚轴表型[19 -20]。GAs家族中GA3对下胚轴生长作用较大,内源GA3含量变化趋势与油菜下胚轴伸长趋势一致,外施GA3能明显增加油菜幼苗下胚轴细胞长度,促进突变体下胚轴伸长[21]。本试验中通过对茎表皮细胞观察发现,35S:HA-OFP4转基因植株表皮细胞长度明显短于野生型,推测茎的缩短可能与表皮细胞沿长轴面上缩短有关。为进一步探究转基因植株矮化是否与GA3有关,试验设计外源添加不同浓度GA3对下胚轴影响的试验。试验结果表明外源GA3对35S:HA-OFP4植株下胚轴生长起到补偿作用。这与Wang等对AtOFP1研究结果一致,即AtOFP4与AtOFP1在植物生长发育发面功能相似。在GA3浓度为1 μmol·L-1时,转基因植株下胚轴长度基本恢复到正常野生型,即AtOFP4蛋白对植株下胚轴的影响类似于激素缺陷型矮化突变体,通过外源施加GA3能够使其恢复野生型表型,推测AtOFP4可能通过抑制GA3生物合成影响下胚轴伸长。而本研究中35S:HA-OFP4转基因植株高度与野生型相比,明显下降,与GA3生物合成相关,抑制GA3生物合成,使植物体内源GA3含量降低,导致转基因植株矮化。
3.2拟南芥AtOFP4基因对花器官生长发育的调控
根据花器官发育的“ABC模型”,被子植物四轮花器官的特征由A、B、C三类同源异型基因的功能决定。每类基因均在相邻的两轮花器官中表达,A类和C类基因相互拮抗。A类基因单独作用决定萼片特征,A类和B类基因作用决定花瓣产生,B类和C类基因共同决定雄蕊形成,而心皮特征由C类基因功能决定[22]。在拟南芥中,APETALA1 (AP1)和APETALA2(AP2)属于A类功能基因,在第1轮中产生萼片[23-24]。AP1既是花分生组织的特征基因,又是花器官的特征基因。在花分化初期,其在整个花原基里表达;在花器官分化阶段,AP1在萼片和花瓣中表达[25-26]。决定花器官突变体基因研究表明,除AP2外,所有与花器官发育相关的功能基因都是转录因子,含高度保守的DNA结合结构域,属于MADS-box家族。这些转录因子与相应DNA区域结合调控该基因转录[23-24]。本研究中,AtOFP4是一个潜在的转录因子,而35S:HA-OFP4转基因植株花的萼片短小,推测,AtOFP4可能与AP1相互作用,调控萼片发育。
原位杂交检测花粉囊结果显示,OsGA3ox1在绒毡层有表达,表明GA也具有调控花粉囊发育作用[27]。拟南芥中GA20-氧化酶基因家族中有5个成员,即AtGA20ox1、AtGA20ox2、AtGA20ox3、AtGA 20ox4和AtGA20ox5。AtGA20ox1在茎和花序中表达,AtGA20ox2在花序和发育中的荚果中表达,过量表达GA20-氧化酶促进拟南芥提前开花[28]。研究发现,AtGA20ox2突变体表现出开花时间稍有延迟,而GA20ox1GA20ox2双突变体表现为开花时间显著延迟[29]。
根据本试验观察结果显示,35S:HA-OFP4转基因植株花粉囊干瘪,可能与GA有关。为探究在这种情况下,35S:HA-OFP4转基因植株能否正常受精结实。经过观察,发现35S:HA-OFP4转基因植株受精结实,可产生种子(见图14B),种子可正常萌发生长,但角果十分瘦小(见图14A),种子产量很低。这可能与花粉囊干瘪相关。同一时期35S: HA-OFP4转基因植株的花期迟于野生型(见图10A)。这与Rieu等对拟南芥ga20ox2突变体研究结果相似[29],即在35S:HA-OFP4转基因植株中,GA20-氧化酶基因表达受到抑制。推测AtOFP4通过抑制GA合成过程中关键基因的表达,降低植物体内GA含量,影响拟南芥花发育及其角果形成。
[参考文献]
[1]李杰.植物转录因子与基因调控[J].生物学通报, 2004, 39(3): 9-10.
[2]杨致荣,王兴春,李西明,等.高等植物转录因子的研究进展[J]遗传, 2004, 26(3): 403-408 .
[3]Liu J, Van Eck J, Cong B, et al. A new class of regulatory genes underlying the cause of pear-shaped tomato fruit [J]. Proc Natl Acad Sci USA, 2002 , 99: 13302-13306.
[4]Hack Busch J, Richter K, Muller J, et al. A central role of Arabi⁃dopsis thaliana ovate family proteins in networking and subcellu⁃lar localization of 3-aa loop extension homeodomain proteins [J]. Proc Natl Acad Sci USA , 2005, 102: 4908-4912.
[5]Li E, Wang S, Liu Y, et al. Ovate Family protein4 (OFP4) interac⁃tion with KNAT7 regulates secondary cell wall formation in Arabi⁃dopsis thaliana [J]. Plant J, 2011, 67: 328-341.
[6]Wang S, Chang Y, Guo J, et al. ArabidopsisOvate family pro⁃teins, a novel transcriptional repressor family, control multiple as⁃pects of plant growth and development[J]. PLoS ONE, 2011, 6(8): 1-11.
[7]Wang S, Chang Y, Guo J, et al. Arabidopsis Ovate family protein 1 is a transcriptional repressor that suppresses cell elongation[J]. Plant J , 2007, 50: 858-872.
[8]Symons G M, Reid J B. Hormone levels and response during de-etiolation in pea[J]. Planta, 2003, 216: 422-431.
[9]Saibo N J, Vriezen W H, Beemster G T, et al. Growth and stomata development of Arabidopsis hypocotyls are controlled by gibberel⁃lins and modulated by ethylene and auxins[J]. Plant J, 2003, 33: 989-1000.
[10]Tanaka K, Murata K, Yamazaki M, et al. Three distinct rice cel⁃lulose synthase catalytic subunit genes required for cellulose syn⁃thesis in the secondary wall[J]. Plant Physiol, 2003, 133: 73-83.
[11]Pagnussat G C, Yu H J, Sundaresan V. Cell-fate switch of syner⁃gid to egg cell in Arabidopsis eostre mutant embryo sacs arises from misexpression of the BEL1-like homeodomain gene BLH1 [J]. Plant Cell, 2007, 19: 3578-3592.
[12]陈俊,王宗阳.植物MYB类转录因子研究进展[J].植物生理与分子生物学学报, 2002, 28 (2): 81-88.
[13]纪宗玲,刘继中,陈苏民.基因功能的研究方法[J].生物工程学报, 2002 , 18(1): 117-120.
[14]Meinke D W. A homeotic mutant of Arabidopsis thaliana with leafy cotyledons[J]. Science, 1992, 258: 1647-1650.
[15]West M A L W, Yee K M, Danao J, et al. LEAFY COTYLEDON1 is an essential regulator of late embryogenesis and cotyledon iden⁃tity in Arabidopsis[J]. Plant Cell, 1994(6): 1731-1745.
[16]Lotan T, Ohto M, Yee K M , et al. Arabidopsis LEAFY COTYLE⁃DON1 is sufficient to induce embryo development in vegetative cells[J]. Cell, 1998, 93: 1195-1205.
[17]王丽,李梅兰,田彩芳,等.赤霉素处理对白菜生长发育的影响[J].山西农业科学, 2009, 37(3): 58-60.
[18]王月华,韩烈保,曾会明,等.植物赤霉素矮化突变体研究进展[J].中国生物工程杂志, 2006, 26(8): 22-27.
[19]Sun T P, Kamiya Y. The Arabidopsis Ga1 locus encodes the cy⁃clase ent-kaurene synthetase-a of gibberellin biosynthesis[J]. Plant Cell, 1994, 6(10): 1509-1518.
[20]Reed J W, Foster K R, Morgan D W, et al. Phytochrome B affects responsiveness to gibberellins in Arabidopsis[J]. Plant Physiology, 1996, 112: 337-342.
[21]高勇,赵云,刘薇,等.激素对甘蓝型油菜矮化突变体幼苗生长及内源GA3含量的影响[J].四川大学学报:自然科学版, 2007, 44(5): 1133-1137.
[22]Coen E S, Meyerowitz E M. The war of the whorls: genetic interac⁃tions controlling flower development[J]. Nature, 1991, 353: 31-37.
[23] Theissen G, Becker A, Di Rosa A, et al. A short history of MADS-box genes in plants[J]. Plant Mol Biol, 2000, 42(1): 115-149.
[24]Theissen G. Development of floral organ identity: stories from the MADS house[J]. Curr Opin Plant Biol, 2001, 4(1): 75-85.
[25]Mandel M A, Gustafson-Brown C, Savidge B, et al. Molecular characteri-zation of the Arabidopsis floral homeotic gene APETALA1[J]. Nature, 1992, 360(6401): 273-277.
[26]Gustafson-Brown C, Savidge B, Yanofsky M F. Regulation of the Arabidopsis floral homeotic gene APETALA1[J]. Cell, 1994, 76 (1): 131-143.
[27]Itoh H, Ueguchi-Tanaka M, Sentoku N, et al. Cloning and func⁃ tional analysis of two gibberellin 3β-hydroxylase genes that are differently expressedduring the growth of rice[J]. Proc Natl Acad Sci USA, 2001, 98: 8909-8914.
[28]Huang S, Raman A S, Ream J E, et al. Overexpression of 20-oxi⁃dase confers a gibberellinoverproduction phenotype in Arabidopsis [J]. Plant Physiol, 1998, 118: 773-781.
[29]Rieu I, Ruiz-Rivero O, Fernandez-Garcia N, et al. The gibberel⁃lin biosynthetic genes AtGA20ox1 and AtGA20ox2 act, partially redundantly, to promote growthand development throughout the Arabidopsis life cycle[J]. PlantJ, 2008, 53: 488-504. 232(1-2): 68-78.
[6]Coban A, Filipov N M. Dopaminergic toxicity associated with oral exposure to the herbicide atrazine in juvenile male C57BL/6 mice [J]. Journal of Neurochemistry, 2007, 100(5): 1177-1187.
[7]Barraclough C A. Neural control of the synthesis and release of luteinizing hormone-releasing hormone[J]. CIBA Foundation Symposium, 1992, 168(5): 233-251.
[8]Moore A, Waring C P.Sublethal effects of the pesticide diazinon on olfactory function in mature male Atlantic salmon Parr[J]. Journal of Fish Biology, 1996, 48(4): 758-775.
[9]Hussein S Y, Ei-nasser M A, Ahmed S M.Comparative studies on the effects of herbicide atrazine on freshwater fish Oreochromis niloticus and Chrysichthyes auratus at Assiut, Egypt[J]. Bulletin of Environmental Contamination and Toxicology, 1996, 57(3): 503-510.
[10]王皓. Atrazine对斑马鱼神经系统发育及功能的影响[D].保定:河北大学, 2007.
[11]Dayall A D.Clinical and experimental toxicology of organophosphates and carbamates[J]. Journal of Clinical Pathology, 1993, 46 (1): 95.
[12]Sherman J D. Organophosphate pesticides-neurological and respiratory toxicity[J]. Toxicology and Industrial Health, 1995, 11 (2): 33-39.
[13]刘晶玉,吴海花,郭亚平,等.辛硫磷及毒死蜱对中华稻蝗的毒力研究[J].山西农业大学学报:自然科学版, 2007(4): 424-426.
[14]王希英,张国林.急性有机磷农药中毒患者血清蛋白水平的变化[J].中华劳动卫生职业病杂志, 2004, 22(4): 274-275.
[15]Hooser S B, Beasley V R, Sundberg J P, et al.Toxicologic evaluation of chlorpyrifos in cats[J]. American Journal of Veterinary Research, 1988, 49(8): 1371.
[16]余向阳,赵于丁,王冬兰,等.毒死蜱和三唑磷对斑马鱼头部AChE活性影响及在鱼体内的富集[J].农业环境科学学报, 2008, 27(6): 2452-2455.
[17]侯方浩,余向阳,赵于丁,等.毒死蜱对锦鲫性腺的影响及其在鱼组织中的富集[J].江苏农业学报, 2009, 25(1): 188-191.
[18]Rauh V A, Garfinkel R, Perera F P, et al.Impact of prenatal chlorpyrifos exposure on neurodevelopment in the first 3 years of Life among inner-city children[J].Pediatrics, 2006, 118(6): 1845-1859.
[19]Breslin W J, Liberacki A B, Dittenber D A, et al. Evaluation of the developmental and reproductive toxicity of chlorpyrifos in the rat [J]. Toxicological Sciences, 1992, 108(3): 474-482.
[20]Barron M G, Plakas S M, Wilga P C. Chlorpyrifos pharmacokinet⁃ics and metabolism following intravascular and dietary administra⁃tion in channel catfish[J]. Toxicology and Applied Pharmacology, 1991, 108(3): 474-482.
[21]秦占芬,李岩,秦晓飞,等.非洲爪蟾在生态毒理学研究中的应用(Ⅲ)-生殖内分泌干扰作用的评价[J].生态毒理学报, 2009, 4(3): 315-323.
[22]索琪.除草剂阿特拉津对大鼠卵巢组织氧化应激损伤的研究[D].长春:吉林大学, 2013.
[23]赵荣伟.阿特拉津和毒死蜱对鲤生殖发育及抗氧化能力的研究[D].哈尔滨:东北农业大学, 2014.
Effect of transcription factor AtOFP4 on epidermal cells elongation in
Arabidopsis thaliana
/CHANG Ying1, ZHANG Wei1, LI Hongling1, WANG Hemeng1, DONG
Shijia2
(1. School of Life Sciences, Northeast Agricultural University, Harbin 150030, China; 2. School of Agriculture, Northeast Agricultural University, Harbin 150030, China)
Abstract:In order to explore the function of Arabidopsis thaliana transcription factor AtOFP4 in plant growth and development, we screened T-DNA insertion mutant of AtOFP4 which is one of Class I of Arabidopsis thaliana OVATE family protein AtOFPs. Phenotype of the Atofp4 mutant and 35S:HA-OFP4 transgenic plants we got before was analyzed. The results showed that Atofp4 mutants were similar to wild type plants, no visible difference in morphologic phenotype. However 35S:HA-OFP4 transgenic plants showed multi-effect distortion in organ shape and structure. Further analysis found that the epidermal cells of ground organs in plants overexpressing AtOFP4 were significantly shortened on the long axis, leading to significant change in shape and structure of plant organs. Exogenous GA3could partially restore defects in hypocotyl elongation in 35S:HA-OFP4 transgenic plants, suggesting a connection between AtOFP4 and GA3. Taken together, our results showed that over expression of AtOFP4 gene could influence epidermic cell elongation, resulting in deficiency in growth and development of transgenic plants.
Key words:AtOFP4genes; Arabidopsisthaliana; phenotypic analysis; GA3
作者简介:常缨(1970-),女,教授,博士,博士生导师,研究方向为植物资源学与植物分子生物学。E-mail: changying@neau.edu.cn
基金项目:国家自然科学基金面上项目(31370221)
收稿日期:2014-11-18
文章编号:1005-9369(2015)03-0050-09
文献标志码:A
中图分类号:Q785
