嗜酸乳杆菌不同成分体外抗TGEV作用的研究
2015-11-11
嗜酸乳杆菌不同成分体外抗TGEV作用的研究
魏萍,刘冠群,贾国东,赵毅博,夏璐
(东北农业大学动物医学学院,哈尔滨150030)
摘要:文章探讨嗜酸性乳杆菌不同成分在抗猪传染性胃肠炎病毒(TGEV)中的作用,并分析益生菌抗病毒可能存在的机制。试验分离嗜酸乳杆菌不同成分和TGEV氨肽酶受体抑制剂Bestatin,按照感染后处理组、处理后感染组和同时感染处理组试验。采用MTT法,在猪睾丸细胞(ST)上评价各成分对TGEV抑制作用。在Bestatin封闭ST细胞基础上添加S-层蛋白,研究二者联合作用。结果表明,抑制率大小顺序:S-层蛋白>菌体>脱S-层蛋白菌体>代谢产物>牛血清白蛋白。S-层蛋白对TGEV抑制作用与Bestatin相当。由此可知,嗜酸乳杆菌S-层蛋白对TGEV 在ST细胞上的复制有抑制作用。氨肽酶抑制剂Bestatin预先处理ST细胞对S-层蛋白抑制TGEV的感染具有协同作用。
关键词:嗜酸乳杆菌;S-层蛋白;抗病毒
网络出版时间2015-3-13 15:21:00
[URL]http://www.cnki.net/kcms/detail/23.1391.S.20150313.1521.002.html
魏萍,刘冠群,贾国东,等.嗜酸乳杆菌不同成分体外抗TGEV作用的研究[J].东北农业大学学报, 2015, 46(3): 59-66.
仔猪病毒性腹泻是猪场常发且危害严重的一类传染病,目前尚无有效预防该类疾病的商品化药物。多种益生菌可以抑制细菌性腹泻且部分益生菌具有抗病毒作用,同时具有安全可靠、增加营养物质吸收、增强粘膜屏障、提高免疫力等优点[1]。这些益生菌在抗病毒过程中,其多种成分可发挥抗病毒作用[2]。其中,存在于某些益生菌菌株表面的S-层蛋白有较强抗病毒能力[3]。Martínez等研究表明S-层蛋白可与树突状细胞受体结合而抑制病毒感染[4]。对益生菌的抗病毒研究很多,但其抗病毒机制研究较少。本文旨在筛选出抗传染性胃肠类(TGEV)且具有S-层蛋白的益生菌菌株,探究S-层蛋白的抗病毒机制。为进一步研究益生菌抗病毒机制和研发抗病毒益生菌制剂奠定理论基础。
1 材料与方法
1.1材料
一株嗜酸乳杆菌(La-A),用LAC表示,由东北农业大学动物医学学院预防兽医传染病实验室保存;DMEM/F12细胞培养基、胎牛血清购自Hyclone公司;MRS培养基、MTT、二甲基亚砜(DMSO)、LiCl、牛血清白蛋白(BSA)购自Sigma公司;猪睾丸细胞(ST)由东北农业大学动物医学学院预防兽医传染病实验室保存;猪传染性胃肠炎病毒(TGEV)TO163株,由哈尔滨兽医研究所馈赠。
1.2方法
1.2.1嗜酸乳杆菌S-层蛋白鉴定
1.2.1.1嗜酸乳杆菌S-层蛋白提取及SDS-PAGE检测
按照Karen等酸性LiCl方法制备S-层蛋白[5]。按1%接种量在MRS培养基中加入菌种,37℃恒温过夜培养。去培养物于4℃,5 000 r·min-1离心5 min。PBS洗涤菌体两次。菌体用5 mol·L-1LiCl悬起,室温处理30 min。4℃,12 000 r·min-1,离心10 min,保留上清。将上清液转移至透析袋中,在50 mmol·L-1Tris-HCl(pH 7.5)溶液中,4℃透析24 h,每12 h换1次透析液。利用PEG 20000对样本适量浓缩。收集透析袋中液体转移至EP管中。4℃,12 000 r·min-1,离心10 min,保留上清。测定所提取的蛋白浓度并做SDS-PAGE,测定蛋白分子质量。
1.2.1.2嗜酸乳杆菌Slp基因提取
将培养好的嗜酸乳杆菌按照Vilgalys介绍方法提取DNA[6],并略有改进,具体步骤如下:取1.5 mL新鲜培养物,4℃、12 000 r·min-1离心5 min。弃上清,加200 μL裂解液,再加溶菌酶和蛋白酶K,56℃温浴1.5 h。加66 μL 5 mol·L-1NaCl,12 000 r·min-1离心10 min。取上清加等体积酚,静止3 min,12 000 r·min-1离心10 min。再取上清加等体积氯仿异戊醇混合液静止5 min,12 000 r·min-1离心10 min。取上清重复步骤4、5。取上清加0.6倍体积的异丙醇室温静止10 min后12 000 r·min-1离心10 min。弃上清加400 μL的75%乙醇洗涤沉淀,12 000 r·min-1离心10 min。室温静止待乙醇挥发尽。加50 μL TE缓冲液悬起沉淀,-20℃保存备用。根据GenBank已发表的SlpA序列,设计1对引物,由大连宝生物公司合成,具体序列为:PF:5' GAATYGTKAGCGCTSCTGCTGC 3';PR:5' GTAAACGTAWGCGTTGTGCTTC 3',目的基因大小为1 200 bp。95℃预变性5 min,94℃变性1 min,56℃退火45 s,72℃延伸1 min,30个循环。用1%琼脂糖凝胶电泳检测。
1.2.2嗜酸乳杆菌各成分的提取
取生长对数期的嗜酸乳杆菌,细菌数目为108cfu·mL-1。菌体:将处理好的菌液3 000 r·min-1离心10 min,取沉淀;S-层蛋白:按照1.2.1.1提取S-层蛋白;脱S-层蛋白菌体的处理:将菌液按照1.2.1.1方法,收集菌体,即得到脱S-层蛋白的菌体;代谢产物:将处理好的菌液12 000 r·min-1离心10 min,取上清,用0.22 μm滤器过滤,收集滤液;牛血清白蛋白:将牛血清白蛋白,按S-层蛋白各稀释度等浓度配置。经预试验Bestatin的最大试验浓度为8.0 mg·mL-1。
1.2.3嗜酸乳杆菌各成分细胞毒性测定
分别将各浓度嗜酸乳杆菌体、脱S-层蛋白的菌体、代谢产物、S-层蛋白、牛血清白蛋白、Bestatin加入已长成单层的96孔培养板中,置37℃、5% CO2中培养90 min后洗涤,加入维持液继续培养。按时观察CPE情况,当病毒对照组CPE出现+++和++++时,用MTT法测定其OD570值,通过细胞存活率计算,选择各组成分最大无毒剂量。
1.2.4嗜酸乳杆菌不同成分对TGEV在ST上增殖的影响
将各浓度菌体稀释液、脱S-层蛋白菌体稀释液、菌代谢上清稀释液、S-层蛋白稀释液、牛血清白蛋白稀释液、Bestatin稀释液。牛血清白蛋白与S-层蛋白等浓度处理。按照下面3种处理方式接入细胞。设置病毒对照组和细胞对照组。
试验分3种处理如下:①各成分预先处理细胞后在攻毒(处理后感染组):将每个试验组成分以0.1 mL量分别孵育细胞90 min,洗涤,以100 TCID50·0.1 mL的病毒量接入细胞,置37℃、5% CO2培养90 min,洗涤,加维持液继续培养。②病毒感染细胞后接入各成分(感染后处理组):以100 TCID50·0.1 mL的病毒量接入细胞,置37℃、5% CO2温箱,孵育90 min后洗涤,再加入每个试验组成分0.1 mL继续孵育90 min后洗涤,加入维持液继续培养。③试验组成分与病毒等体积作用后接入细胞(同时处理感染组):将各个试验组0.1 mL分别与等体积的100 TCID5·00.1 mL的病毒孵育90 min后共同接入细胞,孵育细胞90 min后洗涤,加入维持液,置于37℃、5% CO2环境中培养。
以上试验均设置病毒对照组与正常细胞对照组,每种指标均设置3孔重复。当3种处理方式的病毒对照组出现CPE达到+++和++++时,用MTT方法检测各组细胞活力。
1.2.5 Bestatin与S-层蛋白对TGEV感染ST细胞抑制作用的比较
1.2.5.1不同浓度S-层蛋白与Bestatin对TGEV感染ST细胞的抑制比较
将对ST细胞最大无毒剂量的S-层蛋白和Bestatin同时进行2倍稀释。取不同浓度的两种成分接入到长满单层的ST细胞中,置37℃、5% CO2温箱,孵育90 min,弃去成分,洗涤细胞2~3次,感染100 TCID5·00.1mL TGEV,置37℃、5% CO2温箱,90 min后,弃去成分,加入细胞维持液。设立病毒对照组和正常细胞对照组。每日观察细胞,待病毒对照组出现明显病变时,进行MTT检测。
1.2.5.2 Bestatin和S-层蛋白联合对TGEV在ST细胞上增殖的抑制
将最大无毒剂量的Bestatin接入长满单层的ST细胞上,置于细胞培养箱内孵育90 min后,弃Bestatin,洗涤细胞。加入0.8 mg·mL-1的S-层蛋白,置于37℃、5% CO2温箱90 min后,弃S-层蛋白,洗涤细胞。感染100 TCID50·0.1mL TGEV,置于细胞培养箱内90 min后,弃病毒液,加入细胞维持液。设置病毒对照组和正常细胞对照组。每日观察细胞病变情况,待病毒对照组出现明显CPE时,采用MTT法检测。1.2.6 MTT测定方法
参照方蓉等方法[7],病毒抑制率(%)=[(各成分处理组平均OD值-病毒对照组平均OD值)/(细胞对照组平均OD值-病毒对照组平均OD值)]× 100%。
1.2.7统计学处理
数据采用SPSS 20.0统计软件处理。采用Dun⁃can法进行多重比较。试验数据用平均值±标准差表示,组间标有不同大写字母者表示差异极显著(P<0.01);标有不同小写字母者表示差异显著(P<0.05);标有相同小写字母者表示差异不显著(P>0.05)。
2 结果与分析
2.1 TGEV繁殖滴度测定结果
采用Reed-Muench法计算TGEV TO163毒株的
TCID50·0.1 mL为10-5.92。
2.2嗜酸乳杆菌S-层蛋白鉴定结果
由图1、2可知,经SDS-PAGE蛋白电泳检测蛋白大小为45 ku。与S-层蛋白大小一致。PCR扩增检测显示目的条带大小为1 200 bp。与S-层蛋白基因大小一致。初步鉴定所提取蛋白样本为S-层蛋白。
2.3嗜酸乳杆菌的最大无毒剂量结果
将各种不同稀释度的成分与细胞孵育后,通过观察细胞CPE变化程度和MTT检测计算出细胞活力。嗜酸乳杆菌和脱S-层蛋白的嗜酸乳杆菌最大无毒剂量为1011cfu·mL-1。代谢产物最大无毒剂量益生菌108cfu·mL-1浓度下代谢产物1ϑ2的稀释液,S-蛋白最大无毒剂量益生菌108cfu·mL-1浓度下1ϑ16的稀释液。牛血清白蛋白在S-层蛋白最大无毒剂量下对细胞无毒性。Bestatin的最大无毒剂量为4 mg·mL-1。
2.4嗜酸乳杆菌不同成分对TGEV在ST中增殖的影响
2.4.1嗜酸乳杆菌不同作用方式对TGEV抑制率的对比
由表1可以看出,嗜酸乳杆菌对病毒抑制率随浓度升高而增强,108cfu·mL-1浓度时抑制率最高,再增加菌体浓度则抑制率随之降低;在3种不同处理试验中,感染后处理组对病毒的抑制率明显低于其他两组,同时感染处理组病毒抑制率显著强于处理后感染组。

图1 S-层蛋白SDS-PAGE电泳检测Fig. 1 SDS-PAGE of S-layer protein
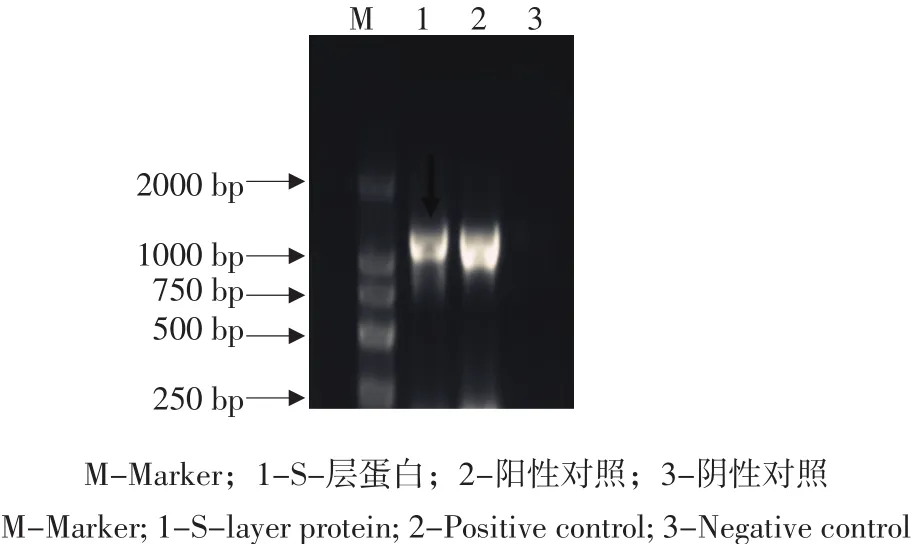
图2 S-层蛋白基因PCR检测Fig. 2 PCR test of S-layer protein's gene

表1 嗜酸乳杆菌不同加入顺序对TGEV抑制率对比(X±SD)Table 1 Comparison of different concentrations of LAC on the inhibitory rate of TGEV(X±SD)
2.4.2脱S-层蛋白嗜酸乳杆菌不同作用方式对TGEV抑制率的对比
由表2可见,脱S-层蛋白菌体对病毒依然具有抑制性,感染后处理组对病毒抑制率极显著低于其他两组,同时感染处理组与处理后感染组对病毒的抑制率相当。最强抑制病毒的菌体浓度是108cfu·mL-1,抑制性随其浓度变化产生相应变化。
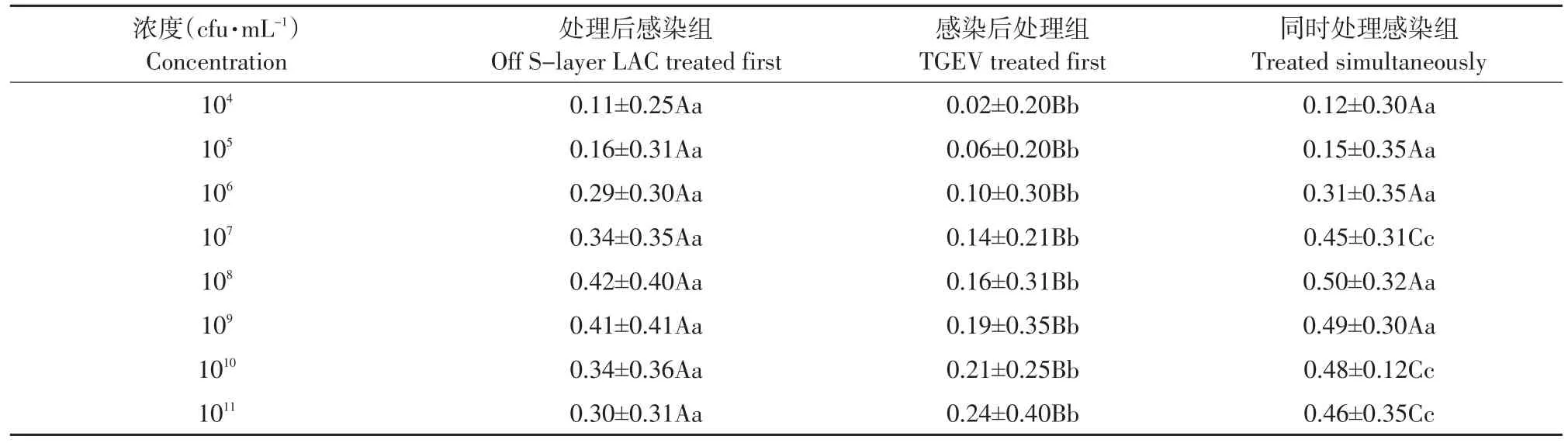
表2 不同浓度脱S-层蛋白菌体不同接入顺序对TGEV抑制率对比(X±SD)Table 2 Comparison of different concentrations of off S-layer LAC on the inhibitory rate of TGEV(X±SD)
2.4.3嗜酸乳杆菌S-层蛋白不同作用方式对TGEV抑制率的对比
由表3可知,随S-层蛋白浓度增加,对病毒抑制率随之加强。S-层蛋白浓度为0.8 mg·mL-1,抑制作用最强。
其中在每组浓度数据中,同时感染处理组的抑制率最大,显著高于处理后感染组,极显著高于感染后处理组。
2.4.4牛血清白蛋白不同作用方式对TGEV抑制率的对比
由表4可知,牛血清白蛋白对病毒有一定的抑制作用,抑制率随蛋白浓度变化而变化,牛血清白蛋白浓度越高,抑制率越高。但抑制率明显低于嗜酸乳杆菌各成分。在3种处理组中,同时感染处理组和处理后感染组对病毒的抑制率相近,略高于感染后处理组。
2.4.5嗜酸乳杆菌代谢产物不同作用方式对TGEV抑制率的对比
如表5所示,2、4倍稀释液,抑制率明显,同时感染处理组对病毒抑制率显著强于处理后感染组,极显著强于感染后处理组;8倍和16倍稀释液抑制作用不强,但同时感染处理组抑制率明显高于其他处理。32、64倍稀释液,3组抑制率均较低,作用强度无显著差异。
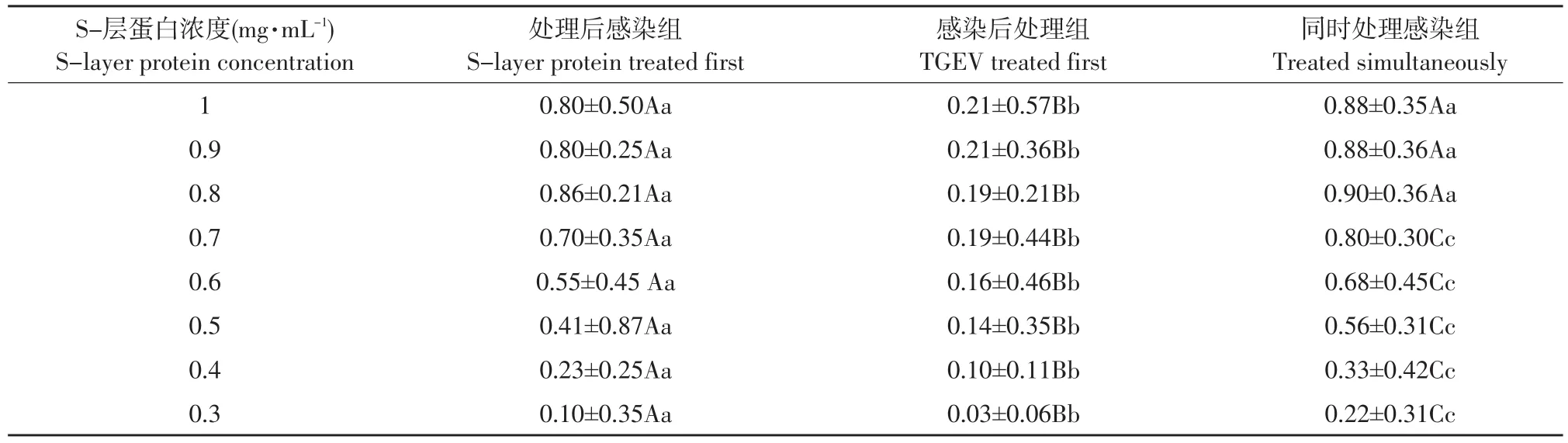
表3 不同浓度S-层蛋白不同接入顺序对TGEV抑制率对比(X±SD) Table 3 Comparison of different concentrations of S-layer protein on the inhibitory rate of TGEV(X±SD)

表4 不同浓度BSA不同接入顺序对TGEV抑制率对比(X±SD)Table 4 Comparison of different concentrations of BSA on the inhibitory rate of TGEV(X±SD)

表5 不同浓度代谢产物不同接入顺序对TGEV抑制率对比(X±SD)Table 5 Comparison of different dilution of metabolites on the inhibitory rate of TGEV(X±SD)
2.4.6不同浓度Bestatin和S-层蛋白对TGEV在ST细胞上增殖的抑制比较
由表6可知,Bestatin不同浓度对TGEV在ST细胞上的增殖均起到试验明显抑制作用。其抑制作用与Bestatin浓度呈明显的计量相关性。浓度越大抑制作用越强。S-层蛋白稀释度也是从细胞的最大无毒剂量开始。但S-层蛋白不是在最大无毒剂量时对病毒抑制作用最强,而是在最大无毒剂量的2倍稀释液的浓度最大,也就是0.8 mg·mL-1。S-层蛋白对病毒的抑制率与其浓度没有计量相关效应。但S-层蛋白对病毒的抑制率与Bestatin相近。
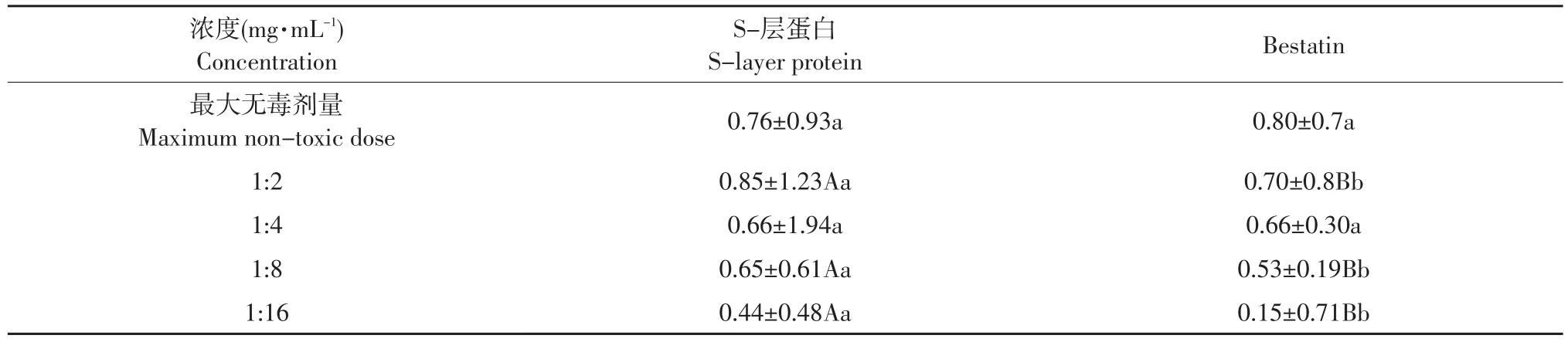
表6 不同浓度Bestatin和S-层蛋白对TGEV在ST细胞上增殖的抑制比较(X±SD)Table 6 Comparison of different dilution of Bestatin and S-layer protein on the inhibitory rate of TGEV(X±SD)
2.4.7 S-层蛋白与Bestatin联合作用对TGEV在ST细胞上增殖的影响
0.8 mg·mL-1的S-层蛋白对TGEV的抑制率为86%,Bestatin最大无毒剂量对TGEV的抑制率为80%,而当Bestatin先预处理ST细胞后加入S-层蛋白孵育细胞后,再感染TGEV,对病毒的抑制率为91.3%。
3 讨论
3.1不同方式处理嗜酸乳杆菌S-层蛋白对抑制TGEV感染ST细胞存在差异
采用3种不同添加方式研究S-层蛋白对病毒的作用,结果显示S-层蛋白预先孵育细胞再感染病毒的预先处理组抑制率最高。与Martínez等研究嗜酸乳杆菌的S-层蛋白对JUNV的抑制中结果一致[4]。本试验结果表明S-层蛋白对ST细胞的保护作用发生在TGEV病毒感染ST细胞之前。感染TGEV病毒后,S-层蛋白对ST细胞的保护作用较小。而S-层蛋白直接与病毒处理后再感染细胞,发现并没有很强的抑制效果,也可以说明S-层蛋白对病毒并没有直接作用。Sergey等在研究嗜酸乳杆菌NCFM的S-层蛋白对未成熟的树突状细胞和T细胞的调节中,试验数据也表明预先将S-层蛋白与病毒处理后,观察病毒结构,研究发现S-层蛋白并不能破坏病毒粒子结构[8]。
嗜酸乳杆菌菌体、脱S-层蛋白嗜酸乳杆菌菌体和嗜酸乳杆菌代谢产物,也发现预先处理组对TGEV病毒的抑制率明显高于处理后感染组和同时感染处理组的抑制率,说明当病毒感染细胞时益生菌成分无法起到明显抑制病毒增殖作用。Botic[2]、王占峰[9]和高长春[10]等用不同益生菌菌体抑制不同病毒在不同细胞上的繁殖研究中,均能证实先感染病毒再添加益生菌组对抑制病毒感染作用不强。菌体最高的病毒抑制率出现在混合感染组和处理后感染组中,菌体感染后处理组的病毒抑制率明显高于S-层蛋白组、脱S-层蛋白菌体组和代谢产物组,说明菌体的综合抗病毒能力强于各自成分,并对已感染病毒的ST有一定保护作用。
3.2 S-层蛋白与牛血清白蛋白在抑制TGEV感染ST细胞能力和方式的差别
S-层蛋白和牛血清白蛋白均能抑制TGEV感染ST细胞,并且同时感染处理组抑制率高于其他组,说明蛋白本身可能与病毒粘附,从而减弱试验病毒感染细胞的能力。嗜酸乳杆菌S-层蛋白分子质量为45 ku,牛血清白蛋白分子质量66.43 ku,牛血清白蛋白的高分子质量要高于S-层蛋白的分子质量。如果S-层蛋白仅仅只是非特异性地粘附在病毒表面,则其对病毒抑制作用应该比牛血清白蛋白小,但是S-层蛋白的抗病毒能力明显强于牛血清白蛋白。试验数据显示牛血清白蛋白对TGEV在ST细胞上的抑制作用与其浓度呈明显的剂量效应关系。浓度越高抑制作用越强。而本试验嗜酸乳杆菌菌株的S-层蛋白对TGEV在ST细胞上的抑制作用与其浓度间并不成剂量效应关系。由此推断S-层蛋白和TGEV病毒之间的作用不同于牛血清白蛋白与TGEV病毒之间的作用,S-层蛋白对TGEV在ST细胞上的抑制作用不仅是蛋白凭借物理作用与细胞表面的吸附,而是有独特方式。Martínez在研究嗜酸乳杆菌抗病毒作用中,发现嗜酸乳杆菌可能存在一种凭借高等电点产生的静电吸引阻碍病毒与易感细胞上的受体结合的机制[4]。而本试验中嗜酸乳杆菌等电点为9.35,而牛血清白蛋白等电点为4.7。S-层蛋白高等电点明显高于牛血清白蛋白。分析两种蛋白在抗TGEV感染ST细胞上能力存在的差异,可能是因为S-层蛋白的高等电点,可以产生静电力,吸引ST细胞上TGEV的病毒受体,从而干扰TGEV与ST上病毒受体的结合,以此达到抑制TGEV在ST上增殖的作用。S-层蛋白对TGEV的最高抑制率出现在0.8 mg·mL-1而非1.0 mg·mL-1,S-层蛋白对TGEV病毒的抑制作用不完全符合剂量-效应梯度变化规律。S-层蛋白具备在高浓度下可以自行恢复成晶格状稳定结构的性质[5]。所以当S-层蛋白浓度处于最大无毒剂量浓度时,可能是因为S-层蛋白处于高浓度下,S-层蛋白单体自行聚集,恢复成晶体状稳定结构,导致S-层蛋白对TGEV在ST细胞繁殖的抑制作用较低。可知,S-层蛋白只有在单体形式下才具有较强的抗病毒能力。S-层蛋白单体与其自身单体的结合能力强于与细胞上病毒受体的结合能力。
3.3 S-层蛋白可能通过封闭TGEV细胞受体氨肽酶发挥抗病毒作用
Delmas等已经证实TGEV受体为氨肽酶[11]。Bestatin是从橄榄网状链霉菌(Stretomyces olivorectic⁃uli)培养液中分离出来的化学物质,有抑制氨肽酶活性功效,是目前唯一上市的APN抑制剂[12]。本试验选取试验氨肽酶抑制剂Bestatin,研究其对TGEV感染ST细胞的影响。结果表明,Bestatin对TGEV具有较强的抑制作用。Bestatin对病毒的抑制呈明显的剂量-效应关系,随剂量增加对病毒抑制率增强。其抑制作用与S-层蛋白对TGEV感染ST的抑制作用一致。当Bestatin与S-层蛋白共同作用时,同样可提高对细胞的保护作用,降低病毒对细胞的感染。Sergey研究试验嗜酸乳杆菌NCFM的S-层蛋白,研究发现此菌可以依靠S-层蛋白的高等电点产生的静电吸引DC-SIGN。DC-SIGN是一种能参于表达与树突状细胞(DC)兼有模式识别受体和细胞黏附功能的C型凝集素。证明试验DC-SIGN配体为嗜酸乳杆菌NCFM的S-层蛋白[8]。树突细胞与嗜酸乳杆菌作用,实际上是DC-SIGN 和S-层蛋白作用调节试验细胞免疫。本研究选用的嗜酸乳杆菌S-层蛋白很有可能借助其高等点产生的静电引力与TGEV受体氨肽酶结合,阻碍试验TGEV与ST细胞上受体氨肽酶的结合,通过竞争病毒受体氨肽酶的方式抑制TGEV病毒对细胞的感染。
3.4 Bestatin和嗜酸乳杆菌S-层蛋白联合对细胞保护的增强作用
Eeuri等在研究氨肽酶密度对PEDV感染的作用中已经证实ST细胞可以表达氨肽酶[13]。所以,本试验选择ST细胞作为细胞平台,研究氨肽酶抑制剂对TGEV的抑制作用。氨肽酶也是冠状病毒家族中PEDV的病毒受体。Eeuri等研究表明ST细胞不能感染PEDV的原因是ST细胞氨肽酶密度较小。提高ST细胞氨肽酶密度,PEDV可大量感染ST细胞[13]。TGEV在ST细胞上增殖,不仅病变时间早,而且毒价高。所以ST细胞是TGEV繁毒的常用细胞。TGEV的病毒受体为氨肽酶,而ST细胞上的氨肽酶含量又很少,可以分析出TGEV感染ST细胞与氨肽酶密度大小无关。本试验氨肽酶活力抑制剂Bestatin加入抑制试验TGEV在ST细胞上的繁殖,TGEV感染ST细胞的程度更依赖于氨肽酶活性,而不是氨肽酶密度。
Bestatin不是完全抑制氨肽酶活性而是部分抑制。所以试验在Bestatin预处理细胞的基础上添加嗜酸乳杆菌的S-层蛋白作用于细胞后感染TGEV病毒。发现Bestatin与S-层蛋白的联合作用对病毒抑制率显著高于二者单独对病毒的抑制。S-层蛋白有高效的基因表达系统并且蛋白合成、分泌能力极强[5]。通过ST细胞平台评价S-层蛋白对TGEV的抑制作用,S-层蛋白在较低浓度下即可表现出较强的抗TGEV病毒能力且与Bestatin一起作用可以明显抑制TGEV对ST细胞的感染。可将S-层蛋白添加入Bestatin,二者联合,有望合成治疗TGEV病毒感染仔猪的新型药剂。嗜酸乳杆菌S-层蛋白在抗TGEV应用领域具有一定前景。
4 结论
本研究结果表明,该株嗜酸乳杆菌S-层蛋白可抑制TGEV在ST细胞上的增殖,与TGEV氨肽酶抑制剂Bestatin对TGEV在ST细胞上的增殖影响呈类似功效。氨肽酶抑制剂Bestain预处理ST细胞对S-层蛋白抑制TGEV感染具有协同作用。S-层蛋白研究为揭示益生菌抗病毒机制奠定理论基础。
[参考文献]
[1]Fuller R. Probiotics in man and animals[J]. J Appl Bacteriol, 1989, 66(5): 365-378.
[2]Botic T, Danø T, Klingberg, et al. A novel eukaryotic cell culture model to study antiviral activity of potential probiotic bacteria[J]. International Journal of Food Microbiology, 2007, 115: 227-234.
[3]Mastromarino P, Cacciotti F, Masci A, et al. Antiviral activity of Lactobacillus brevis towards herpes simplex virus type 2: Role of cell wall associated components[J]. Anaerobe, 2011, 17: 334-336.
[4]Martínez M G, Acosta M P, Nélida A, et al. S-layer proteins of Lactobacillus acidophilus inhibits JUNV infection[J]. Biochemical and Biophysical Research Communications, 2012, 422 (2012): 590-595.
[5]Karen E H, Le L G, Gerald W T, et al. Detection characterization and in vivo expression of genes encoding S-proteins in Lactobacil⁃lus gallinarum strains isolated from chicken crops[J]. Applied and Enviromental Microbiology, 2005, 71: 6633-6643.
[6]Vilgalys R. Ancient and recent patterns of geographic speciation in the oyster mushroom Pleurotus revealed by phylogenetics analy⁃sis of ribosomal DNA sequence[J]. Proc Natl Acad Sci USA, 1994, 91: 4599-4603.
[7]方蓉,李芳秋,武建国. MTT比色法的条件探讨[J].临床检验杂志, 2003, 21(1): 34-35.
[8]Sergey R. Konstantinov,S-layer protein of Lactobacillus acidophi⁃lus NCFM regulates immature dendritic cell and T cell functions [J]. PNAS, 2008, 49: 19474-19479.
[9]王占锋.鸡胚肠组织细胞培养及益生菌抗NDV作用研究[D].哈尔滨:东北农业大学, 2010.
[10]高长春.猪肠道抗TGEV益生菌株筛选及其体外抗病毒作用[D].哈尔滨:东北农业大学, 2012.
[11]Delmas B, Gelfi J, L'Haridon R, et al. Aminopeptidase N is a ma⁃jor receptor for the entero-pathogenic coronavirus TGEV[J]. Na⁃ture, 1992, 357(6377): 417-420.
[12]Umezawa H, Aoyagi T, Suda H, et al. Bestatin, an inhibitor of ami⁃nopeptidase B, produced by actinomycetes[J]. J Antibiot (Tokyo), 1976, 29(1): 97-99.
[13]Eeuri N, Lee C. Contribution of the porcine aminopeptidase N (CD13) receptor density to porcine epidemic diarrhea virus infec⁃tion[J]. Vet Microbiol, 2010, 144(1-2): 41-50.
Wei Ping, Liu Guanqun, Jia Guodong, et al. Study of antivirus actions at different LAC component in TGEV infecting ST cell [J]. Journal of Northeast Agricultural University, 2015, 46(3): 59-66. (in Chinese with English abstract)
Study of antivirus actions at different LAC component in TGEV infect⁃
ing ST ce
ll/WEI Ping, LIU Guanqun, JIA Guodong, ZHAO Yibo, XIA Lu(School of Veteinary Medi-cines, Northeast Agricultural University, Harbin 150030, China)
Abstract:The study was used different LAC component in TGEV infecting ST cell in order to explore the antivirsl activity of probiotics and possible mechanism thereof. Lactobacillus acidophilus was isolated different components and Bestatin. Experiment was divided into three groups: preventing group, treating group and mixed infectious group. With MTT of ST, virus inhibition rate were determined to evaluate the impact of different LAC component on TGEV. S-layer protein were added based on Bestatin closing ST cells, in order to study on the combined effect. The experimental results showed that the S-layer protein inhibited virus strongest, followed probiotics, later off S protein probiotics, metabolites, BSA lowest. S-layer protein inhibition of S-layer protein almost was equal with Bestatin. The experimental concluded that anti-virus capability of S-layer protein was descripted. The combined effects of Bestatin and S-layer strengthened the inhibition rate of TGEV infected ST cells invitro.
Key words:Lactobacillusacidophilus; S-layer protein; antivirus
作者简介:魏萍(1961-),男,教授,博士,博士生导师,研究方向为兽医传染病学与流行病学。E-mail: weiiping@163.com
基金项目:黑龙江省教育厅重点项目(12521z001);哈尔滨市科技局项目(2014RFXGJ096)
收稿日期:2014-02-11
文章编号:1005-9369(2015)03-0059-08
文献标志码:A
中图分类号:S855.3;S858.28
