地塞米松诱导小鼠脾淋巴细胞凋亡实验研究*
2015-11-09龚惠红
伊 萍,龚惠红,明 莹,胡 鑫**
(1.中南民族大学药学院,湖北武汉430074;2.湖北科技学院生物医学工程学院;3.咸宁市温泉红旗路中学)
糖皮质激素可影响小鼠脾淋巴细胞承受凋亡的能力,当机体处于应激状态时能调节能量反应,具有很强的抗炎、抗变态反应作用,在临床上主要用于抗生素治疗无效的炎症、较强变态反应以及抗内毒素性休克等疾病,还用于治疗恶性淋巴瘤以及许多免疫系统疾病的常见药物。但其在长期使用中会产生某些副作用,主要表现为抑制免疫系统功能、减轻免疫反应,其主要机制可能是引起免疫细胞凋亡[1~5]。迄今为止,已经有相当多关于细胞凋亡及其相关研究的报道,其检测方法也较多,如何建立一种快速、可靠、准确的诱导细胞凋亡模型是目前许多相关研究需要解决的问题。我们主要探讨通过地塞米松建立一种体外诱导淋巴细胞凋亡模型[6],然后用流式细胞术、DNA梯度法以及蛋白质免疫印迹等实验室常规技术手段鉴定和检测细胞是否发生凋亡及其凋亡后生物化学变化特征,为以后研究细胞凋亡及淋巴细胞免疫抑制机制等提供实验基础和理论依据。
1 材料与方法
1.1 实验动物 6~8周龄昆明种小白鼠20只,体质量16~20g,由湖北省实验动物研究中心提供,每次实验取4只小鼠,重复实验5次。
1.2 主要试剂 地塞米松磷酸钠(湖北襄樊恒生药业有限公司产品);Annexin V-FITC/PI细胞凋亡检测试剂盒(碧云天有限公司);DNA提取试剂盒(天根有限公司);RMPI1640细胞培养基(Hy-Clone);小牛血清(HyClone);蛋白裂解液(自配);PBS(自配)。
1.3 主要仪器 CO2细胞培养箱(3111型,Thermo);倒置显微镜(上海美谱达仪器有限公司);细胞培养瓶(NEST);流式细胞仪(Gallios型,贝克曼库尔特);电泳仪(北京东方仪器厂);蛋白质印迹设备(DYY-6C,北京市六一仪器厂)。
1.4 脾淋巴细胞的制备和培养 取4只6~8周的昆明种小鼠,在无菌环境中取出小鼠的脾脏,用玻璃膜片将脾脏研磨成细胞悬液,用纱布过滤后,加入红细胞裂解液裂解数分钟,离心之后用PBS洗涤3次,然后用含有10%胎牛血清的RMPI1640培养液将细胞稀释成6×106/ml,以便后面使用。
1.5 脾淋巴细胞在地塞米松诱导下的最适浓度向NEST塑料瓶中加入浓度6×106的细胞,分别设置空白对照正常组和地塞米松作用组,地塞米松的浓度依次为 10-8,10-6,10-4,10-2mol/L,用10%胎牛血清的RMPI 1640培养液补至适当体积。同时取小鼠的脾淋巴细胞做为新鲜对照组。把装好小鼠脾淋巴细胞的培养瓶放在5%CO2培养箱中,37℃培养17h。
1.6 流式细胞仪检测细胞凋亡 分别收集上述6组细胞,要设置两组单阳组的对照,按照Annexin V-FITC/PI细胞凋亡检测试剂盒的说明书进行操作,检测细胞的凋亡率。
1.7 DNA凝胶电泳法检测淋巴细胞凋亡 分别收集上述6组细胞,按DNA提取试剂盒操作说明提取 DNA,进行 DNA电泳,观察凋亡细胞DNA ladder。
1.8 用蛋白质印迹检测小鼠脾淋巴细胞中凋亡基因Bax和抗凋亡基因Bcl-2的凋亡 先提取6组细胞中的蛋白质,然后通过电泳、转膜、封闭、孵育抗体、显影5个步骤完成Bax和Bcl-2蛋白质表达。
2 结果
2.1 流式细胞仪检测结果 如图1所示,新鲜分离小鼠脾淋巴细胞几乎未发生凋亡;正常组脾淋巴细胞可发生自然凋亡[凋亡率为(31.4±0.4)%];不同浓度地塞米松处理后脾淋巴细胞出现不同程度凋亡,其中浓度为 10-2mol/L、10-4mol/L地塞米松处理组诱导凋亡较高,其淋巴细胞凋亡率分别为(65.7±0.8)%(P<0.05)、(76.6±1.2)%(P <0.01);浓度为 10-6mol/L、10-8mol/L处理组随浓度降低诱导凋亡逐渐减弱,与正常组接近(P>0.05)。
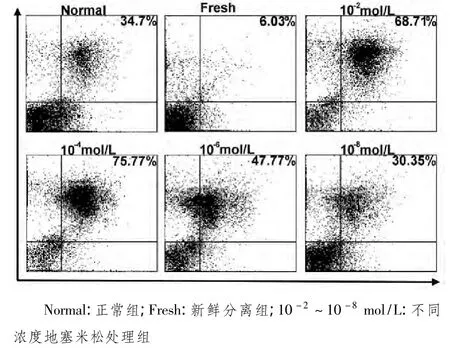
图1 流式细胞术检测不同浓度地塞米松诱导小鼠脾脏淋巴细胞凋亡
2.2 DNA凝胶电泳法检测淋巴细胞凋亡 如图2所示,10-2mol/L地塞米松浓度组淋巴细胞出现的凋亡程度最明显,其余各地塞米松浓度组10-4、10-6mol/L凋亡程度依次下降,地塞米松浓度10-8mol/L组凋亡程度较小,呈浓度依赖性,而新鲜分离淋巴细胞几乎未见凋亡。
2.3 蛋白质免疫印迹检测小鼠脾淋巴细胞中凋亡基因Bax和抗凋亡基因Bcl-2 为进一步探讨地塞米松诱导小鼠脾淋巴细胞凋亡分子机制,我们用蛋白质免疫印迹法检测凋亡相关蛋白表达,以β-actin为内参。如图3所示,地塞米松浓度为10-2mol/L时,凋亡蛋白 Bax表达最高,浓度10-4、10-6、10-8mol/L 地塞米松处理组 Bax 表达水平几乎依次递减,新鲜分离淋巴细胞组未见Bax表达。而从抗凋亡蛋白Bcl-2表达情况来看,地塞米松浓度为10-2mol/L处理组淋巴细胞几乎未见表达,浓度 10-4、10-6、10-8mol/L 地塞米松处理组和新鲜分离组Bcl-2表达逐渐升高。上述结果提示,浓度为10-2mol/L组淋巴细胞经地塞米松处理后发生凋亡的原因可能至少部分与其诱导凋亡蛋白Bax表达升高、抗凋亡蛋白Bcl-2表达下降甚至不表达紧密相关,而其他浓度处理组凋亡相关蛋白表达水平变化同其细胞凋亡递减趋势一致。
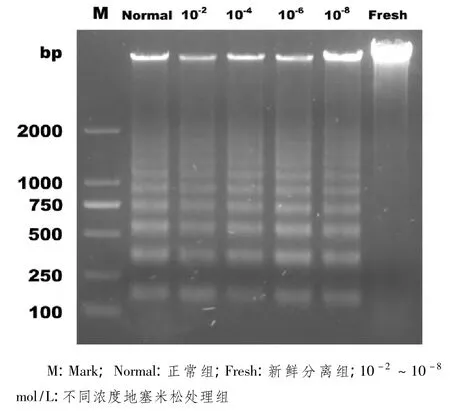
图2 DNA凝胶电泳检测不同浓度地塞米松诱导小鼠脾脏淋巴细胞凋亡
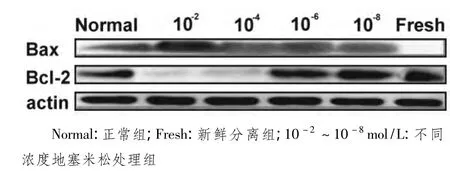
图3 Western blotting检测不同浓度地塞米松诱导小鼠脾脏淋巴细胞凋亡相关基因表达
3 讨论
细胞最终结局主要包含两种可能:一是细胞凋亡,另一个是细胞坏死。从生理学意义上讲,细胞坏死是一种机体内非正常现象,在缺氧、补体攻击、代谢中毒等一系列物理或化学损害因子的作用下,导致细胞的死亡,属于“他杀”行为。而细胞凋亡则不同,它是细胞为维持机体内环境稳定而进行的一种程序性死亡,属于“自杀”行为[7],类似秋季树叶自然凋落,而凋亡细胞不会影响机体正常运转,也几乎不会产生任何炎症反应,因为凋亡细胞会被巨噬细胞或者其他免疫细胞清除掉。细胞凋亡具有重大生物学理论和实际意义,多种相关基因如抗凋亡和(或)抑制凋亡基因严格控制其发生发展,多种疾病的发生与细胞凋亡有着密切联系。尽管目前细胞凋亡过程在生命科学研究中已有了较大突破,但迄今为止,细胞凋亡的机制尚未完全阐明。
本文从凋亡细胞形态特征等角度证明地塞米松能够诱导小鼠脾脏淋巴细胞凋亡,用流式细胞术和蛋白质免疫印迹等方法进行了定性和定量分析,并且提取凋亡细胞DNA进行梯度分析加以鉴定是否发生凋亡,该方法被认为是检测细胞凋亡的金标准。本研究还从凋亡蛋白水平表达变化角度证实地塞米松诱导脾淋巴细胞凋亡机制可能是通过诱导凋亡蛋白Bax表达提高和抑制抗凋亡蛋白Bcl-2的表达[8]。综上所述,本实验采用流式细胞术、DNA ladder以及蛋白质印迹法筛选地塞米松诱导小鼠脾淋巴细胞凋亡的最适浓度,结果证实地塞米松浓度为10-2mol/L能够达到诱导小鼠脾脏淋巴细胞最佳效果,为建立准确、可靠的细胞凋亡模型及淋巴细胞凋亡相关免疫抑制的研究提供实验依据。
[1]郑俊年,谢叔良.细胞凋亡检测方法的研究进展[J].国外医学临床生物化学与检验学分册,1999,20(3):124
[2]Gorman AM,Hirt UA,Oriunies S.et al.Dexamethasone pre-treatment interferes with apoptotic death in glioma cells[J].Neuroscoence,2000,96:417
[3]彭赛亮,徐燕萍.两种检测方法对地塞米松诱导小鼠淋巴细胞凋亡的观察[J].江西医学院学报,2007,47(3):23
[4]张呵,张书模.淋巴细胞发育与凋亡[J].国外医学输血及血液学分册,1998,21(2):73
[5]刘金保,王随照,赵青.氨茶碱及地塞米松对小鼠淋巴细胞凋亡的调节作用[J].中国病理生理杂志,1999,15(7):609
[6]夏洪生,张玲梅.地塞米松诱导脾淋巴细胞凋亡模型的制备[J].深圳中西医结合杂志,2004,14(5):270
[7]杨连君,曹雪涛.bcl-2,bax 与肿瘤细胞的凋亡[J].中国肿瘤生物治疗杂志,2003,10(3):232
[8]吕盈盈,袁孟彪.bcl-2和bax蛋白在肝癌组织的表达与细胞凋亡指数的关系[J].山东大学学报,2002,8(40):310
