卵巢透明细胞癌的CT影像特征
2015-11-08董越于韬罗娅红
董越,于韬,罗娅红
辽宁省肿瘤医院医学影像科,辽宁 沈阳 110042
卵巢透明细胞癌是一类相对少见的卵巢上皮类肿瘤。透明细胞癌最初被认为来源于中肾管,但ScIllly和Barlow发现透明细胞癌伴有子宫内膜异位及内膜样腺癌,提示来源于苗勒管[1]。1973年,世界卫生组织(World Health Organization,WHO)将卵巢透明细胞癌归为上皮性卵巢癌的组织学类型之一,其发生率占上皮性卵巢恶性肿瘤的8.0%~10.0%[2]。随着报道例数的增加,该病逐渐被临床医师认识。虽然很多卵巢透明细胞癌可在早期发现,但各期总生存率较其他上皮性卵巢癌差。主要原因是其对化疗药物反应不敏感。文献报道卵巢透明细胞癌对以铂类为基础的联合化疗的反应率仅为11.1%~16.0%[3],对紫杉醇(paclitaxel,PTX)+铂类的反应率为30.0%[4]。因此,术前正确诊断和分期对卵巢透明细胞癌的治疗非常重要,而其影像学表现与卵巢其他囊腺癌等疾病相类似,易误诊[5-7]。本研究收集辽宁省肿瘤医院手术病理证实的11例卵巢透明细胞癌的CT和MRI资料,以提高对该病影像学表现的认识。
1 资料和方法
1.1 一般资料
回顾性分析2008年1月—2015年1月于本院经手术病理证实的卵巢透明细胞癌11例。年龄37~66岁,平均52.3岁。肿瘤标记检查,5例血液血清CA l25升高,癌胚抗原(carcinoembryonic antigen,CEA)、CA 199均在正常值范围内。所有患者均以腹痛、腹部包块就诊;临床查体肿块表现为边界较清楚、活动度可,7例质地中等、4例质硬;6例有压痛。患者均行子宫全切除术并双附件、大网膜及阑尾切除术,获得最终病理学结果,根据大体病理和镜下观察结果。最终确定国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期。
1.2 影像学检查方法
所有病例均进行CT扫描,采用64排螺旋CT扫描仪(GE公司Sensation 64),全腹或盆腔扫描。扫描参数:管电压120 kV,管电流200~230 mA,扫描准直器3 mm,螺距自动匹配,矩阵512×512,图像重建层厚3 mm。8例行双期增强扫描,经肘静脉由高压注射器注射非离子型对比剂80 mL (优维显300 mgI/mL),速率3~3.5 mL/s,注射造影剂后30、75 s分别行动脉期和静脉期扫描。
1.3 观察指标
由2名腹部放射诊断工作经验丰富的医师共同协商评定肿瘤的影像学表现,一般特征包括位置、大小、边缘、病灶内部特征、囊实性、囊性部分CT值、实性部分CT值和强化程度及腹腔积液、腹膜转移和淋巴结转移情况。
2 结果
FIGO分期:Ⅰ期7例、Ⅱ期1例、Ⅲ期3例;4例同时合并子宫内膜异位症。10例为单侧发生(左侧5例、右侧5例),双侧1例。9例表现为囊实混合型肿块,单囊4例、多囊5例;2例为实性型肿块。肿块最长径10.5~22.5 cm,平均16.1 cm。囊实混合型肿块平扫边界清晰;单囊或多囊,肿块内均可见不规则乳头状结节或团块样实性成分,实性成分为10%~80%;多囊型肿块还可见厚薄不一的分隔,厚度<5 mm;囊性部分CT值11~55 HU,中位值18 HU,其中3例可见高密度出血和(或)液-液分层(图1、2);实性部分CT值34~49 HU,中位值40 HU;增强各期实性部分轻中度延迟强化,动脉期CT值46~57 HU,静脉期CT值56~66 HU(图2)。2例为实性肿块,未进行增强扫描,平扫呈饼状,实性部分CT值分别为39、46 HU(图3)。5例伴腹腔积液,3例可见腹膜不规则絮状或结节状增厚(图1、2),未见淋巴结肿大。

图1 盆腔不规则囊实混合型肿块CT表现

图2 右侧附件区囊实混合型肿块CT表现
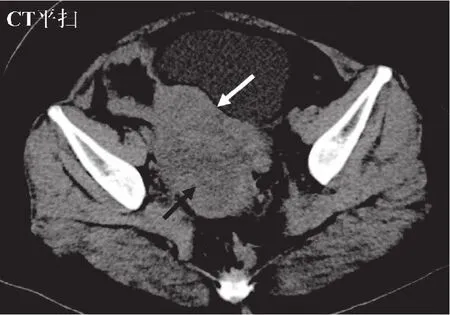
图3 CT平扫示右侧附件区实性肿块影像学表现
3 讨 论
3.1 临床特征
卵巢癌不是一种单纯疾病,而是一组临床和病理特点迥异的一大类肿瘤,可起源于卵巢上皮组织、性索间质组织和生殖细胞。其中约90%为上皮细胞来源,根据组织学、免疫组化和分子遗传学分析,至少有5种主要类型:高级别浆液性癌(70%)、内膜样癌(10%)、透明细胞癌(10%)、黏液性癌(3%)和低级别浆液性癌(不足5%)。其中透明细胞癌是一种相对少见的卵巢恶性上皮来源肿瘤,由于其发病年龄相对低、对化疗不敏感、预后差而逐渐被临床重视[8]。
卵巢透明细胞癌发病年龄跨度广泛,文献报道为28~79岁。本研究中患者年龄37~66岁,平均52.3岁,与以往研究结果相仿[6-7]。卵巢透明细胞癌倾向于早期发现,本研究中FIGOⅠ期7例,Ⅱ期1例,Ⅰ/Ⅱ期占所有分期比例为72.7%,高于文献报道的59%~65%[9-11]。卵巢透明细胞癌的临床表现多无特征性,腹痛为最常见症状,本组患者均有腹痛表现;其次是体重减轻,确诊前症状平均持续时间长[6-7]。卵巢透明细胞癌与子宫内膜异位症关系密切[12-14],本组病例中有4例(33.6%)病理证实存在子宫内膜异位症,略低于陶慧芳报道的41%[12]。患者临床症状可表现为周期性痛经,本组2例患者在最初就诊时也曾初步诊断为子宫腺肌症。
3.2 影像学表现
文献报道卵巢透明细胞癌在就诊时盆腔肿块较大,本研究中10例肿瘤最长径>10 cm,5例>17 cm,最大达22.5 cm,与文献报道相仿[6-12]。既往文献报道卵巢透明细胞癌多为单侧发病,偶有双侧发生[11],本组中仅1例为双侧,发生率为9.1%。通常将卵巢透明细胞癌分为囊实混合型和实性型,其中以囊实混合型多见。本组9例(81.8%)为囊实混合型,2例为实性型,与文献报道相仿[6-7,11]。在囊实混合型中,多囊型略多于单囊型,与文献报道以单囊型为主略有不同[6-7]。但无论单囊型还是多囊型,囊性部分的CT值相对较高,多为10~30 HU,在合并出血时可增高至50 HU以上,CT呈现相对高密度,增强后无强化;且可合并液-液平面。这种密度或信号改变,对透明细胞癌的诊断具有重要意义,因为透明细胞癌易合并子宫内膜异位,而出血正是提示子宫内膜异位的存在,这在其他卵巢恶性肿瘤中是非常罕见的。所有病例均未见钙化,与文献报道相仿[6-7]。囊实混合型肿块的实性部分比例不同,但均在10%以上,个别病灶可达70%以上;实性部分可表现为乳头状突起或块状结构,增强后有延迟强化。多囊型病灶可有分隔,也存在强化。
3.3 鉴别诊断
卵巢癌的常见类型包括浆液性囊腺癌、黏液性囊腺癌、内膜样癌和透明细胞癌等,这些肿瘤均可表现为盆腔巨大肿块。此外,子宫肌瘤和盆腔间质瘤也常表现为巨大囊实性或实性肿块。肿块较大时确定起源困难,因此在卵巢恶性肿瘤的诊断和鉴别诊断中需全面考虑、仔细观察。
(1)浆液性囊腺癌:是卵巢最常见恶性肿瘤,好发于40~70岁,约半数患者为双侧性,大多为多房囊实混合型肿物,但囊内间隔细、少,分房之间密度相似,囊壁薄而光整,可见乳头状突起并伴有钙化;实行部分轻度强化[15]。
(2)黏液性囊腺癌:好发于30~65岁,一般较大,单侧多见,为多房囊肿样,子囊多、且大小不等,子囊间密度差异可接近,也可很大,可近似水样密度,也可呈高密度,CT值多在20 HU左右,略高于水的密度,囊壁和分隔厚薄不均,可见钙化;大囊内可见子囊是粘液性囊腺瘤的特征性表现[15]。
(3)阔韧带巨大子宫肌瘤:中年女性多见,多为巨大的实性肿块,较少发生囊变,即使发生囊变也无乳头状突起结构,增强后呈明显延迟并向心性强化。
(4)盆腔巨大间质瘤:可起源于盆腔肠管或系膜,表现为巨大囊实混合型肿块,可见其与肠管关系密切、增强显著不均匀强化、缺少乳头状突起的结构。
虽然透明细胞癌容易早期发现,但其对以铂类为主的传统化疗不敏感,因此预后差,5年累积生存率最高为92%。透明细胞癌一旦诊断明确,手术切除是首选治疗方式。目前影像医师对透明细胞癌的影像学表现尚缺乏认识,因此在术前常易误诊为其他囊性癌;但影像学方法对术前分期、肿瘤侵犯范围及程度的确定等甚有帮助。
卵巢透明细胞癌在临床和影像学上均有一定的特征性,好发于中老年女性,典型表现为巨大囊实混合病灶,囊性部分可由于出血而密度增高或呈现液-液分层改变,实性部分可表现为乳头状或团块状,实性部分所占比例不一,基本在10%以上,多者肿块可基本以实性为主,实性部分延迟强化。CT可很好地显示病变及其细节,有助于术前正确诊断。
[1]马绍康, 张宏图, 昊令英, 等.88例卵巢透明细胞癌临床及预后分析 [J].中华肿瘤杂志, 2007, 29(10): 784-788.
[2]TAKANO M, KIKUCHI Y, YAEGASHI N,et al.Clear cell carcinoma of the ovary: a retrospective multicentre experience of 254 patients with complete surgical staging[J].Br J Cancer, 2006, 94(10): 1369-1374.
[3]SUGIYAMA T, KAMURA T, KIGAWA J, et al.Clinical characteristics of clear cell carcinoma of the ovary: a distinct histologic type with poor prognosis and resistance to platinum-based chemotherapy [J].Cancer,2000, 88(11): 2584-2589.
[4]BEHBAKHT K, RANDALL TC, BENJAMIN I, et al.Clinical characteristics of clear cell carcinoma of the ovary[J].Gynecol Oncol, 1998, 70(2): 255-258.
[5]王雁, 孔为民.卵巢透明细胞癌70例临床分析 [J].实用妇产科杂志, 2008, 24(2): 101-103.
[6]张家云,江魁明.卵巢透明细胞癌的CT表现[J].中国医学影像技术, 2010, 26(10): 1943-1945.
[7]陈文新, 孙骏,吴晶涛,等.卵巢透明细胞癌的CT特征(附10例报道)[J].医学影像学杂志, 2013, 23(11):1749-1751.
[8]UEKURI C, SHIGETOMI H, ONO S, et al.Toward an understanding of the pathophysiology of clear cell carcinoma of the ovary (Review)[J].Oncol Lett, 2013,6(5): 1163-1173.
[9]KENNEDY A W, BISCOTTI C V, HART W R, et al.Ovarian clear cell adenocarcinoma [J].Gynecol Oncol,1989, 32(3): 342-349.
[10]JENISON E L, MONTAG A G, GRIFFITHS C T, et al.Clear cell adenocarcinoma of the ovary: a clinical analysis and comparison with serous carcinoma[J].Gynecol Oncol, 1989, 32(1): 65-71.
[11]YOONESSI M, WELDON D, SATCHIDAND S K, et al.Clear cell ovarian adenocarcinoma [J].J Surg Oncol,1984, 27(4): 289-297.
[12]陶敏芳.卵巢恶性肿瘤与子宫内膜异位症关系分析 [J].同济大学学报(医学版), 2008, 29(4): 77-79.
[13]热娜,季菲,艾星子,等.卵巢子宫内膜异位症与卵巢恶性肿瘤的相关性分析[J].中国妇产科临床杂志,2011, 12(5): 331-334.
[14]CHOI H J, LEE J H, SEOK LEE J, et a1.CT findings of clear cell carcinoma of the ovary [J].J Comput Assist Tomogr, 2006, 30(6): 875-879.
[15]程遥, 吴鸿, 张印, 等.卵巢囊性肿瘤的多层螺旋CT分析 [J].医学影像学杂志, 2012, 22(3): 448-451.
