18F-FES小动物PET/CT评价不同乳腺癌模型雌激素受体表达的差异
2015-04-17何思敏罗健民张建平章英剑
何思敏,罗健民,张建平,章英剑
1.复旦大学附属肿瘤医院核医学科,复旦大学上海医学院肿瘤学系,上海 200032;2.上海市质子重离子医院核医学科,上海 201321;3.复旦大学生物医学影像研究中心,上海 200032;4.上海分子影像探针工程技术研究中心(筹),上海 200032
18F-FES小动物PET/CT评价不同乳腺癌模型雌激素受体表达的差异
何思敏1,2,3,4,罗健民1,2,3,4,张建平1,2,3,4,章英剑1,2,3,4
1.复旦大学附属肿瘤医院核医学科,复旦大学上海医学院肿瘤学系,上海 200032;2.上海市质子重离子医院核医学科,上海 201321;3.复旦大学生物医学影像研究中心,上海 200032;4.上海分子影像探针工程技术研究中心(筹),上海 200032
目的:用16α-18F-17β-雌二醇(18F-FES)小动物PET/CT评价不同类型乳腺癌模型雌激素受体(ER)表达的差异。方法:用ER阳性人乳腺癌细胞(ZR-75-1、MCF-7)和阴性细胞(MDA-MB-231)构建荷瘤裸鼠动物模型。阳性组每组各10只,接种前3 d植入雌激素缓释片,再将细胞与基质胶混合液接种于乳腺脂肪垫,成瘤后显像前3 d取出缓释片。阴性组5只,直接将细胞悬液接种于乳腺脂肪垫。当肿瘤长至长径5 mm左右时行18F-FES PET/CT显像,用%ID/gmax定量ER表达,然后用免疫组化测定并比较ER结果。数据分析采用单因素方差分析。结果:ZR-75-1、MCF-7和MDA-MB-231的瘤体成瘤率分别为100%(10/10)、70%(7/10)和100%(5/5),瘤体随时间延长而增大,但三组之间差异无统计学意义(P>0.05),18F-FES %ID/gmax分别为6.6±1.0、3.3±0.5和1.1±0.1,三组之间差异均有统计学意义(P<0.05)。T/M比值分别为4.2±0.3、2.6±0.2和1.1±0.1,三组之间差异均有显著统计学意义(P<0.001)。18F-FES显像结果与免疫组化结果呈正相关(%ID/gmax:r2=0.65,P<0.001;T/M:r2=0.87,P<0.001)。结论:18F-FES PET/CT的%ID/gmax能准确评价不同类型荷人乳腺癌模型的ER表达水平,从而为进一步研究乳腺癌内分泌疗效提供了一种活体、无创、动态的分析方法。
乳腺癌模型;雌激素受体;18F-FES;PET/CT ;MCF-7;ZR-75-1 ;MDA-MB-231
75%乳腺癌为雌激素受体(estrogen receptor,ER)阳性[1],需通过免疫组化离体检测ER表达水平,从而制订治疗方案和评估预后。但肿瘤异质性及耐药等因素导致疗效不理想[2],因此探讨耐药机制、筛选有效的耐药逆转方法和设计个体化治疗方案已成为临床治疗乳腺癌的热点问题,而对这些问题的研究均有赖于准确检测ER的方法和建立合适的实验动物模型。本研究旨在探讨16α-18F-17β-雌二醇(18F-fluoroestradiol,18F-FES)PET/CT评价不同类型乳腺癌模型中ER表达水平的可行性,为ER阳性乳腺癌患者设计治疗方案和疗效监测提供可靠方法。
1 资料和方法
1.1 细胞和动物
ER阳性人乳腺癌细胞(ZR-75-1、MCF-7)和阴性细胞(MDA-MB-231)均购自中国科学院上海生命科学研究院细胞资源中心。6周龄BALB/c雌性裸鼠25只,体重20~25 g,购于复旦大学上海医学院实验动物部,用于ZR-75-1、MCF-7 (各10只)及MDA-MB-231 (5只)研究,显像前在实验中心饲养。
1.2 试剂和仪器
DMEM培养基购自HyClone公司,内含10%胎牛血清、青霉素100 IU/mL、链霉素100 μg/mL;RPMI 1640培养基购自Gibco公司,内含10%胎牛血清、青霉素100 IU/mL、链霉素100 μg/mL;0.72 mg/片雌二醇90 d缓释片购自Innovative Research of America公司;基质胶购自美国BD公司。18F-FES的合成和所需仪器详见参考文献[3]。
1.3 细胞培养及动物模型的建立
细胞培养主要参考美国标准生物品收藏中心(American Type Culture Collection,ATCC)提供的方法。ZR-75-1细胞用RPMI 1640培养基,MCF-7和MDA-MB-231细胞用DMEM培养基,在37 ℃、5% CO2细胞培养箱中常规培养,每3~4 d于细胞对数生长期时按1∶3传代培养。阳性组:接种前3 d在裸鼠颈部皮下埋植雌二醇缓释片,然后将处于对数生长期的ZR-75-1和MCF-7细胞经胰酶消化,以无血清RPMI 1640培养液洗涤,调整活细胞密度为5×106个细胞(约0.1 mL),取0.1 mL细胞悬液与基质胶按2∶1 混匀后,分别接种于裸鼠右侧第二乳房垫内。阴性组:调整活细胞密度为1×106个细胞(约0.1 mL),取0.1 mL细胞悬液直接接种于相同部位。肿瘤长至5 mm,于显像前3 d取出雌二醇缓释片。有创伤的操作均在无菌麻醉下进行。小鼠饲养于标准动物房。接种后,每3 d用游标卡尺测量肿瘤长径(a)和短径(b)。肿瘤体积(tumor volume,TV)的计算公式为:TV=a×(b2)/2[5],计算每组裸鼠移植瘤体积平均值和标准方差,绘制肿瘤生长曲线。
1.4 荷瘤裸鼠小动物PET/CT显像
所有荷瘤鼠均尾静脉注射18F-FES 7.4 MBq,1 h 后在异氟烷麻醉状态下行小动物PET/CT显像,三维模式采集20 min静态图像。OSEM3D/ MAP法重建,获得衰减校正后的PET/CT融合图像,在肿瘤部位和对侧肌肉勾画感兴趣区(region of interest,ROI),测量ROI放射性占注入量的百分比(%ID/g),并计算肿瘤与对侧肌肉组织比值(ratio of tumor to muscle,T/M)。
1.5 病理检测
荷瘤裸鼠肿瘤组织经10%甲醛溶液固定,石蜡包埋,常规脱水、透明、浸蜡、石蜡包埋,切片厚5 μm,行苏木精-伊红(hematoxylin-eosin,HE)染色;二甲苯脱蜡,梯度乙醇至水化后高压锅热处理5~8 min;过氧化物酶阻断血清封闭,加一抗孵育,4 ℃过夜,接着加二抗及过氧化物酶标记的链霉菌抗生物素蛋白。其余步骤按SP试剂盒操作步骤进行,二氨基联苯胺(3,3'-diaminobenzidine,DAB)显色,苏木精复染。免疫组化染色用磷酸盐缓冲液(phosphate buffered saline,PBS)代替一抗为阴性对照,以试剂商提供的阳性片为阳性对照。对ER的判断标准采用Allred score方法,根据染色阳性细胞的比例和染色强度,阳性细胞比例<1%为(-);1%≤阳性细胞比例<10%为(+);10%≤阳性细胞比例<50%为(++);阳性细胞比例≥50%为(+++)。染色强度分为弱、中、强。若染色强度弱,则阳性级别下降1级。
1.6 统计学处理
2 结 果
2.1 肿瘤生长情况
接种后第7天,接种部位长出结节,周边泛红,质地较硬,随着时间推移肿块逐渐增大。肿瘤生长曲线见图1。相比而言,ZR-75-1组的肿瘤平均体积略大于MCF-7荷瘤鼠,但差异无统计学意义(P>0.05)。ZR-75-1、MCF-7和MDA-MB-231的成瘤率分别是100% (10/10)、70% (7/10)和100% (5/5)。
2.2 荷瘤裸鼠PET/CT显像
荷瘤裸鼠的PET/CT显像见图2。ZR-75-1、MCF-7、MDA-MB-231组18F-FES %ID/gmax分别为6.6±1.0、3.3±0.5和1.1±0.1,ZR-75-1与MCF-7 (P<0.05)和MDA-MB-231 (P<0.00 1)比较差异有统计学意义,MCF-7与MDA-MB-231比较差异有统计学意义(P<0.05)。T/M比值分别为4.2±0.3、2.6±0.2和1.1±0.1,ZR-75-1与MCF-7和MDAMB-231比较差异有统计学意义(P<0.00 1),MCF-7与MDA-MB-231比较差异有统计学意义(P<0.00 1)。
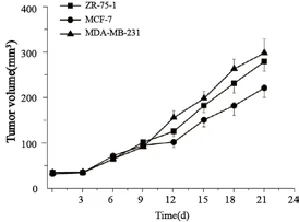
图1 乳腺癌荷瘤裸鼠肿瘤生长曲线
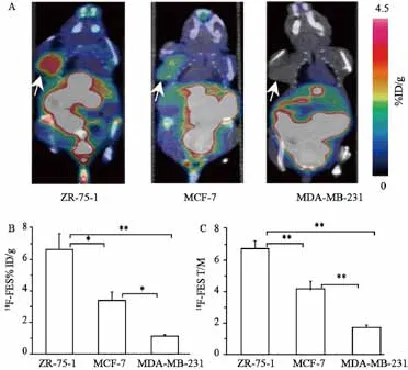
图2 荷瘤鼠18F-FES PET/CT显像
2.3 病理检测
ZR-75-1和MCF-7肿瘤组织经免疫组化证实为ER阳性表达,MDA-MB-231为ER阴性表达(图3),与PET/CT显像结果一致。两者呈正相关(%ID/gmax:γ2=0.65,P<0.00;T/M:γ2=0.87,P<0.00 1)。
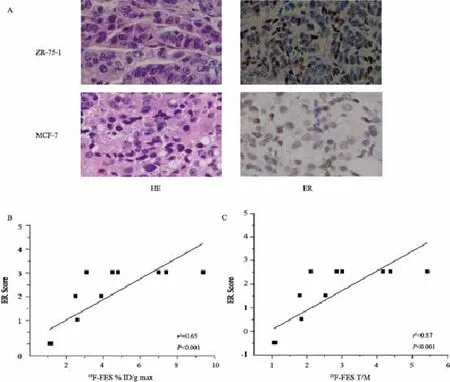
图3 肿瘤组织ER免疫组化与18F-FES相关性分析
3 讨 论
ER是乳腺癌分型和预后评估的重要指标[6]。目前,主要采用原发灶术后或活检标本经免疫组化检测,反映所取病灶部位ER的免疫活性。但由于肿瘤异质性,还不能完全代表全身其他病灶ER的表达状态。雌激素衍生物最早于1984年由Kiesewetter等[7]用18F标记成功。在过去20余年内,不断有新的衍生物合成,但迄今为止,18F-FES仍被认为是最佳的正电子药物[8],能与ER特异性结合,反映原发灶和转移灶中有功能的ER(即ER的生物学活性);同时,可对受体水平进行半定量分析[9]。18F-FES用于诊断人乳腺癌病灶ER状态已有研究,ER阳性诊断灵敏度为93.33%,特异度为100%[10],但能否识别不同类型ER阳性人乳腺癌尚不清楚。ZR-75-1和MCF-7均来源于人乳腺癌细胞株,肿瘤形态与亲代肿瘤一致,具有乳腺癌细胞的超微结构特征和人类染色体核型,表达ER,且对甾体类激素敏感,广泛用于临床前研究[11]。Aliaga等[12]建立ER阳性(MCF-7和T-47D)和ER阴性(MDA-MB-231)人乳腺癌模型,18F-FES %ID/g分别为0.26、0.25和0.24,提示ER阳性乳腺癌模型与ER阴性模型的18F-FES摄取无差异,可能与ER阳性模型未能保持其生物学特性有关。本课题组以前进行MCF-7荷瘤鼠18F-FES显像,其肿瘤组织最大标准摄取值(maximal standardized uptake value,SUVmax)为0.18~0.30,仅略高于阴性模型MDA-MB-231的0.13~0.16[13]。因此,本研究探讨18F-FES识别不同类型ER阳性乳腺癌的可行性,为内分泌疗效监测和设计治疗方案提供了准确方法。
本研究中,为建立保持ER阳性生物学特性的荷瘤裸鼠,应注意以下几点。①接种部位:原位接种有利于保持肿瘤的生物学特性。Paget分析了735例乳腺癌尸检病例后,认为某些肿瘤细胞(种子)对某些器官(土壤)的微环境具有特殊的生长倾向,从而提出了“种子与土壤学说”,也得到其他实验数据支持[14]。相反,异位移植虽能维持原有肿瘤的组织结构和生理、生化特性,但由于微环境不同,少见或未见转移。而且,异位移植肿瘤达到一定大小后,瘤体血供差,内部较易出现坏死,不利于后续治疗和影像学研究。沈国栋等[15]对裸鼠肋部皮下、腋窝及乳房垫3个接种部位进行比较,发现乳腺癌细胞接种于乳房垫内效果最好,具有成瘤早、生长快且形状均匀等优点,这可能与乳房垫具有天然囊状结构及微血管丰富等特点有关。另外,乳腺脂肪垫移植能更好地模拟人类乳腺的组织学、血液供应和对治疗的反应。本研究采用乳房垫内原位接种方式建立人乳腺癌裸鼠移植瘤模型,在第21天时肿瘤体积分别达(279±21) mm3、(221±21) mm3和(298±31) mm3。Aliaga等[12]建立MCF-7和T-47D乳腺癌裸鼠模型,细胞株接种后70 d,肿瘤体积仅150 mm3。Paquette等[16]采用MC7-L1和MC4-L2这两株鼠源性ER阳性细胞建立模型,21 d后肿瘤体积仅分别为(22.1±4.8) mm3和(23.9±6.8) mm3。甄林林等[17]用MCF-7细胞接种于裸鼠建立乳腺癌模型,第30~70天,肿瘤平均长径为(10±2) mm,当长径≥10 mm时,肿瘤侵犯皮肤,出现溃疡性坏死。与上述数据比较,本研究的建模方法能在短时间内获得恰当的肿瘤模型,满足临床前研究。②将癌细胞与基质胶混合后接种,可通过两种机制提高成瘤率和促进转移:一方面,形成一个屏障,使癌细胞免受巨噬细胞、自然杀伤细胞(natural killer,NK细胞)和淋巴因子激活的杀伤细胞(lymphokineactivated killer cell,LAK)前体细胞的作用;另一方面,基质胶提供一个自然的结构或立体空间,使瘤细胞接近一些黏附分子或促有丝分裂因子,如层粘连蛋白、纤连蛋白和Ⅳ型胶原纤维[18]。③激素水平:Eietreby等[19]认为,动物体内雌激素水平太低,不能支持肿瘤的生长,需要补充外源性雌激素促进肿瘤生长,否则即使在未切除卵巢的雌鼠内也无肿瘤生长。刘建中等[20]发现,MCF-7不加雌激素肿瘤移植成功率仅33.3%(10/30)。因此,建立ER阳性模型期间,裸鼠体内需补充一定量的雌激素。本研究采用Van Slooten等[4]的方法,在裸鼠颈部皮下埋植0.72 mg雌二醇90 d缓释片,发现接种后21 d,荷瘤鼠肿瘤体积达200 mm3以上,因此选择30 d的缓释剂更经济。
本研究构建了ZR-75-1和MCF-7两种ER阳性原位乳腺癌模型,另建立MDA-MB-231阴性模型为对照。由18F-FES PET/CT显像可见,ER阳性肿瘤均明显摄取,阴性不摄取。18F-FES % ID/gmax分别为6.6±1.0、3.3±0.5和1.1±0.1。T/M比值分别为4.2±0.3、2.6±0.2和1.1±0.1。免疫组化结果显示,ZR-75-1和MCF-7肿瘤组织ER阳性表达,MDA-MB-231为ER阴性表达。为进一步验证18F-FES检测不同乳腺癌模型ER表达的能力,对PET/CT显像结果和免疫组化结果进行相关性分析,两者呈正相关(%ID/gmax:r2=0.65,P<0.001;T/M:r2=0.87,P<0.001)。
综上所述,本研究建立的ER阳性人乳腺癌原位动物模型方法,能保持ER高表达的特点,成瘤率高,周期短。18F-FES可准确评价不同类型荷人乳腺癌模型的ER表达水平,能为进一步监测内分泌疗效及设计治疗方案提供准确方法。
[1] BlAMEY R W, HORNMARK-STENSTAM B, BALL G, et al. ONCOPOOL-a European database for 16,944 cases of breast cancer [J]. Eur J Cancer, 2010, 46(1): 56-71.
[2] GHAYAD S E, BIECHE I, VENDRELL J A, et al. mTOR inhibition reverses acquired endocrine therapy resistance of breast cancer cells at the cell proliferation and gene-expression levels [J]. Cancer Sci, 2008, 99(10): 1992-2003.
[3] 张勇平, 章英剑, 王明伟, 等. 基于Explora GN/LC双模块的16α-[18F]氟-17β-雌二醇全自动化合成 [J].中华核医学杂志, 2011, 31(3): 196-200.
[4] VAN SLOOTEN H J, BONSING B A, HILLER A J,et al. Outgrowth of BT-474 human breast cancer cells in immune- deficient mice: a new in vivo model for hormone- dependent breast cancer [J]. Br J Cancer, 1995,72(1):22-30.
[5] YONEYA T, TSUNENARI T, TANIGUCHI K, et al. Effects of CH4893237, a new orally active estrogen receptor downregulator, on breast cancer xenograft models with low serum estrogen levels [J]. Oncol Rep,2009, 21(3): 747-755.
[6] C H E N G J Y, L E I L, X U J Y, e t a l.18F-Fluoromisonidazole PET/CT: a potential tool for predicting primary endocrine therapy resistance in breast cancer [J]. J Nucl Med, 2013, 54(3): 333-340.
[7] KIESEWETTER D O, KILBOURN M R,LANDVATTER S W, et al. Preparation of four fluorine-18-labeled estrogens and their selective uptakes in target tissues of immature rats [J]. J Nucl Med, 1984, 25(11): 1212-1221.
[8] SUNDARARAJAN L, LINDEN H M, LINK J M, et al.18F-Fluoroestradiol [J]. Semin Nucl Med, 2007, 37(6): 470-476.
[9] 何思敏, 曹天野, 章英剑. 分子影像探针18F-FES的研究进展 [J]. 肿瘤影像学, 2014, 23(3): 259-264.
[10] 孙艺斐, 杨忠毅, 章英剑, 等.18F-FES在乳腺癌患者体内摄取与病理免疫组化的关系 [J]. 中国癌症杂志,2014, 24(2): 128-134.
[11] ENGEL L W, YOUNG N A, TRALKA T S, et al. Establishment and characterization of three new continuous cell lines derived from human breast carcinomas [J]. Cancer Res, 1978, 38 (10): 3352-3364.
[12] ALIAGA A, ROUSSEAU J A, OUELLETTE R, et al. Breast cancer models to study the expression of estrogen receptors with small animal PET imaging [J]. Nucl Med Biol, 2004, 31(6): 761-770.
[13] 杨忠毅, 王明伟, 章英剑, 等.18F-FES在正常大鼠及荷乳腺癌裸鼠体内的生物分布和显像 [J]. 上海医学影像,2011, 20(3): 234- 238.
[14] WU M, JUNG L, COOPER A B, et al. Dissecting genetic requirements of human breast tumorigenesis in a tissue transgenic model of human breast cancer in mice [J]. Proc Natl Acad Sci USA, 2009, 106(17) : 7022-7027.
[15] 沈国栋, 赵婷, 张安莉, 等. ErbB2 高表达的人乳腺癌原位移植瘤裸鼠模型的建立 [J]. 中国药理学通报, 2010,26(10): 1391-1394.
[16] PAQUETTE M, OUELLETR, ARCHAMBAULT M,et al. [18F]-fluoroestradiol quantitative PET imaging to differentiate ER+and ERα-knockdown breast tumors in mice [J]. Nucl Med Biol, 2012, 39(1): 57-64.
[17] 甄林林, 武正炎, 范萍, 等. 人乳腺癌裸鼠移植模型的建立 [J]. 南京医科大学学报, 2000, 21(6):510-511.
[18] CLARKE R. Human breast cancer cell line xenografts as models of breast cancer. The immunobiologies of recipient mice and the characteristics of several tumorigenic cell lines [J]. Breast Cancer Res Treat, 1996, 39(1): 69-86.
[19] EIETREBY M F, LIANG Y. Effect of antiprogestins and tamoxifen on growth inhibition of MCF-7 human breast cancer cells in nude mice [J]. Breast Cancer Res Treat,1998, 49(2): 109-117.
[20] 刘建中, 谷俊朝, 俞巍. MCF-7细胞系乳腺癌裸鼠模型病理学特点及生物学性状的研究 [J]. 国际外科学杂志,2010, 37(3): 165-167.
Evaluation of estrogen receptor expression by18F- fl uoroestradiol PET/CT imaging in human breast cancer
model HE Simin1,2,3,4, LUO Jianmin1,2,3,4, ZHANG Jianping1,2,3,4, ZHANG Yingjian1,2,3,4(1.Department of Nuclear Medicine, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China; 2.Department of Nuclear Medicine, Shanghai Proton and Heavy Ion Center,Shanghai 201321, China; 3.Center for Biomedical Imaging, Fudan University, Shanghai 200032, China; 4.Shanghai Engineering Research Center for Molecular Imaging Probes, Shanghai 200032, China)
ZHANG Yingjian E-mail: yjzhang111@aliyun.com
Objective: To evaluate estrogen receptor (ER) expression level in human breast cancer model using18F-f l uoroestradiol (18F-FES) microPET/CT. Methods: ER+human breast cancer cell lines (ZR-75-1 and MCF-7) and ER-control(MDA-MB-231) were used to construct BALB/c nude mouse model. There were ten mice in each ER+group. The estrogen pellets were implanted 3 d prior to tumor cell inoculation and removed 3 d before administration of18F-FES. The mice were implanted with ZR-75-1 and MCF-7. There were 5 mice in ER-group. MDA-MB-231 cells were inoculated into thoracic mammary fat pad.18F-FES PET/CT was performed until the tumor length reached 5 mm. %ID/gmaxwas used to quantitate ER expression. ER expression was also detected by immunohistochemistry. Results: The tumor formation rates for ZR-75-1, MCF-7 and MDAMB-231 were 100% (10/10), 70% (7/10) and 100% (5/5), respectively. There was no statistical difference in the volume among three groups (P>0.05). %ID/gmaxvalues were 6.6±1.0, 3.3±0.5 and 1.1±0.1, respectively. Signif i cant differences were observed when ZR-75-1 was compared to MCF-7 (P<0.05) and MDA-MB-231 (P<0.001). There was signif i cant difference between MCF-7 and MDA-MB-231 (P<0.05). The ratios of tumor to muscle (T/M) were 4.2±0.3, 2.6±0.2 and 1.1±0.1, respectively. There were signif i cant differences among three groups (P<0.001). A signif i cantly positive correlation was found between the resultsof18F-FES imaging and immunohistochemistry (%ID/gmax: r2=0.65, P<0.001; T/M: r2=0.87, P<0.001). Conclusion: %ID/gmaxfrom18F-FES PET/CT imaging is able to evaluate ER expression reliably.18F-FES PET/CT can be used as a noninvasive and dynamic method in vivo.
Breast cancer model; Estrogen receptor;18F-f l uoroestradiol; PET/CT; MCF-7; ZR-75-1; MDA-MB-231
R445.6
A
1008-617X(2015)01-0035-06
2015-03-10
2015-03-21)
上海市科委项目(No:12431900208);上海分子影像探针工程技术研究中心项目(14DZ2251400)。
章英剑 E-mail:yjzhang111@aliyun.com
