循环逆流提取发芽糙米γ-氨基丁酸工艺条件优化
2015-11-07刘利霞惠丽娟何余堂
马 涛,刘利霞,赵 旭,王 勃,刘 贺,惠丽娟,何余堂
(1.渤海大学化学化工与食品安全学院,辽宁锦州121013;2.沈阳农业大学食品学院,辽宁沈阳110866;3.辽宁省粮食科学研究所,辽宁沈阳110866)
循环逆流提取发芽糙米γ-氨基丁酸工艺条件优化
马涛1,刘利霞2,赵旭3,王勃1,刘贺1,惠丽娟1,何余堂1
(1.渤海大学化学化工与食品安全学院,辽宁锦州121013;2.沈阳农业大学食品学院,辽宁沈阳110866;3.辽宁省粮食科学研究所,辽宁沈阳110866)
以水为提取溶剂,采用实验室模拟动态逆流提取工艺,并通过响应面实验设计方法对发芽糙米γ-氨基丁酸(GABA)的提取工艺条件进行优化。结果表明:提取温度51℃、单级提取时间59min、液料比5.9∶1(mL/g),提取级数3级,在此条件下,发芽糙米GABA提取率可达到89.35%。
发芽糙米,γ-氨基丁酸,逆流提取,条件优化
γ-氨基丁酸(GABA)是广泛分布于动植物中的一种非蛋白质氨基酸,糙米在发芽过程中谷氨酸在内源谷氨酸脱羧酶作用下会转化为GABA,其含量成倍增加[1]。GABA具有改善脑机能、调整血压、促进生长激素分泌,以及保护肝脏等功能[2]。同时,GABA作为一种天然的食品加工原料被广泛应用[3],因此,发芽糙米及其生理活性物GABA受到国内外广泛的关注。
连续循环逆流提取技术是一种集萃取、重渗透、动态、逆流为一体的新型提取技术[4]。动态逆流提取逐渐取代了传统的分批提取过程,其优势在于降低溶剂消耗、缩短处理时间、减少成本[5-7];与传统的提取方法相比,具有经济、安全等特点[8]。本实验采用实验室模拟工业生产中连续式逆流提取方法,以水为提取溶剂,并通过Box-Behnken响应面法对发芽糙米提取GABA工艺条件进行了优化,为实现GABA提取工业化提供参考。
1 材料与方法
1.1材料与仪器
糙米市购,经发芽[9]干燥、微粉碎后备用;γ-氨基丁酸(GABA)标品(纯度>99%) Sigma公司;次氯酸钠分析纯,有效氯为9%,天津市致远化学试剂有限公司;重蒸苯酚分析纯,天津市风船化学试剂科技有限公司;硼酸、无水乙醇分析纯,国药集团化学试剂有限公司;谷氨酸钠(味精)谷氨酸钠>99%,无盐,北京市朝阳区中联化工试剂厂。
HH-601A型超级恒温水浴锅江苏省金坛市医疗仪器厂;HPX-9082ME型电热恒温培养箱、DHG-9055A型电热鼓风干燥箱上海一恒科学仪器有限公司;RRH-A500型高速多功能粉碎机海缘沃工贸有限公司;UV-2550型紫外可见分光光度计日本岛津Shimadzu公司;SC-279GA型海尔冰柜海尔公司;AR224CN型电子天平上海奥豪斯仪器有限公司。
1.2实验方法
1.2.1循环逆流法提取发芽糙米GABA工艺
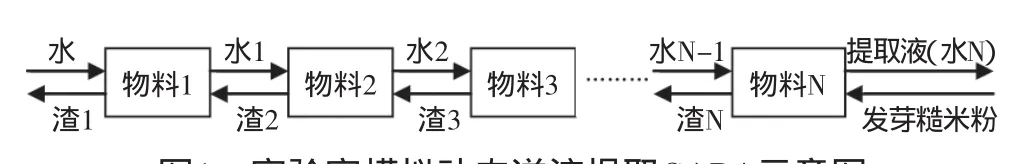
图1 实验室模拟动态逆流提取GABA示意图Fig.1 The schematic diagram of GABA extraction using laboratory simulation dynamic countercurrent method
由图1可见,逆流法提取发芽糙米GABA工艺流程是:新鲜溶剂水从第一级进入逆流体系,对第2级排出的渣2进行提取,提取后的渣1排出体系;去除沉淀后的水1进入第2级,对第3级排出的渣3进行提取;分离得到的水2进入第3级,对第4级的渣4进行提取;以此类推,最后水相N-1进入N级对原料进行提取,排出的渣N-1进入N-1级,而去除沉淀后的水相N即为所需的发芽糙米GABA提取液[10]。
1.2.2发芽糙米的制备精选颗粒饱满、成熟高的糙米原料,每份称取10g,并用20mL蒸馏水清洗3遍,然后用1%的次氯酸钠溶液浸泡5min(加入量以刚好淹没糙米为宜),消毒之后每份用20mL清水清洗3遍,然后用20mL蒸馏水清洗3遍,于30℃水浴锅中浸泡12h,30℃恒温培养箱中培养发芽28h,发芽结束后,用去离子水清洗,于55℃烘箱中终止活性、干燥5h,于4℃冰箱保存备用[9]。
1.2.3GABA检测方法
1.2.3.1GABA标准曲线的制作准确称取浓度为0.1、0.25、0.5、0.75、1.0mg/mL的γ-氨基丁酸标准溶液分别取0.5mL,加入0.2mL硼酸缓冲溶液(pH9.0),1mL浓度为6g/100mL的重蒸苯酚溶液,0.4mL有效氯含量10%的次氯酸钠溶液,充分振荡,置于沸水浴10min,再立即冰浴20min,并不断振荡,待出现蓝绿色后加入2mL体积分数60%的乙醇溶液,再次振荡均匀,静置后于645nm波长处测定其吸光度,以浓度为横坐标x,吸光度为纵坐标y,绘制标准曲线。
1.2.3.2样品GABA含量的检测将干燥后的发芽糙米粉碎过60目筛,称取10g发芽糙米粉,用水进行逆流提取,过滤后,取滤液,即GABA粗提液。取上清液0.5mL,加入0.2mL硼酸缓冲溶液(pH9.0),1mL浓度为6g/100mL的重蒸苯酚溶液,0.4mL有效氯含量10%的次氯酸钠溶液,充分振荡,置于沸水浴10min,再立即冰浴20min,并不断振荡,待出现蓝绿色后加入2mL体积分数60%的乙醇溶液,再次振荡均匀,静置后于645nm波长处测定其吸光度[11]。
1.2.3.3GABA提取率的计算方法
GABA提取率(%)=WE/WO×100
式中:WE为原料浸出的可溶性固形物量(g);WO为原料中可溶性固形物含量(g)。
1.2.4单因素实验以水为提取溶剂,准确称取10g/份发芽糙米粉,考察提取温度、提取时间、液料比以及提取级数四个因素对发芽糙米GABA提取率的影响,每次实验均重复3次。
以水为提取溶剂,设定液料比为6∶1,提取级数为3级,分别在20、30、40、50、60、70℃条件下逆流提取60min,以GABA提取率为响应值,重复3次。
以水为提取溶剂,设定液料比为6∶1,提取级数为3级,分别在50℃条件下逆流提取30、60、90、120、150min,以GABA提取率为响应值,重复3次。
以水为提取溶剂,按液料比为4∶1、5∶1、6∶1、7∶1、8∶1、10∶1mL/g,在50℃条件下逆流提取60min,提取级数为3级,以GABA提取率为响应值,重复3次。
以水为提取溶剂,设定液料比为6∶1,在50℃逆流提取60min,对发芽糙米GABA分别进行了5级提取,以GABA提取率为响应值,重复3次。
1.2.5响应面法优化逆流提取发芽糙米GABA工艺条件在单因素实验基础上,利用Design-Expert(version 8.0.6)软件以提取温度、提取时间、液料比及提取级数为考察变量,分别以A、B、C、D表示,以γ-氨基丁酸提取率Y为响应值,其中以+1、0、-1分别代表自变量的高、中、低水平[12],各因素及水平编码如表1所示。

表1 Box-Behnken实验因素及水平编码Table 1 Four main induction conditions and their levels for Box-Behnken design
1.2.6数据分析运用Design-Expert软件(Version 8.0.6)对响应面实验所得数据进行线性回归和方差分析,模型和因素的显著性以F值进行考察(p<0.05),每次实验均重复3次。
2 结果与讨论
2.1GABA标准曲线结果
根据1.2.3.1方法绘制GABA标准曲线如图2所示,得到的GABA标准曲线的回归方程为y=0.4154x+ 0.1020,R2=0.9987。
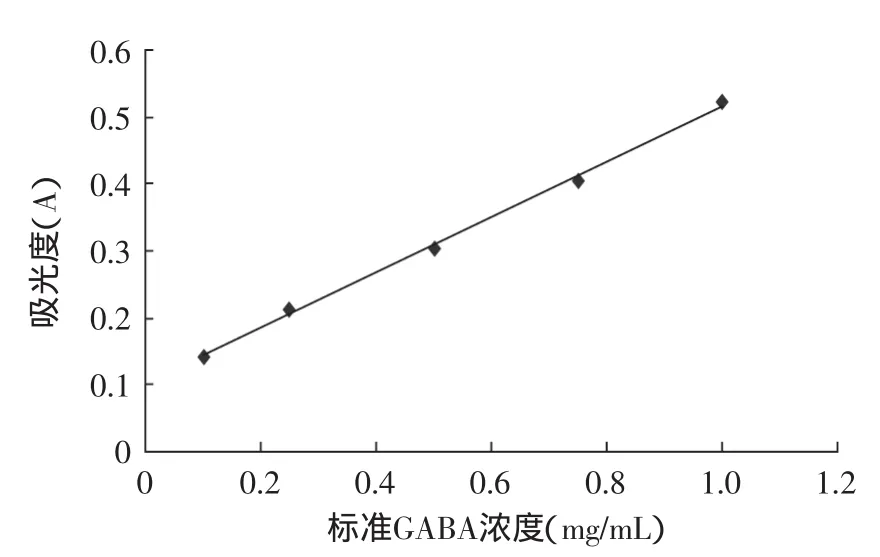
图2 γ-氨基丁酸的标准曲线Fig.2 Standard curve of γ-aminobutyric acid
2.2单因素实验结果
2.2.1提取温度对发芽糙米GABA提取率的影响由图3可知,随着提取温度的升高,发芽糙米GABA提取率呈现先上升后下降的趋势,温度升高,溶剂的传质动力增加,使得物质的提取率上升,在50℃时提取率达到最大;之后随着提取温度的增加,发芽糙米发生糊化现象,而且高温会破坏热敏性物质的结构,本实验取50℃为最佳提取温度。
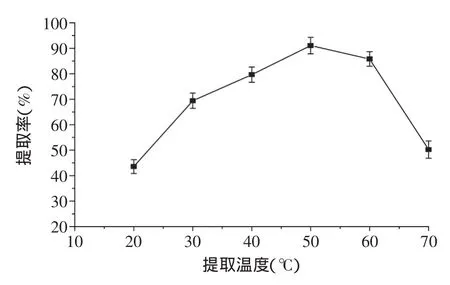
图3 提取温度对发芽糙米GABA提取率的影响Fig.3 Effect of extraction temperature on extraction rate of GABA
2.2.2提取时间对发芽糙米GABA提取率的影响由图4可知,发芽糙米GABA提取率随着提取时间的延长先增加后降低,在60min内提取率最大,原因是随着提取时间的增加,溶剂粘度下降,析出的物质含量降低。从操作费用和能源消耗上考虑,60min为发芽糙米GABA最佳提取时间。
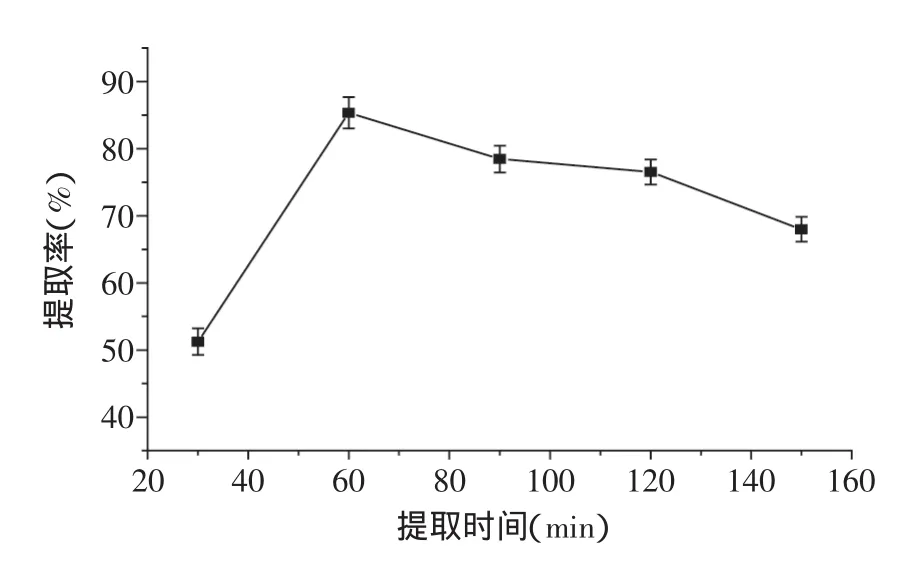
图4 提取时间对发芽糙米GABA提取率的影响Fig.4 Effect of extraction time on extraction rate of GABA
2.2.3液料比对发芽糙米GABA提取率的影响从图5可知,随着液料比的增加,GABA的提取量在不断的增高,这是因为增加液料比,传质动力增加,GABA就更容易溶出,损失减少[13],考虑经济效益,本实验选取最佳提取液料比为6∶1。
2.2.4提取级数对发芽糙米GABA提取率的影响由图6可知,GABA提取率在3级时达到最大值,之后提取率趋于平缓,原因是新物料的加入会大量的吸水,当达到一定级数时,提取液中GABA含量达到饱和,提取率下降,本实验发芽糙米逆流提取GABA最佳提取级数确定为3级。
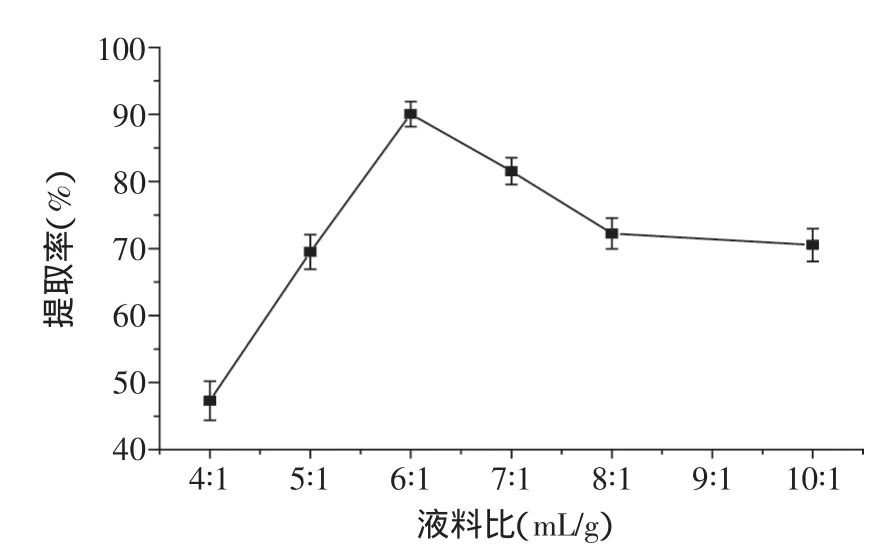
图5 液料比对发芽糙米GABA提取率的影响Fig.5 Effect of liquid/material ratio on extraction rate of GABA
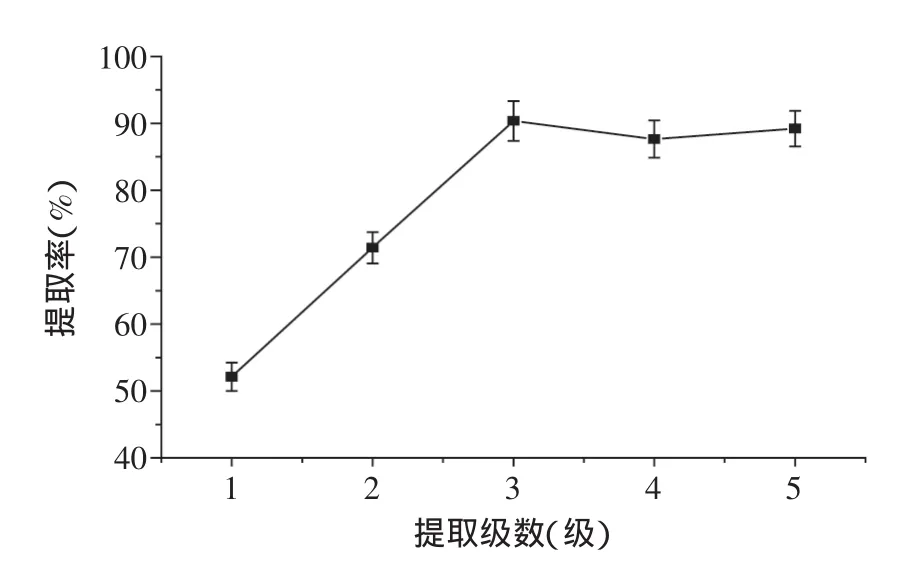
图6 提取级数对发芽糙米GABA提取率的影响Fig.6 Effect of extraction numbers on extraction rate of GABA
2.3响应面分析法优化发芽糙米GABA提取工艺结果分析
2.3.1实验因素水平编码与实验结果采用Design-Expert软件进行Box-Behnken中心组合实验设计,依次进行提取实验,以发芽糙米中GABA提取率为响应值(Y)进行响应面实验,实验设计及结果如表2所示。
2.3.2二次多项式回归模型建立及统计分析应用Design-Expert 8.0软件,对表2中的GABA提取率实验数据进行多元回归拟合分析,拟合后得到的关于提取温度(A)、单级提取时间(B)、液料比(C)及提取级数(D)二次多项回归方程为:
Y=88.24+3.44A+1.62B-2.47C-3.66D-2.57AB+ 3.69AC+2.28AD-5.16BC+7.12BD-1.51CD-9.13A2-11.21B2-8.35C2-5.40D2
方程中各项系数绝对值大小直接反映各因素对响应值的影响程度,系数的正、负反映影响的方向。由表3回归方程的显著性检验中可知,p值说明影响提取发芽糙米GABA的提取温度、单级提取时间、液料比及提取级数各因素存在显著性影响。因素提取温度、料液比、提取级数的影响极显著(p<0.01);交互项AB、AD影响显著(p<0.05),且交互项AC、BC、BD影响极显著(p<0.01)。综合上述分析得知,各个因素对响应值的影响程度为:D(提取级数)>A(提取温度)>C(液料比)>B(单级提取时间)。
对回归方程进行方差分析及显著性检验的结果见表4。由表4可知,该回归整体模型显著(Pr>F值<0.0001),失拟项不显著(Pr>F值=0.1064>0.05),说明模型与实际拟合较好,能反应各因素对发芽糙米GABA逆流提取的影响效果,因此所得方程能够预测响应值随各参数的变化规律[14],可用作发芽糙米提取GABA提取评定的理论基础。
2.3.3响应面水平的分析与优化利用Design-Expert8.0软件对回归方程构建响应面分析图,响应面分析图是响应值对各实验因子所构成的三维空间的曲面图,从响应面分析图上可以形象的看出最佳参数和各个参数之间的相互影响作用[15]。依回归方程绘制的响应曲面和等高线图如图7~图9所示。
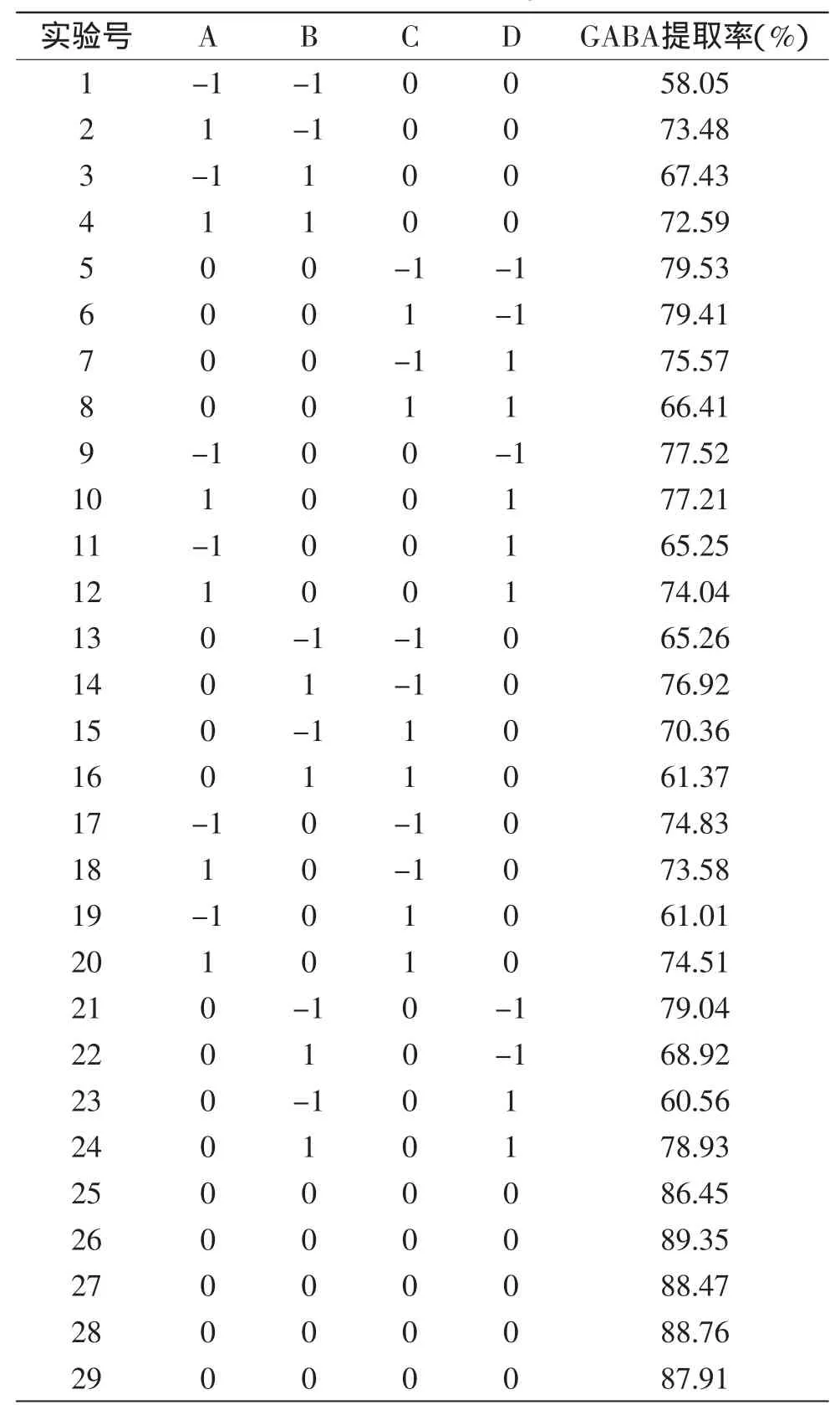
表2 Box-Behnken实验设计优化方案及结果Table 2 Optimization project design and experimental results of Box-Behnken design
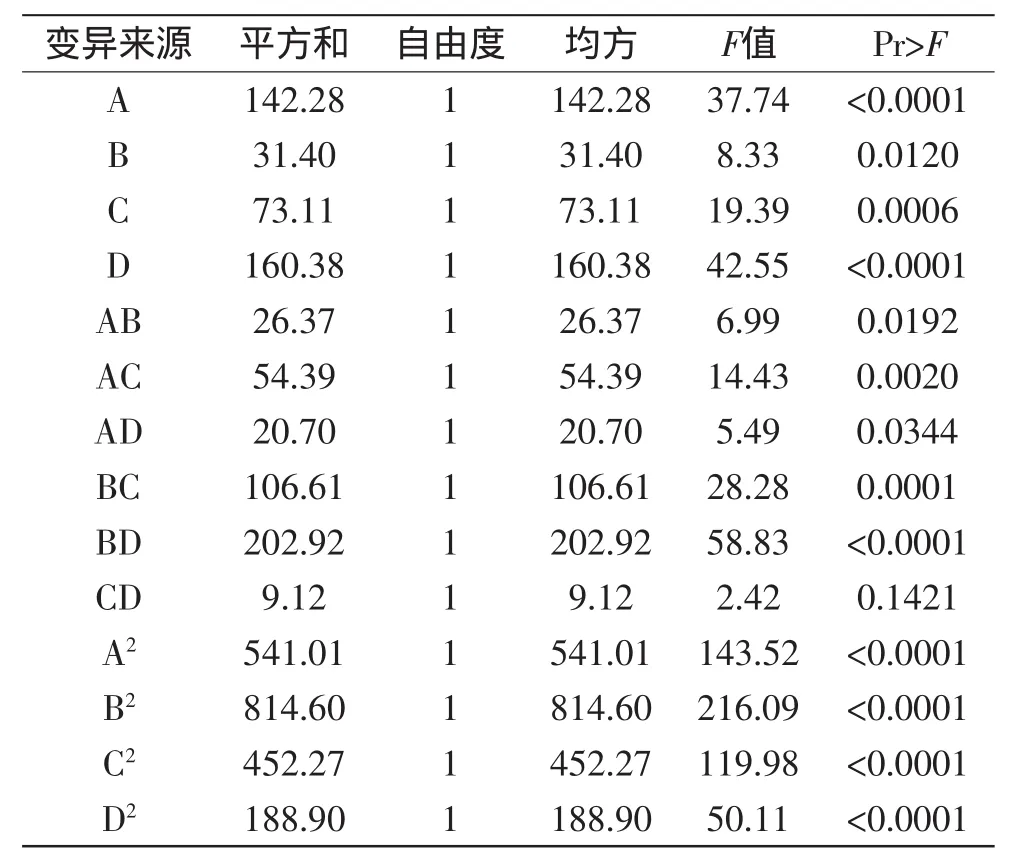
表3 回归方程的显著性检验Table 3 Test of significance for regression equation
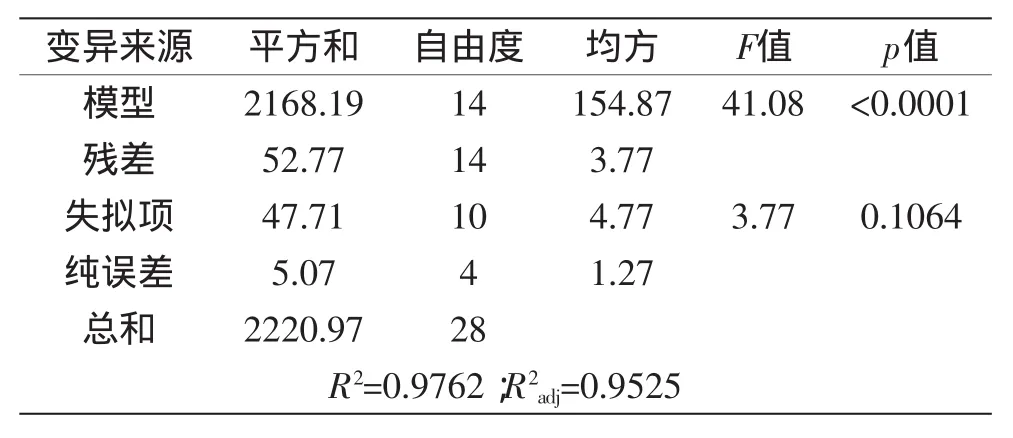
表4 逆流提取GABA提取率回归模型的方差分析结果Table 4 Analysis of variance for regression equation of extraction rate of countercurrent extraction on GABA
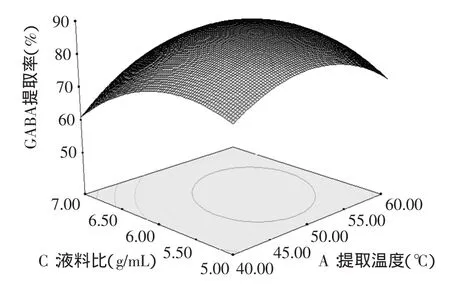
图7 提取温度与液料比对GABA提取率影响的响应面图Fig.7 Response surface plots of extraction temperature and liquid/material ratio on the GABA content
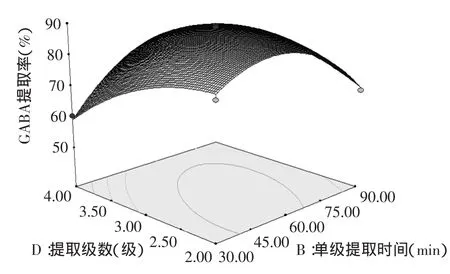
图8 提取级数与单级提取时间对GABA提取率影响的响应面图Fig.8 Response surface plots of extraction numbers and single stage extraction time on the GABA content
通过上述响应面图可即可对任何两个因素交互影响发芽糙米GABA提取率效应进行分析和评价。响应面坡度相对平缓,表示可以接受处理条件的变化[16]。图7表示固定单级提取时间和提取级数,提取温度与液料比对提取率的影响,在提取温度为40~60℃,液料比为5∶1~7∶1时,提取率与单级提取时间和提取级数的增加而提高。根据图8得知,提取率随着单级提取时间与提取级数的增加而增加。图9表示提取温度50℃,提取级数3级时,发芽糙米GABA提取率逐渐的提高。由响应面的分析图可知,回归模型存在最大值,最高点位于实验设计范围内,结合回归模型的数学分析,对回归方程进行一阶偏导并令等于零,得到响应曲面的最大值点[17],整理得出最佳条件参数为A=51.4,B=59.3,C=5.9∶1,D=3。为检验RSM法的可靠性,采用上述最优提取条件对发芽糙米GABA进行提取实验,考虑到实际操作简便,将GABA的最佳提取工艺调整为提取温度51℃,单级提取时间59min,液料比为5.9∶1,提取级数3级,在此最佳参数条件下进行3次验证实验,循环逆流法提取发芽糙米GABA平均提取率达到89.35%,与理论值89.47%接近,说明回归方程能够真实的反应各参数对提取率的影响,对发芽糙米GABA提取工艺具有指导意义。
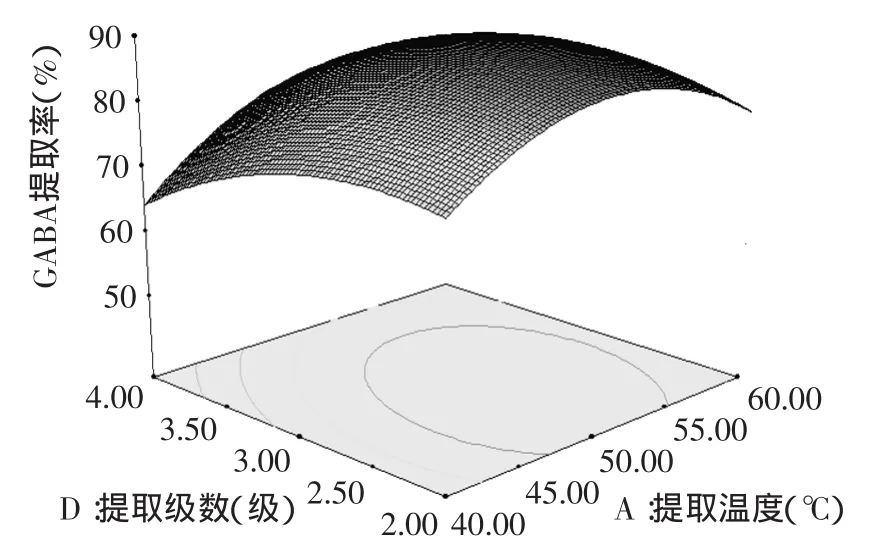
图9 提取温度与提取级数对GABA提取率影响的响应面图Fig.9 Response surface plots of extraction temperature and extraction numbers on the GABA content
3 结论
采用Box-Behnken响应面法建立影响因素的二次回归模型,对数据进行分析,得到发芽糙米GABA最佳逆流提取工艺为提取温度51℃、单级提取时间59min、液料比5.9∶1、提取级数3级,此条件下GABA提取率达到89.35%,实验拟合误差小,可用来实际预测和评价发芽糙米GABA提取量,该方法是一种值得参考的高效、节能的提取工艺方法,采用逆流提取技术具有一定的可行性[18]。
[1]张晖,姚惠源,姜元荣.富含γ-氨基丁酸保健食品的研究与开发[J].食品与发酵工业,2002,28(9):69-72.
[2]Rui Liu,Xiangli He,Jiaqi Shi,et al.The effect of electrolyzed water decontamination,germination and g-aminobutyric acid accumulation of brown rice[J].Food Control,2013,33(1):1-5.
[3]NaruebodeeSrisang,WaruneeVaranyanond,Somchart Soponronnarit,et al.Effects of heating media and operating conditions on drying kinetics and quality of germinated brown rice[J].Journal of Food Engineering,2011,107(3):385-392.
[4]栾连军,陈娜,刘雪松,等.葡萄籽原花青素多级逆流提取工艺研究[J].中国食品学报,2010,10(5):32-35.
[5]R Poirot,L Prat,C Gourdon,et al.Fast batch to continuous solid-liquid extraction from plants in continuous industrial extractor[J].Chem Eng Technol,2006,29(1):46-51.
[6]S M Shen,J H Dai.Development of multistage count-current continuousextracting machine[J].Pharm Eng Des,1977,18(4):4-5.
[7]Q E Wang,S M Ma,B Q Fu,et al.Development of multistage countercurrent extraction technology for the extraction of glycyrrhizic acid(GA)from licorice[J].Biochem Eng,2004,21(3):285-292.
[8]G O Veloso,G C Thomasa,V G Krioukov.A mathematical model of extraction in countercurrent crossed flows[J].Chemical Engineering and Processing,2008,47(9):1470-1477.
[9]蒋静,马涛.营养液培养糙米发芽富集GABA工艺条件优化[J].食品工业科技,2013,34(5):195-199.
[10]张毅,宁正祥,董华强,等.多穗柯总黄酮的连续逆流提取研究[J].现代食品科技,2011,27(5):550-552.
[11]陈恩城,张名位,彭超英,等.比色法快速测定糙米中γ-氨基丁酸含量研究[J].中国粮油学报,2006,21(1):125-128.
[12]JOSHI S,YADAV S,DESAI A J.Application of response surface methodology to evaluate the optimum medium components for the enhanced production of lichenysin by Bacillus licheniformis[J].Biochemical Engineering Journal,2008,41(2):122-127.
[13]刘振春,张利宽,于畅,等.响应面优化超声波辅助提取发芽糙米黄酮工艺[J].食品科学,2012,33(8):80-84.
[14]王伟.响应面分析法优化花生壳黄酮类化合物提取工艺及其抗氧化活性的研究[J].安徽农业科学,2011,39(22):13521-13523.
[15]丁双华,叶立斌,陈卫,等.响应面优化提取桑叶多酚的研究[J].中国食品学报,2012,12(1):52-58.
[16]陈源,杨道富,范丽华,等.响应面法优化微波提取茂谷橘橙皮总黄酮工艺[J].中国食品学报,2013,13(4):80-86.
[17]马凤鸣,李浦,叶万军.脉冲强光对梨多酚氧化酶钝化实验研究[J].食品工业科技,2012,33(6):159-162.
[18]Zheng-Wei Cui,Ming-Qi Cai,Chun-Fang Song,et al. Effects of different pretreatments on dynamic countercurrent extraction of polysaccharides from Ganoderma[J].Separation and Purification Technology,2012,85(2):61-68.
Process optimization of γ-aminobutyric acid from germinated brown rice by circulating countercurrent extraction method
MA Tao1,LIU Li-xia2,ZHAO Xu3,WANG Bo1,LIU He1,HUI Li-juan1,HE Yu-tang1
(1.College of Chemistry,Chemical Engineering and Food Safety,Bohai University,Jinzhou 121013,China;2.College of Food Science and Technology,Shenyang Agricultural University,Shenyang 110866,China;3.Grain Science Research Institute of Liaoning Province,Shenyang 110866,China)
By using water as extraction solvent,the laboratory simulation of dynamic countercurrent extraction method and response surface experimental design method were used for optimizing process conditions of γ-aminobutyric acid from germinated brown rice.The experimental results showed that the optimal extraction conditions were single stage extraction time for 59min at 51℃,a liquid material ratio 5.9∶1(mL/g)and extracted from the series 3.Under this conditions,the average extraction rate of GABA could reach 89.35%。
germinated brown rice;γ-aminobutyric acid;countercurrent extraction;condition optimization
TS210.4
B
1002-0306(2015)14-0249-05
10.13386/j.issn1002-0306.2015.14.043
2014-09-01
马涛(1962-),男,博士,教授,研究方向:食品科学,生物材料科学。
