果胶酶在磁性复合载体上的固定化及其酶学性质
2015-11-07林建城陈越丽
林建城,陈越丽
(莆田学院环境与生物工程学院,福建莆田351100)
果胶酶在磁性复合载体上的固定化及其酶学性质
林建城,陈越丽
(莆田学院环境与生物工程学院,福建莆田351100)
通过Fe3O4磁核与海藻酸钠明胶制备磁性复合载体,戊二醛交联后协同对果胶酶进行固定化,并研究固定化酶的酶学性质。利用正交实验优化固定化酶的制备条件,比较研究了固定化酶与溶液酶的酶学性质。结果表明:在Fe2+(5mol/L)∶Fe3+(5mol/L)体积比为0.75∶1的溶液中,制备Fe3O4磁核;3.5%海藻酸钠与3.0%明胶以2.5∶1的体积比,加入3.0mg/mL Fe3O4磁核量,在体积分数4.0%的戊二醛中交联2.5h;以每克载体加入20mg果胶酶,pH4.0下固定60min,制备的固定化果胶酶活力回收率可达78.69%。固定化果胶酶最适pH为4.0,在pH3.0~7.0内稳定;最适温度50℃,在20~50℃具有较好的热稳定性;表观米氏常数Kmapp为3.162mg/mL;重复使用10次后,酶活力还剩51%,4℃下储存10d,酶活力还保留81%。说明以戊二醛交联磁性海藻酸钠明胶为复合载体制备的固定化果胶酶,机械强度大、弹性好,酶活力回收率高,操作稳定性好。
磁性复合载体,果胶酶,固定化,酶学性质
酶固定化载体与固定化方法是固定化酶研究的核心问题。海藻酸钠是从海藻中提取的一种亲水性胶态多聚糖,这种线性高分子化合物含有自由的羧基和羟基,作为固定化酶载体,具有生物相容性、传质性能好,成本低以及操作简单等优点[1]。明胶是由胶原部分水解而得到的一类蛋白质,溶解性好而且价格低廉,可以很好的改善海藻酸钠的成型效果;与单一应用海藻酸钠载体相比,利用海藻酸钠与明胶联合固定化制备的凝胶粒,可以为酶提供更大的固定化空间,有利于内外物质的扩散[2]。目前采用这2种高分子材料为复合载体协同对酶进行固定的研究不多,薛庆海等[3]使用海藻酸钠明胶协同包埋苋菜脂氢过氧化物裂解酶,并使用戊二醛交联,获得了较好的固定化效果。采用海藻酸钠明胶协同固定化纤维素酶和脂肪酶[4-5],制备的固定化酶也呈现较好的热稳定性与储存稳定性,显示了海藻酸钠明胶复合载体在酶固定化中的优越性。前已用明胶、壳聚糖为载体分别制备了固定化果胶酶[6-7],但是存在固定化载体易破碎,酶活力回收率不高或酶反应器难于使用等诸多缺点。
此外,近年来发现利用磁性高分子微球载体制备的固定化酶具有磁响应性,能较快从反应体系中分离和回收,操作简便,还可借助外部磁场将其应用在流化床式的酶反应器中,比表面积大,从而提高固定化酶的催化效率[8-10]。为此,本课题组以壳聚糖为载体制备了磁性壳聚糖微球固定化果胶酶,获得了各种性能较好固定化酶[11]。为了进一步提高固定化果胶酶酶活力回收率和固定化酶的操作稳定性,本文拟采用Fe3O4磁核与海藻酸钠和明胶制备成磁性复合载体,戊二醛交联后协同对果胶酶进行固定,并优化固定化酶制备的条件,研究固定化酶的酶学性质,旨为固定化果胶酶在食品工业中应用提供可靠的实验数据。
1 材料与方法
1.1材料与仪器
果胶酶(20000U/g) 莆田市绿森庄园酒业有限公司赠送,以0.1mol/L pH4.0柠檬酸-柠檬酸钠缓冲液配制果胶酶液;果胶Sigma公司;明胶、戊二醛(50%)、碘和可溶性淀粉购于国药集团化学试剂有限公司;海藻酸钠购于广东光华化学厂有限公司;柠檬酸、柠檬酸钠、硫代硫酸钠、碳酸钠、氢氧化钠、FeCl2、FeCl3均为分析纯,购于天津市红岩化学试剂厂。
JBZ-14H磁力搅拌器上海隆拓仪器设备有限公司;THZ-82恒温振荡器常州润华电器有限公司;HH-4恒温水浴锅常州国华电器有限公司;BS224S电子天平北京赛多丽斯科学仪器有限公司;TDL-5低速大容量离心机上海安亭科学仪器厂;PHS-25精密数显酸度计南京晓晓仪器设备有限公司。
1.2实验方法
1.2.1Fe3O4磁核的制备参照文献[11]的方法,5mol/L的FeCl2和FeCl3以一定的体积比,与过量的3mol/L NaOH混合均匀后,磁力搅拌30min,用磁铁从底部吸住沉淀物,去除上清液,用蒸馏水重复洗至中性,烘干得Fe3O4磁核。
1.2.2磁性海藻酸钠明胶微球的制备参照文献[11]的方法,并略作修改如下:3.5%海藻酸钠与3.0%明胶以一定体积比例混合,加入一定量Fe3O4磁核,搅拌均匀,以30次/min振速振荡混匀30min,用5mL注射器吸取上述混合液,从约10cm高度滴入2%CaCl2溶液中,形成凝胶微球。滤出微球,更换CaCl2溶液,4℃下静置继续硬化2h。再滤出凝胶微球,用质量分数为0.9%NaCl洗涤,沥干,得磁性凝胶微球,50℃下真空干燥。
1.2.3磁性复合载体固定化果胶酶的制备将磁性凝胶微球与戊二醛交联一定时间,蒸馏水洗涤3次,50℃下真空干燥,获得交联磁性凝胶微球复合载体。将复合载体与果胶酶液混合,25℃下以30次/min振速振荡固定,用蒸馏水清洗3次,获得固定化酶,4℃下存储备用。
1.2.4海藻酸钠与明胶体积比对固定化酶制备的影响选择3.5%海藻酸钠与3.0%明胶5种体积比:3.0∶1.0、2.5∶1.0、2.0∶1.0、1.0∶1.0、0.5∶1.0,分别制备固定化酶凝胶微球,比较不同体积比下制备的凝胶微球弹性、硬度以及固定化酶活力。
凝胶微球复合载体弹性的检测:以微球从10cm高处自由落在树脂板面上的还弹高度来表示,还弹高度高表明制备的小球体弹性好;凝胶微球硬度的检测:将微球用手轻捏,分易碎、较易碎和不易碎等3种不同硬度。
1.2.5Fe2+:Fe3+体积比对固定化酶制备的影响在0.5∶1、0.75∶1、1∶1、1.25∶1、1.5∶1、2∶1等6种不同Fe2+∶Fe3+体积比下,制备Fe3O4磁核,研究Fe2+∶Fe3+体积比对固定化酶制备的影响。
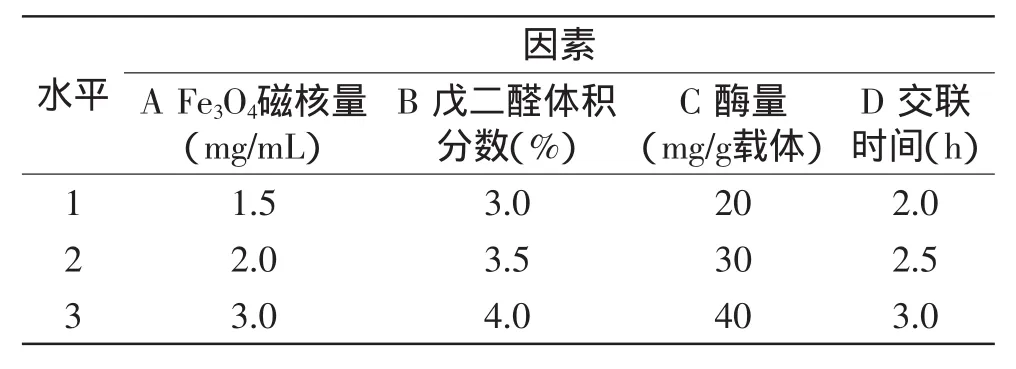
表1 L9(34)正交实验设计Table 1 Factors and levels of L9(34)orthogonal experiment
1.2.6固定化果胶酶制备条件的优化
1.2.6.1单因素实验设计在戊二醛体积分数为3.5%,20mg/g载体的酶量(1g载体固定20mg果胶酶),交联时间2.0h,固定化时间60min,固定化体系pH4.0下研究1.5、2.5、3.0、3.5、4.0、5.0mg/mL Fe3O4磁核量对固定化酶制备的影响;在3.0mg/mL Fe3O4磁核量、酶量为20mg/g载体,交联时间2.0h,固定化时间60min,固定化体系pH4.0下研究1.0%、2.0%、3.0%、3.5%、4.0%、5.0%戊二醛体积分数对固定化酶制备的影响;在3.0mg/mL Fe3O4磁核量、戊二醛体积分数4.0%,交联时间2.0h,固定化时间60min,固定化体系pH4.0下研究10、20、30、40、50、60mg/g载体的酶量对固定化酶制备的影响;在3.0mg/mL Fe3O4磁核量,戊二醛体积分数4.0%,酶量为30mg/g载体,固定化时间60min,固定化体系pH4.0下,研究1.0、2.0、2.5、3.0、4.0、5.0h不同交联时间对固定化酶制备的影响;在3.0mg/mL Fe3O4磁核量,戊二醛体积分数4.0%,酶量为30mg/g载体,交联时间2.5h,固定化体系pH4.0下,研究20、40、60、80、100、120min不同固定化时间对固定化酶制备的影响;在3.0mg/mL Fe3O4磁核量,戊二醛体积分数4.0%,酶量为30mg/g载体,交联时间2.5h,固定化时间60min下,研究pH3.0、3.4、3.8、4.0、4.4、5.0不同固定化体系pH对固定化酶制备的影响。
1.2.6.2正交实验设计选择Fe3O4磁核量、戊二醛体积分数、酶量(mg/g载体)、交联时间(h)4个因子,按照L9(34)正交实验设计(表1),确定磁性海藻酸钠明胶协同固定化果胶酶的制备方案。
1.2.7果胶酶与固定化果胶酶活力的测定果胶酶活力测定方法采用次碘酸钠滴定法[12]。固定化酶活力测定参照文献[11],20mL反应体系包括:1%果胶溶液(pH4.0)10mL,蒸馏水10mL。50℃预热15min后,加入1g固定化酶,继续反应lh,隔20min摇动一次,置沸水浴中灭活10min,冷却,回收固定化酶,采用次碘酸钠滴定法测定固定化果胶酶活力。1个酶活力单位(U)定义为:在上述条件下,每分钟催化果胶水解生成1μmoL浓度半乳糖醛酸所需的酶量为1个酶活力单位(U)。
固定化酶活力回收率(%)=(固定化酶总活力/溶液酶总活力)×100
1.2.8酶的最适温度及温度稳定性测定参照文献[13]的方法,检测不同温度(20~90℃)下固定化果胶酶和溶液果胶酶的酶活力,确定酶的最适温度。再将固定化果胶酶和溶液果胶酶分别置于不同温度下处理1h,然后取一定量处理过的酶液,在最适温度下检测各自酶活力,计算热处理后的剩余酶活力(%),分析固定化酶和溶液酶的温度稳定性。
1.2.9酶的最适pH及酸碱稳定性测定参照文献[13]的方法,测定在不同pH(3.0~8.0)下固定化果胶酶和溶液果胶酶的酶活力,确定它们的最适pH。再将固定化果胶酶和溶液果胶酶分别置于不同pH的0.1mol/L柠檬酸缓冲液中,4℃下处理2h,在最适pH下检测各自酶活力,计算酸碱处理后的剩余酶活力(%),分析固定化酶和溶液酶的酸碱稳定性。
1.2.10酶的动力学参数测定酶米氏常数(Km)测定参照文献[13]的方法,在固定化酶和溶液酶的测活体系中,改变底物果胶的浓度(0.7~5.0mg/mL),分别测定各底物浓度下固定化酶和溶液酶的酶活力,采用Lineweaver-Burk双倒数作图法作图,测定溶液果胶酶的Km和固定化果胶酶的表观米氏常数(Kmapp)。
1.2.11固定化酶操作稳定性的测定参照文献[14]的方法,测定上述制备的1g固定化果胶酶的酶活力,固定化酶使用后,用蒸馏水清洗3次,再测定该固定化酶的酶活力,计算其相对酶活力(%);同法连续测定10次,从固定化酶多次使用后酶活力的变化分析固定化酶的操作稳定性。
固定化酶相对酶活力(%)=每次使用后固定化酶活力/首次固定化酶活力×100
1.3数据处理
数据采用SPSS 17.0数据分析软件分析,采用grapher 7.0数据绘图软件绘图。
2 结果与分析
2.1磁性海藻酸钠明胶微球的制备
2.1.1海藻酸钠与明胶体积比对固定化酶制备的影响研究了海藻酸钠与明胶的体积比对固定化酶制备的影响。结果见表2,海藻酸钠与明胶的体积比为1.0∶1.0时,凝胶刚好能成球,没有拖尾现象,弹性差,较易碎,小于这个体积比制备的凝胶难成球且易碎,这是由于被包埋的酶量减少,酶活力反而较高。当体积比为2.5∶1.0时,制备的球形凝胶固定化酶活力高,但随着海藻酸钠体积的增加,制备的固定化酶活力反而降低。说明海藻酸钠和明胶体积比影响着载体的机械强度和成球难易,海藻酸钠所占体积比大,凝胶成球效果好;但所占体积比若过大,制备的载体强度大,球体质地致密而凝胶网孔小,吸附在凝胶网孔上酶量减少,底物与酶之间接触速率和产物传递速率也降低,进而降低了酶的催化活力。因此,海藻酸钠与明胶的体积比为2.5∶1.0是较适宜的。

表2 不同体积比的海藻酸钠与明胶对固定化酶的影响Table 2 Effect of volume ratio of sodium alginate and gelatin on the immobilized pectinase
2.1.2Fe2+∶Fe3+体积比对固定化酶制备的影响0.5∶1、0.75∶1、1∶1、1.25∶1、1.5∶1、2∶1等6种Fe2+∶Fe3+体积比下,制备的固定化酶活力分别为3.50、4.67、4.08、3.83、3.58、3.00U。结果表明,当Fe2+∶Fe3+体积比为0.75∶1时,制备的磁性海藻酸钠明胶固定化酶活力较高;后随Fe2+占比越大,制备的固定化酶活力逐渐减小。磁核Fe3O4的形成原理是:Fe2++2Fe3++8OHˉ=Fe3O4↓+4H2O,形成的Fe3O4易被氧化为Fe2O3[15],Fe3+可能是通过配位键与果胶酶上的基团结合,从而也可起到对果胶酶的固定作用,因此,Fe2+、Fe3+配比会影响固定化酶的活力。
2.2复合载体固定化果胶酶制备的影响因素
2.2.1Fe3O4磁核量对固定化酶的影响研究了Fe3O4磁核量对固定化酶制备的影响。结果见表3,表明:随着Fe3O4磁核量的提高,制备的固定化酶酶活力逐渐增大;当Fe3O4磁核量为3.0mg/mL时,固定化酶活力最高为5.00U,酶活力回收率达65.22%;Fe3O4磁核量大于3.0mg/mL时,制备的固定化酶活力反而呈下降趋势。固定化酶主要是依靠磁性微球载体的吸附及其戊二醛的交联作用实现对果胶酶的固定,如果磁核量多了,磁核会渗出微球表面,影响了它们之间的交联而使固定化酶的活力降低。
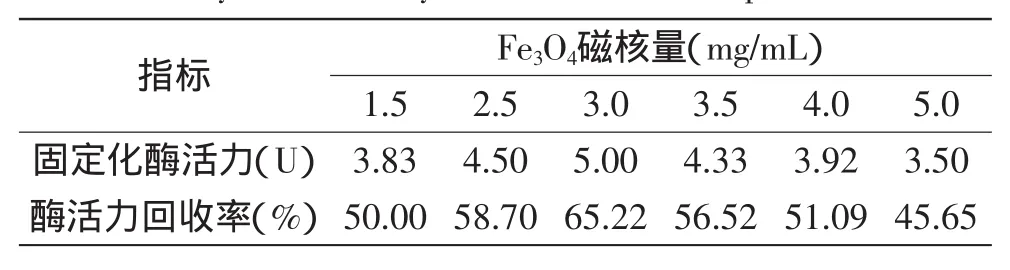
表3 Fe3O4磁核量对固定化酶酶活力与回收率的影响Table 3 Effect of concentration of Fe3O4magnetic nucleus on activity and recovery rate of immobilized pectinase
2.2.2戊二醛浓度对固定化酶的影响从表4可知,戊二醛体积分数在1.0%~4.0%范围时,固定化酶活力随其浓度增加而增大,戊二醛浓度为4.0%时,固定化酶活力和酶活力回收率达最大,5.0%戊二醛制备的磁性微球硬度大、易碎,酶活力较低,因此,固定化体系中采用4.0%戊二醛较为适宜。戊二醛既是交联剂,又是酶的变性剂;戊二醛浓度过大,大量的醛基与酶分子及载体之间相结合,酶活性中心的结合位点过多,催化时产生了空间障碍,从而导致固定化酶活力下降。
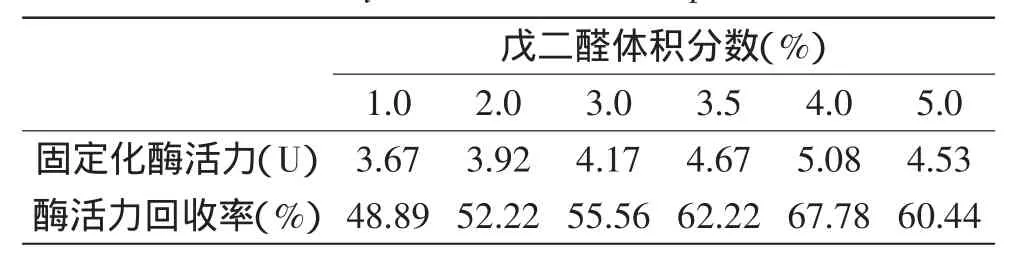
表4 戊二醛体积分数对固定化酶酶活力与回收率影响Table 4 Effect of volume fraction of glutaraldehyde on activity and recovery rate of immobilized pectinase
2.2.3酶量对固定化酶的影响研究了不同固定化酶量对固定化酶制备的影响。结果见表5:1g微球载体固定的酶量小于30mg时,随酶量增加固定化酶活力呈上升趋势,固定化酶量超过30mg,固定化酶活力随酶量增加反而呈逐渐下降趋势;而酶活力回收率随固定化酶量的增加则呈下降趋势,1g载体固定10mg酶,酶活力回收率最高,但酶活力最小。综合考量酶回收率与酶活力,1g微球载体固定20~30mg酶量为适宜。固定化酶与溶液酶不同,不是酶浓度越大,酶活力越高;若在固定化凝胶载体中加入过量的酶,酶在载体上的结合位点趋于饱和,酶则会堆积在载体表面或凝胶网孔深处,酶催化时存在空间位阻,凝胶网孔深处的底物扩散困难,内扩散阻力使底物分子与活性中心的接近受阻,影响其催化活性。
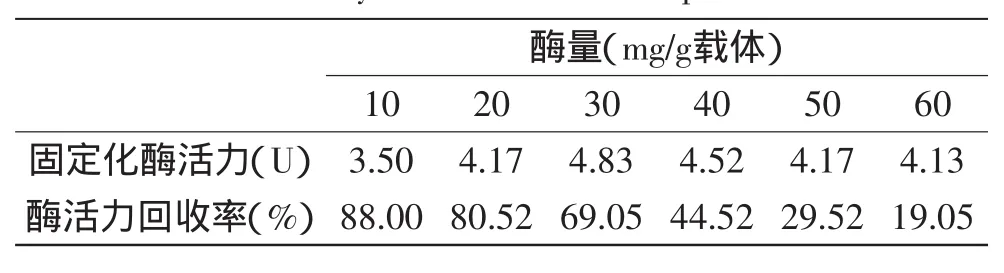
表5 固定化酶量对固定化酶酶活力和回收率的影响Table 5 Effect of amount of immobilized pectinase on activity and recovery rate of immobilized pectinase
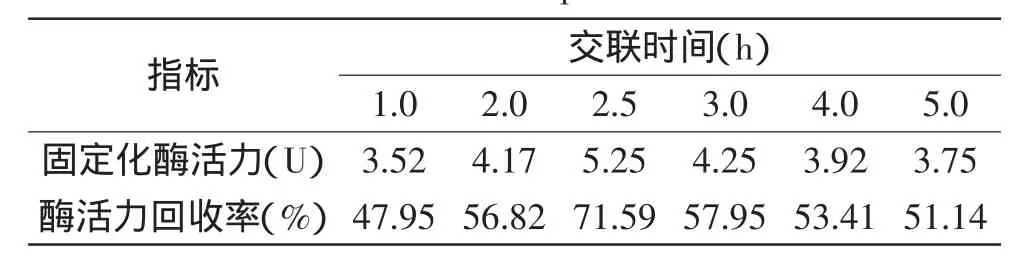
表6 交联时间对固定化酶酶活力和回收率的影响Table 6 Effect of time of crosslink on activity and recovery rate of immobilized pectinase
2.2.4交联时间对固定化酶的影响研究了戊二醛与微球载体交联时间对固定化酶制备的影响,结果见表6。从表6可知,戊二醛交联2.5h时,固定化果胶酶活力最高为5.25U,酶活力回收率高达71.59%,2.5h的交联时间较为适宜;随着交联时间的延长,固定化酶活力反而逐渐下降。说明随着凝胶载体与戊二醛间交联时间的延长,交联度增大,酶的结合位点较多,固定化酶的活力则提高;但交联度若过大,可能由于空间位阻现象反而会影响酶在载体上的固定,而使固定化酶活力下降。
2.2.5固定化时间对固定化酶的影响研究固定化时间为20、40、60、80、100、120min下对固定化酶活力的影响,测得固定化酶活力分别为3.83、4.67、5.33、4.72、4.17、3.92U。结果显示:固定化时间为60min时,固定化酶活力达到最大;当固定化时间超过60min,固定化酶活力呈逐渐下降的趋势。这是由于吸附时间过长酶则会渐渐失活,再则,过多的酶吸附于载体表面,导致凝胶网孔堵塞,酶蛋白分子互相屏蔽,酶与底物难以契合,酶活力也就降低了。因此,固定化时间60min较为适宜。
2.2.6固定化体系pH对固定化酶的影响考察了不同pH固定化体系对固定化果胶酶活力的影响。在固定化体系中pH为3.0、3.4、3.8、4.0、4.4、5.0下,测得固定化酶活力分别为3.03、3.92、4.33、5.17、4.18、3.67U。结果表明:当固定化体系pH4.0时,固定化果胶酶活力最高,这与果胶酶最适pH接近,偏酸性。酶蛋白质中的-NH2与戊二醛的醛基之间的加成反应,也需要在酸性环境中进行[1];偏离最适pH也会引起酶蛋白的部分失活,所以固定化体系应选择pH4.0的柠檬酸缓冲体系。
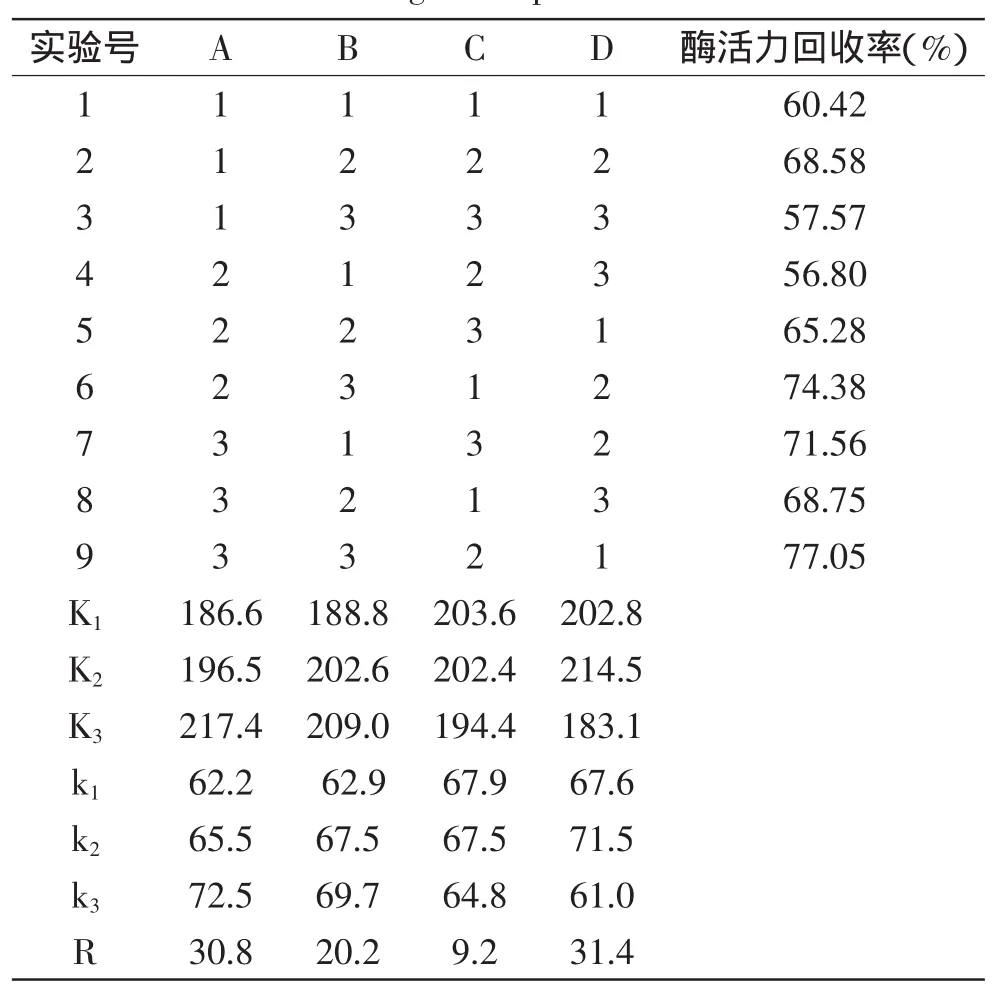
表7 L9(34)正交实验结果与分析Table 7 Results and range analysis of L9(34)orthogonal experiment
2.3固定化果胶酶制备条件的优化
选择了Fe3O4磁核量、酶量、戊二醛浓度和交联时间4个影响因素,以酶活力回收率为指标,采用L9(34)正交实验对制备条件进行优化,表7结果表明,R极差大小顺序为D>A>B>C,即固定化酶制备的主要影响因素从主到次是:交联时间>Fe3O4磁核量>戊二醛浓度>酶量,最优组合为A3B3C1D2,即磁粉Fe3O4量为3.0mg/mL,戊二醛浓度为4.0%,1g载体加入20mg酶量,交联时间2.5h。此条件下制备的载体与果胶酶在pH4.0下固定60min,固定化酶活力回收率可达至78.69%,这比用磁性壳聚糖微载体固定的果胶酶酶活力回收率(68.4%)大[11]。
2.4固定化果胶酶的酶学性质
2.4.1酶的最适温度及温度稳定性研究了温度对果胶酶活力的影响,结果见图1。图1表明,固定化果胶酶的最适温度为50℃,大于溶液酶的最适温度(40℃)。溶液酶在20~40℃区域内具有较好的稳定性,在40℃后,酶活力呈现明显下降趋势;而固定化果胶酶在20~50℃区域内稳定性较好,超过50℃后,固定化酶活力开始下降;90℃时固定化酶剩余活力为20.3%,溶液酶则只剩3.82%,说明固定化酶的温度稳定性有一定程度的提高。温度升高使酶变性失活,是由于维持酶蛋白空间构象的次级键发生断裂引起酶分子伸展变形所致,而固定化后的酶分子与载体间多点连接,可防止热引起的酶分子伸展变形作用。
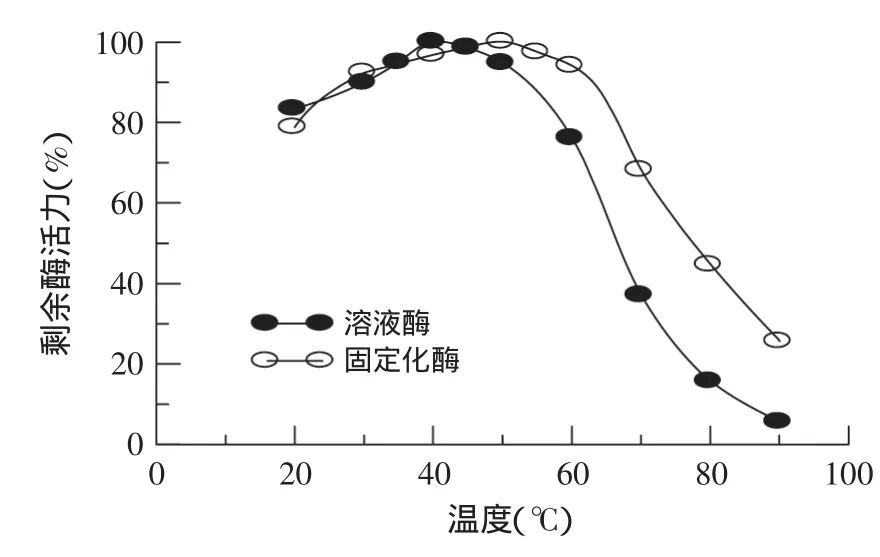
图1 溶液酶与固定化酶的最适温度Fig.1 The optimum temperature of soluble pectinase and immobilized pectinase
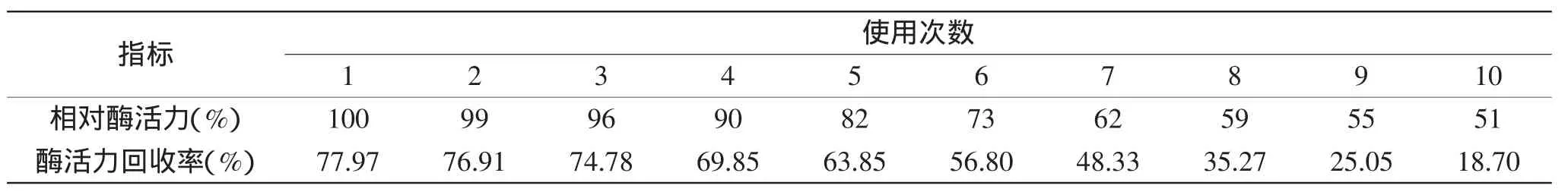
表8 固定化酶的操作稳定性Table 8 Operation stability of immobilized pectinase
2.4.2酶的最适pH及酸碱稳定性研究了pH对果胶酶活力的影响。结果表明:固定化果胶酶与溶液酶的最适pH均为4.0。固定化果胶酶在pH3.0~7.0范围内相对稳定,而溶液酶在pH3.0~5.5范围内较稳定;pH7.0下处理2h,固定化酶剩余活力为67.0%,溶液酶则只剩20.2%,说明固定化酶比溶液酶较耐酸碱。可能原因为:酶蛋白活性中心上的带电基团与海藻酸钠明胶载体和戊二醛上的基团之间发生相互作用,导致酶活性中心解离基团不易受环境中pH变化的影响;固定化缓冲液体系中的带电基团与海藻酸钠明胶载体上带电基团的结合,削弱了pH变化对酶蛋白活性中心解离基团的影响;固定化后酶分子与载体多点连接,可防止酸碱变化引起的酶分子伸展变形作用。
2.4.3固定化果胶酶的动力学参数改变果胶底物的浓度,在测活体系下分别测定了固定化酶和溶液酶的酶活力,采用Lineweaver-Burk双倒数作图法,以底物浓度倒数(y)对反应速度倒数(x)作图。得固定化酶的线性方程为:y=0.623x+0.197,求得固定化酶表观米氏常数Kmapp=3.162mg/mL;溶液酶的线性方程为:y=0.350x+0.331,求得溶液酶的米氏常数Km= 1.057mg/mL。说明磁性海藻酸钠明胶协同固定的果胶酶对底物的亲和力降低。
2.4.4固定化酶的操作稳定性对制备的固定化酶进行10批次的使用,从表8可知,重复使用6次后,酶活力回收率为56.8%;重复使用10次后,酶活力还剩余51%,而且磁性球形载体还保持较好弹性,破碎现象少;而用磁性壳聚糖微载体固定的果胶酶,重复使用6次后,酶活力只剩余4%[11]。说明以海藻酸钠明胶协同固定化的果胶酶不仅酶活力回收率高,还具有较好的操作稳定性。
2.4.5固定化酶的储存稳定性固定化酶在4℃和25℃下分别储存30d,每隔5d,测其剩余酶活力(%)。图2结果显示,固定化酶在4℃下储存10d,酶活力还保持81%的较高水平,而在25℃下储存,剩余酶活力为74%;但4、25℃下储存30d后,固定化酶活力分别只剩42%、34%,说明随着储存时间的延长,固定化酶活力逐渐丧失,磁性海藻酸钠明胶协同固定化果胶酶在4℃下储存相对较好。
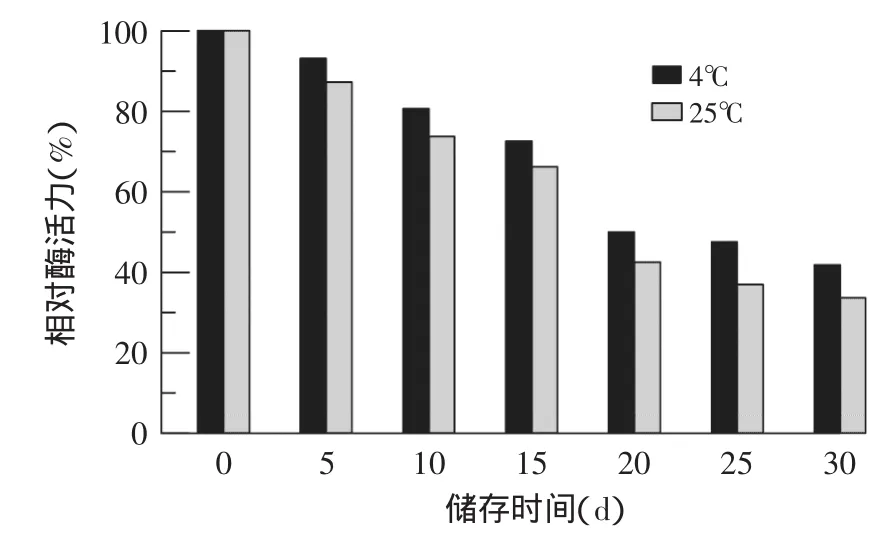
图2 固定化酶的储存稳定性Fig.2 Storage stability of immobilized pectinase
3 结论
5mol/L FeCl2和5mol/L FeCl3以0.75∶1.0的体积比,在过量的NaOH中制备Fe3O4磁核。3.5%海藻酸钠与3.0%明胶以2.5∶1.0的体积比,加入3.0mg/mL Fe3O4磁核量,在2%氯化钙中成磁性球体后,在体积分数4.0%戊二醛中交联2.5h,1g磁球载体中加入20mg酶量,在pH4.0柠檬酸缓冲体系下固定60min,此条件下可制得磁性海藻酸钠明胶协同固定化果胶酶,磁性微球载体弹性好,不易碎,酶活力回收率可达至78.69%;固定化酶重复使用10次后,酶活力还剩51%,4℃下储存30d后,固定化酶活力剩余42%。
磁性海藻酸钠明胶协同固定化果胶酶其最适pH为4.0,最适温度为50℃,在pH 3.0~7.0、20~50℃温度范围内酶相对稳定,固定化酶表观米氏常数Kmapp为3.162mg/mL。
[1]刘峥,林原斌,吕慧丹.交联海藻酸钠磁性微球的制备及固定化胰蛋白酶研究[J].材料导报,2006,20(12):1337-1340,1347.
[2]王爱玲,杨江科,尹利,等.海藻酸钠明胶协同固定化的研究[J].生物技术,2006,16(6):69-72.
[3]薛庆海,徐梁,沐万孟,等.海藻酸钠明胶及戊二醛协同固定化苋菜脂氢过氧化物裂解酶[J].食品与发酵工业,2010,36(12):10-14.
[4]王爱玲,杨江科,黄瑛,等.海藻酸钠明胶协同固定化黑曲霉脂肪酶[J].应用化工,2007,36(4):317-320,324.
[5]裴哲,朱启忠,李希红,等.海藻酸钠明胶联合固定化香菇纤维素酶的技术研究[J].生物技术,2010(7):126-129.
[6]林建城,梁杰,苏渊红.球形交联壳聚糖固定化果胶酶在枇杷果汁澄清中的应用[J].食品与发酵工业,2012,38(11):84-87.
[7]林建城,朱丽华,王志鹏,等.明胶固定化果胶酶的制备及酶学性质研究[J].食品科学,2006,27(12):315-318.
[8]王玫,宋芳,汪世龙,等.磁性纳米颗粒Fe3O4固定化纤维素酶的光谱学研究[J].光谱学与光谱分析,2006(5):895-898.
[9]Liu X Q,Guana Y P,Shen R,et al.Immobilization of lipase on to micron-size magnetic beads[J].Journal of Chromatography B,2005,822(1):91-97.
[10]赵敏,王玮,李昕芯,等.海藻酸钠磁性微粒的制备及对漆酶的固定化[J].中国造纸学报,2008,23(4):94-99.
[11]林建城,陈燕红,张雄.交联壳聚糖磁性微球的制备及固定化果胶酶研究[J].中国农学通报,2012,28(33):204-208.
[12]郭勇.酶工程[M].北京:中国轻工出版社,1996:322-323.
[13]林建城,杨文杰,朱丽华,等.商品果胶酶(Aspergillus niger)的催化动力学研究[J].甘肃农业大学学报,2006,41(4):81-85.
[14]裴哲,朱启忠,李希红,等.海藻酸钠固定化香菇纤维素酶的比较研究[J].江苏农业科学,2010(3):0351-0352.
[15]黄俊,官建国,袁润章.Fe3O4纳米复合粒子研究[J].复合材料学报,1999,16(4):35-39.
Immobilization and enzymological property of pectinase on the magnetic composite support
LIN Jian-cheng,CHEN Yue-li
(College of Environment&Biological Engineering,Putian University,Putian 351100,China)
The magnetic microspheres were prepared with Fe3O4magnetic nucleus and sodium alginate-gelatin. Pectinase was immobilized while magnetic microspheres were crosslinked with glutaraldehyde.The preparation conditions of immobilized pectinase were optimized through orthogonal experiments based on single factor,and the properties of immobilized enzyme were investigated.The results showed that Fe3O4magnetic nucleus could be made out when Fe2+(5mol/L)∶Fe3+(5mol/L)was 0.75∶1(volume ratio).When sodium alginate(3.5%)∶gelatin(3.0%)was 2.5∶1(volume ratio),the concentration of Fe3O4magnetic nucleus was 3.0 miligram per millilitre,crosslinked with volume fraction of 4.0%glutaraldehyde for 2.5 hours,and following mixed with 20 miligram pectinase per gram supporter,the process time was one hour,pH value for 4.0,the recovery rate of immobilized pectinase activity could reach to 78.69%.The optimum pH and optimum temperature of immobilized pectinase for the hydrolysis of pectin were determined to be pH4.0 and 50℃,respectively.The immobilized pectinase was stable in a pH range from 3.0 to 7.0 and at temperature 20~55℃.The apparent Michaelis constant of immobilized pectinase Kmappequaled to 3.162mg/mL.The relative activity of immobilized enzyme remained 51.0%after continuous use for ten times,and that of remaining 81%after stored ten days.The results indicated the immobilized pectinase prepared with composite support were good enough for the strength,the flexibility and the recovery rate,and had good operation stability.
magnetic composite support;pectinase;immobilization;properties of enzymology
TS201.1
A
1002-0306(2015)14-0220-06
10.13386/j.issn1002-0306.2015.14.037
2014-10-20
林建城(1966-),男,硕士,教授,主要从事生物化学、酶学与食品生物技术方面的研究。
福建省高校服务海西重点建设项目(2008HX02);福建省教育厅资助省属高校科研基金项目(JK2012046)。
