高压促进猪肉肌内脂肪氧化过程中脂肪氧化酶的作用
2015-11-07黄业传
黄业传,李 凤,严 成
(西南科技大学生命科学与工程学院,四川绵阳621010)
高压促进猪肉肌内脂肪氧化过程中脂肪氧化酶的作用
黄业传,李凤,严成
(西南科技大学生命科学与工程学院,四川绵阳621010)
为研究高压促进猪肉肌内脂肪氧化过程中脂肪氧化酶(Lipoxygenase,LOX)的作用,以去除LOX的猪背最长肌为原料,在其中加入事先从猪肉中提取的或外源LOX(大豆脂肪氧化酶),经600MPa、50℃或350MPa、20℃处理并经6d冷藏后,测定各样品高压处理和冷藏后LOX活性和TBARS值。结果表明:LOX对高压下肌内脂肪氧化的启动有重要作用,但其不会影响样品冷藏后的最终氧化状态(TBARS值);在高压处理后的冷藏中,LOX的作用不明显,主要以脂肪自动氧化为主,即使加入5倍浓度的外源LOX,也只引起样品最终TBARS值的少量增加。因此,高压促进猪肉肌内脂肪氧化中主要以自动氧化为主,而LOX的作用很小。
高压,猪肉,脂肪氧化,脂肪氧化酶
高压技术在食品中的应用始于100多年前,但当时由于设备等方面的限制并没有真正推广。直到上世纪90年代,欧美和日本等发达国家开始投入大量人力、物力和财力对高压技术进行研究。高压处理能在低温或常温下抑制或杀灭食品中有害微生物和酶,从而延长食品保质期;或改善食品的功能特性,如嫩度、凝胶特性等[1]。相比于传统的热处理,高压对食物营养和感官品质破坏更小,能最大限度保留食物的色、香、味和营养成分[2-4]。但高压处理也有对食品品质不利的地方,如一定压力下能加快肉中脂肪氧化,从而使肉品质败坏[5-7]。
压力诱导肌肉脂肪氧化的原因很多学者进行了研究,但结论并不一致,如可能与变性蛋白的协同作用[8]、高压下金属离子释放[9-11]、高压下酶活性变化[12]或细胞膜结构损坏有关[3,13-14]。存在这些争议的关键原因之一是高压促进肌内脂肪氧化中脂肪氧化酶(Lipoxygenase,LOX)的作用仍不清楚。氧化主要分为自动氧化和酶促氧化,高压下两者的关系无人研究过,但一些学者研究了干腌肉制品加工中两者的关系,如Zhou[15]、Huang[16]发现在金华火腿和烟熏腊肉生产中脂肪氧化主要是自动氧化。而Jin[17]发现干腌培根加工中LOX能显著促进脂肪氧化。Kühn[18]认为LOX催化脂肪氧化有一定的滞后性,而German[19]的观点则相反,认为内源LOX对脂肪氧化的启动极为重要,但在随后的加工中以自动氧化为主,Roozen[20]、Josephson[21]也证明了这一点。
一些芽孢菌在1000MPa的压力下仍很稳定,而压力结合一定温度的热处理对这些菌有较好的抑制效果,因而现在高压技术在肉品中的应用大多围绕高压结合一定的低温热处理进行。本文拟研究高压(350、600MPa)结合一定的热处理(20、50℃)对猪肉中LOX活性和脂肪氧化(TBARS值)的影响,并着重探讨两者的关系,以明确高压促进肌内脂肪氧化中LOX的作用。
1 材料与方法
1.1材料与仪器
白玉黑土猪由绵阳天农生态食品开发有限公司提供,共三头,同一批饲养,接近商品成猪的重量时宰杀,宰杀后取背最长肌,真空包装后于-18℃保藏待用;大豆脂肪氧化酶(酶活为50000U/mg)、亚油酸Sigma公司;其他药品均为国产分析纯。
HPP.L2超高压处理设备天津华泰森淼生物工程技术有限公司;FSH-2A匀浆机上海梅香仪器有限公司;5804R台式高速冷冻离心机德国Eppendorf公司;U-3900H分光光度计日本Hitachi公司;JYSA800绞肉机山东九阳电器有限公司。
1.2实验方法
1.2.1去LOX样品的准备参照靳国锋[22]的方法,样品先在4℃解冻24h,并去掉表面可见脂肪、筋膜及结缔组织,然后用三倍体积(v/w)的冷去离子水(4℃)清洗三次,清洗后加3倍体积(v/w)50mmol/L的磷酸钠缓冲液(pH7.4,4℃),并匀浆1min(10000r/min),匀浆结束后用塑料棒搅动2min并静置15min。然后在10000g、4℃条件下冷冻离心30min,离心结束后用3倍体积(v/w)50mmol/L磷酸钠缓冲液(pH7.4,4℃)使沉淀再次悬浮,并继续10000g条件下冷冻离心30min。重复悬浮、离心3次,最后一次所得沉淀即为去LOX肌肉,收集备用。
1.2.2LOX的提取和活性测定未去LOX的样品先在4℃解冻24h,去掉表面可见脂肪、筋膜及结缔组织,并用绞肉机绞碎;事先去LOX的样品直接按以下程序提取。LOX的提取参考Jin等的方法[17],并进行一定修改。称取一定量的碎肉,加入4倍体积的浓度为50mmol/L、pH7.4的磷酸钠缓冲溶液,该溶液中还含有浓度为1mmol/L的二硫苏糖醇(DTT)和乙二胺四乙酸(EDTA),然后用高速匀浆机在冰水浴中于15000r/min下匀浆4次,每次10s。经四层纱布过滤后,匀浆物在10000g、4℃条件下离心1h,然后得到的上清液经滤纸过滤后即为提取的LOX粗酶液。
亚油酸底物溶液的制备参考Gata等[23]的方法,将称量好的140mg亚油酸溶解在5mL脱氧重蒸水中,再加入180μL吐温20,然后用2mol/L的NaOH将溶液的pH调整到9.0,直到亚油酸完全溶解且pH保持稳定,然后用脱氧重蒸水定容至50mL,该溶液于低温、氮气环境中贮藏备用。
LOX的活性测定采用分光光度计法。量取0.2mL亚油酸底物溶液和2.9mL、浓度为50mmol/L、pH为5.5的柠檬酸缓冲溶液在20℃快速混合均匀,待其在234nm处吸光值稳定后,加入0.1mL酶溶液,迅速混合均匀后测定1min吸光度的增加量。对照样为0.2mL亚油酸底物溶液和3.0mL柠檬酸缓冲溶液(50mmol/L,pH为5.5)。1个酶活单位定义为每分钟每克蛋白中引起吸光度值增加0.001的酶量。
1.2.3TBARS值测定TBARS值的测定参考Siu[24]的方法,结果表示为mg MDA(丙二醛)/kg样品。
1.2.4样品处理为研究高压促进猪肉肌内脂肪氧化中LOX的作用,设计以下四组实验。
对照样猪肉:原料使用前在4℃解冻24h,并去掉表面可见脂肪、筋膜及结缔组织,用绞肉机绞碎并用聚乙烯塑料袋真空包装,共15袋,每袋50g左右。
去LOX样品,用聚乙烯塑料袋真空包装,共15袋,每袋50g左右。
去LOX的样品约750g,加入适量从猪背最长肌中提取的LOX溶液,使LOX在样品中的活性与对照样猪肉相当,达到8~9U,然后用聚乙烯塑料袋真空包装,共15袋,每袋50g左右。
去LOX的样品约750g,加入适量外源LOX(大豆LOX),使LOX在样品中的活性是对照样的5倍左右,达到40~45U,然后用聚乙烯塑料袋真空包装,共15袋,每袋50g左右。
预备实验发现在600MPa、50℃的条件下处理20min猪肉样品中的LOX会完全失活;前面的研究发现常温下350MPa是导致猪肉脂肪氧化加剧的关键压力点[25],而在此条件下LOX活性变化不大,因此本研究中选取600MPa、50℃和350MPa、20℃作为处理条件。以上四组样品,每组中的3袋准备好后马上测定其LOX活性;其余12袋分别平均分成两份,每份6袋,其中一份在350MPa、20℃条件下进行处理,另一份在600MPa、50℃进行处理,处理时间均为20min,高压处理以癸二酸二辛酯为压力传递介质。高压处理后,每份的6袋样品中3袋立即用来测定样品中LOX活性和TBARS值,另外3袋在0~4℃条件下避光透氧冷藏6d后测定LOX活性与TBARS值。
1.3统计分析
用SPSS13.0软件(SPSS Inc.,Chicago,Illinois,USA)作方差分析和多重比较,显著水平为0.05。
2 结果与分析
2.1高压处理和冷藏对样品中LOX活性的影响
结果如表1所示,高压处理前对照样(1、5组)、去LOX+提取的LOX(3、7组)样品中的LOX活性相当,而两组去LOX样品(第2、6组)未检出LOX活性,去LOX+外源LOX(4、8组)的两组中LOX活性较高,因为加入了原料中约5倍浓度的外源LOX。高压处理后,600MPa、50℃处理的样品,除了第8组还有少量酶活外,其余三组均已检不出酶活,说明肉中的LOX在600MPa、50℃处理20min会全部失活。Seyderhelm[26]与Heinisch[27]分别报道了LOX在缓冲溶液中经600MPa、45℃处理10min或在40℃处理30min会全部失活;Rodrigo[28]和Tedjo[29]也分别发现番茄和大豆中LOX的失活压力为550和570MPa,这些都与本研究的结论基本一致。
350MPa、20℃处理的样品保留较高酶活,其中对照样中酶活还升高了7.84%,说明有部分酶被激活,激活作用可能是部分酶在高压下从溶酶体中释放出来[30-31]或高压下酶的结构发生了有利于活性增加的变化[32]。第3和4组中酶活在高压处理后都有所下降但不显著,因此第1组中酶活升高可能主要是由于高压下酶从溶酶体中释放所致。一方面,压力下,酶会变性失活,另一方面溶酶体膜破坏后部分酶释放出来,因此酶活是增加还是减小取决于哪种因素占主导作用。350MPa、20℃下对照样酶活增加说明此时酶的释放占主导,第3、4组样品可能在去除LOX过程中溶酶体已破坏,进而在高压处理时溶酶体中无酶可释放,因此酶活有所降低。经过6d冷藏后,各样品中酶活都有所降低,第1、3和4组分别降低了15.97%、20.66%和26.15%,其中后两者的降低达到显著(p<0.05)水平,说明未经提取的肉样中的LOX在冷藏中更稳定,可能是其处于完整的肌肉结构中,肌肉成分对其有保护作用。
2.2350MPa处理和冷藏对样品脂肪氧化的影响
350MPa处理后各样品的TBARS值如图1所示,可以看出,去LOX的样品TBARS值显著(p<0.05)低于其他组,其他组都含有内源或外源的LOX,因此可推测LOX对高压下脂肪氧化启动有重要作用。可能是由于脂肪氧化主要分为自动氧化和酶促氧化,自动氧化需要有一个中间过程,启动相对较慢;而酶促氧化启动较迅速,其启动后,生成的一些氧化产物和游离基可迅速带动自动氧化,因此可使整个脂肪氧化的进度加快。去LOX的样品中没有LOX,因此完全是自动氧化,由于自动氧化启动较慢,因此处理结束时其TBARS值显著(p<0.05)低于其他三组。去LOX+外源LOX的样品TBARS值最高,比对照样高出11.29%,但差异不显著;而比去LOX+提取的LOX的样品高出39.86%,差异显著(p<0.05)。可能是去LOX+外源LOX的样品中加入了高浓度的(原料中的5倍)外源LOX,而LOX对脂肪氧化启动有重要作用,因此其脂肪氧化的速度更快。

图1 350MPa处理后各样品TBARS值Fig.1 The TBARS values of samples following pressure treatment of 350MPa
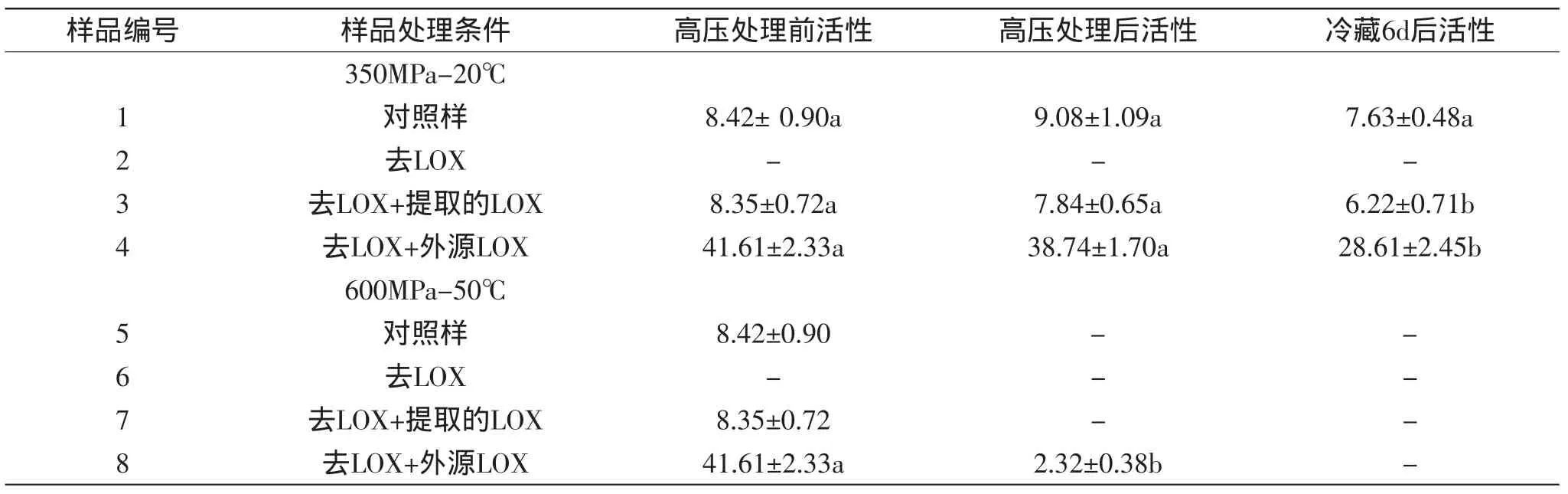
表1 高压处理和冷藏对各样品LOX活性的影响(n=3)Table 1 Effect of high-pressure treatment and cold-storage on the activity of LOX in samples(n=3)
350MPa处理的样品经6d冷藏后TBARS值如图2所示,刚经高压处理后,去LOX组的TBARS值显著(p<0.05)低于去LOX+提取的LOX组(图1),而经过6d冷藏后,两者并无显著差异,这说明LOX虽然对脂肪氧化启动有重要作用,但不会影响贮藏后样品最终的TBARS值,对样品最终TBARS值起决定作用的是自动氧化。可能是由于酶促氧化对底物的专一性较强,且需要酶与底物接触时才能发生反应,而自动氧化一旦启动后速度较快;也可能是由于后期自动氧化对酶促氧化的抑制作用,因为生成的大量氢过氧化物会氧化LOX的巯基而使其失活[33],LOX失活后,其分子中所含的铁离子释放出来,反而又会加速自动氧化[34]。经6d冷藏后,去LOX+提取的LOX组显著(p<0.05)低于对照组,可能是由于LOX提取过程中,一些水溶性的助氧化物质比如金属离子发生了部分损失;而在处理后两者没有显著差异(图1),可能是处理时间较短,损失的水溶性成分不足以造成显著影响,而且启动阶段自动氧化的作用也不及贮藏阶段,启动阶段LOX发挥了重要作用。加提取LOX组的TBARS值显著(p<0.05)低于加外源LOX组,可能是由于高浓度的外源脂肪酶引起的脂肪氧化;加外源LOX的样品冷藏中LOX活性几乎是加提取LOX组的5倍,但最终TBARS值只比其高36.48%,说明TBARS值的增加程度与加入的LOX浓度不呈比例,因此冷藏中起主要作用的仍是自动氧化。加外源LOX组与对照组没有显著差异可能是由于一方面前者中高浓度的LOX增加了脂肪氧化,但同时样品在去LOX过程中部分助氧化物质损失掉,两相抵消了。
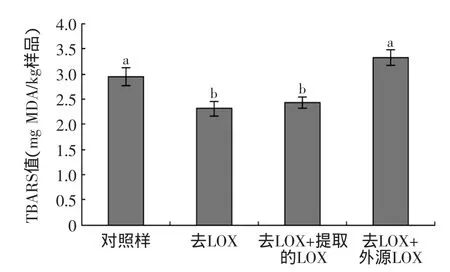
图2 350MPa处理样品经6d冷藏后的TBARS值Fig.2 The TBARS values of samples after 6 day cold-storage following pressure treatment of 350MPa
2.3600MPa处理和冷藏对样品脂肪氧化的影响
600MPa、50℃处理后各样品的TBARS值如图3所示,可以看出,与350MPa处理时类似,去LOX的样品中TBARS值低于其他组,但与去LOX+提取的LOX和对照样差异不显著,而350MPa时去LOX的样品显著低于另外两组,可能是因为600MPa、50℃下LOX迅速失活,因此发挥作用的时间较短,不及350MPa处理明显。同样,去LOX+外源LOX的样品处理后TBARS值最高,可能是加入的酶浓度越高失活所需的时间也更长,到高压处理结束时仍保留有部分LOX活性(5.58%),因此LOX对脂肪氧化的启动更明显。

图3 600MPa处理后各样品TBARS值Fig.3 The TBARS values of samples following pressure treatment of 600MPa
600MPa、50℃处理样品经6d冷藏后的TBARS值如图4,可以看出,虽然对照样的TBARS值高于其他三组,但差异不显著,对照样中TBARS值稍高可能是由于去除LOX过程中一些助氧化物质的损失。350MPa处理时,加入外源LOX的样品冷藏后TBARS值最高,而600MPa处理后,加入外源LOX的样品TBARS值低于对照样,可能是由于600MPa、50℃条件下加入的外源LOX几乎全部失活,因此在冷藏中发挥作用的LOX较少,而350MPa处理的样品中残留的LOX活性较高,因此冷藏中发挥作用的LOX也较多。

图4 600MPa处理样品经6d冷藏后的TBARS值Fig.4 The TBARS values of samples after 6 day cold-storage following pressure treatment of 600MPa
高压促进肌肉肌内脂肪氧化中自动氧化和酶促氧化的关系还无人作过报道,但很多学者对肉品加工中脂肪自动氧化和酶促氧化的关系作了研究,Zhou[15]、Huang[16]分别报道在金华火腿和烟熏腊肉生产中自动氧化作用更大,这与本研究的结论是一致的;而Jin[17]发现在干腌培根加工中LOX能显著促进脂肪氧化。关于LOX的作用,German[19]认为内源LOX对脂肪氧化启动极为重要,但在随后的加工中自动氧化占优,Roozen[20]和Josephson[21]利用模型系统也证明了这一点,发现若LOX在开始阶段失活,脂肪氧化初速度会减慢,但总的氧化程度不会降低,这与本研究的结论一致,但Kühn[18]报道的结论相反,认为LOX在催化脂肪氧化中具有一定的滞后性,因为LOX中所含的Fe2+转变为Fe3+后LOX才有活性,而Fe2+向Fe3+的转变需要在脂肪酸氢过氧化物的作用下才能产生。
3 结论
3.1600MPa、50℃处理时猪肉中LOX全部失活,而350MPa、20℃处理对LOX活性没有显著影响,甚至存在部分激活作用;LOX在6d冷藏过程中较稳定。
3.2LOX对脂肪氧化的启动有重要作用,但其不会对产品冷藏后的最终TBARS值产生显著影响,冷藏中以自动氧化为主。
3.3样品中加入高浓度外源LOX会在一定程度上促进高压下的脂肪氧化,但对TBARS值的提高与加入的酶浓度不呈正比。
3.4高压促进肌内脂肪氧化过程中,脂肪氧化主要以自动氧化为主,LOX的作用十分有限。
[1]马汉军.高压和热结合处理对僵直后牛肉品质的影响[D].南京:南京农业大学,2004.
[2]Cheftel J C,Culioli J.Effects of high pressure on meat:A review[J].Meat Science,1997,46:211-236.
[3]Orlien V,Hansen E,Skibsted L H.Lipid oxidation in highpressure processed chicken breast muscle during chill storage:critical working pressure in relation to oxidation mechanism[J]. European Food Research and Technology,2000,211:99-104.
[4]Torres J A,Velazquez G.Commercial opportunities and research challenges in the high pressure processing of foods[J]. Journal of Food Engineering,2005,67:95-112.
[5]Angsupanich K,Ledward D A.High pressure treatment effects on cod(Gadus morhua)muscle[J].Food Chemistry,1998,63:39-50.
[6]Cheah P B,Ledward D A.High pressure effects on lipid oxidation in minced pork[J].Meat Science,1996,43:123-134.
[7]CHeah P B,Ledward D A.High-pressure effects on lipid oxidation[J].Journal of the American Oil Chemists’Society,1995,72:1059-1063.
[8]Tanaka M,Xueyi Z,Nagashima Y,et al.Effect of High Pressure on the Lipid Oxidation in Sardine Meat[J].Nippon Suisan Gakkaishi,1991,57:957-963.
[9]Gray J I,Pearson A M.Rancidity and warmed-over flavour[J].Advanced Meat Research,1987,3:221-269.
[10]Beltran E,Pla R,Yuste J,et al.Use of antioxidants to minimize rancidity in pressurized and cooked chicken slurries[J]. Meat Science,2004,66:719-725.
[11]CHeah P B,Ledward D A.Catalytic mechanism of lipid oxidation following high pressure treatment in pork fat and meat[J].Journal of Food Science,1997,62:1135-1138.
[12]Huang Y,He Z,Li H,et al.Effect of antioxidant on the fatty acid composition and lipid oxidation of intramuscular lipid in pressurized pork[J].Meat Science,2012,91:137-141.
[13]Beltran E,Pla R,Yuste J,et al.Lipid oxidation of pressurized and cooked chicken:role of sodium chloride and mechanical processing on TBARS and hexanal values[J].Meat Science,2003,64:19-25.
[14]Kato M,Hayashi R.Effects of high pressure on lipids and biomembranes for understanding high-pressure-induced biological phenomena[J].Bioscience,Biotechnology and Biochemistry,1999,63:1321-1328.
[15]Zhou G H,Zhao G M.Biochemical changes during processing of traditional Jinhua ham[J].Meat Science,2007,77:114-120.
[16]Huang Y,Li H,Huang T,et al.Lipolysis and lipid oxidation during processing of Chinese traditional smoke-cured bacon[J]. Food Chemistry,2014,149:31-39.
[17]Jin G,Zhang J,Yu X,et al.Lipolysis and lipid oxidation in bacon during curing and drying-ripening[J].Food Chemistry,2010,123(2):465-471.
[18]Kühn H,Borchert A.Regulation of enzymatic lipid peroxidation:the interplay of peroxidizing and peroxide reducing enzymes[J].Free Radical Biology and Medicine,2003,33:154-172.
[19]German J B,Kinsella J E.Lipid oxidation in fish tissue. Enzymic initiation via lipoxygenase[J].Journal of Agriculture and Food Chemistry,1985,33:680-683.
[20]Roozen J P,Frankel E N,Kinsella J E.Enzymic and autoxidation of lipids in low fat foods:model of linoleic acid in emulsified hexadecane[J].Food Chemistry,1994,50:33-38.
[21]Josephson D B,Lindsay R C,Stuiber D A.Enzymic Hydroperoxide Initiated Effects in Fresh Fish[J].Journal of Food Science,1987,52:596-600.
[22]靳国锋.干腌培根加工过程中脂质氧化调控机制研究[D].南京:南京农业大学,2011.
[23]Gata J L,Pinto M C,Macías P.Lipoxygenase activity in pig muscle:purification and partial characterization[J].Journal of Agricultural and Food Chemistry,1996,44:2573-2577.
[24]Siu G M,Draper H H.A survey of malonaldehyde content of retail meats and fish[J].Journal of Food Science,1978,43:1147-1149.
[25]He Z,Huang Y,Li H,et al.Effect of high-pressure treatment on the fatty acid composition of intramuscular lipid in pork[J]. Meat Science,2012,90:170-175.
[26]Seyderhelm I,Boguslawski S,Michaelis G,et al.Pressure induced inactivation of selected food enzymes[J].Journal of Food Science,1996,61:308-310.
[27]Heinisch O,Kowalski E,Goossens K,et al.Pressure effects on the stability of lipoxygenase:Fourier transform-infrared spectroscopy(FT-IR)and enzyme activity studies[J].Z Lebensm Unters Forsch,1995,201:562-565.
[28]Rodrigo D,Jolie R,Van Loey A,et al.Thermal and high pressure stability of tomato lipoxygenase and hydroperoxide lyase[J].Journal of Food Engineering,2007,79:423-429.
[29]Tedjo W,Eshtiaghi M N,Knorr D.Impact of supercritical carbon dioxide and high pressure on lipoxygenase and peroxidase activity[J].Journal of Food Science,2000,65:1284-1287.
[30]Homma N,Ikeuchi Y,Suzuki A.Effect of high pressure treatmentonproteolyticsysteminmeat[J].Progressin Biotechnology,1996,13:327-330.
[31]Lakshmanan R,Patterson M F,Piggott J R.Effects of highpressure processing on proteolytic enzymes and proteins in coldsmoked salmon during refrigerated storage[J].Food Chemistry,2005,90:541-548.
[32]Terefe N S,Yang Y H,Knoerzer K,et al.High pressure and thermal inactivation kinetics of polyphenol oxidase and peroxidase in strawberry puree[J].Innovative Food Science and Emerging Technologies,2010,11:52-60.
[33]Kuo J,Pan B S,Zhang H,et al.Identification of 12-lipoxygenase in the hemolymph of tiger shrimp(Penaeus japonicus Bate)[J].Journal of Agriculture and Food Chemistry,1994,42:1620-1623.
[34]Kuribayashi T,Kaise H,Uno C,et al.Purification and characterization of lipoxygenase from Pleurotus ostreatus[J]. Journal of Agriculture and Food Chemistry,2002,50:1247-1253.
Effect of lipoxygenase on the intramuscular lipid oxidation in pork due to high pressure treatment
HUANG Ye-chuan,LI Feng,YAN Cheng
(College of Life Science and Engineering,Southwest University of Science and Technology,Mianyang 621010,China)
To investigate the effect of lipoxygenase(LOX)on the intramuscular lipid oxidation in pork due to high pressure treatment,porcine longissimus muscle which had been removed of LOX was used as material,after addition of some LOX extracted from fresh porcine longissimus muscle or exogenous LOX(from soybean),the samples were treated at 600MPa-50℃ or 350MPa-20℃ before 6 days storage at 4℃,then the activities of LOX and TBARS values in all samples after high pressure treatment and after cold storage were analyzed.The results showed that LOX had important role on the start-up of intramuscular lipid oxidation due to high pressure treatment,but it had no effect on the last oxidation state(TBARS value)of chilled samples.During cold storage after high pressure treatment,the lipid oxidation was mainly the auto-oxidation,and the role of LOX was very limited,even 5 times of exogenous LOX was added,the TBARS value of the chilled samples only increased a little.So the role of LOX on the intramuscular lipid oxidation in pork due to high pressure treatment was very limited compared to auto-oxidation.
high pressure;pork;lipid oxidation;lipoxygenase
TS251.1
A
1002-0306(2015)14-0147-05
10.13386/j.issn1002-0306.2015.14.022
2014-10-20
黄业传(1975-),男,博士,副教授,研究方向:肉制品食品加工与酶工程。
国家自然科学基金资助项目(31271892)。
