杨梅蛋白酶解肽抗氧化及降血糖活性的稳定性研究
2015-11-07张一帆吴莉宇章程辉
张一帆,王 强,王 伟,吴莉宇,张 玉,章程辉
(1.海南大学食品学院,海南海口570228;2.浙江省农业科学院农产品质量与标准研究所,农业部农产品质量安全风险评估实验室(杭州),浙江省食品安全重点实验室,浙江省植物有害生物防控省部共建国家重点实验室培育基地,浙江杭州310021)
杨梅蛋白酶解肽抗氧化及降血糖活性的稳定性研究
张一帆1,2,王强1,2,王伟2,吴莉宇2,张玉2,章程辉1,*
(1.海南大学食品学院,海南海口570228;2.浙江省农业科学院农产品质量与标准研究所,农业部农产品质量安全风险评估实验室(杭州),浙江省食品安全重点实验室,浙江省植物有害生物防控省部共建国家重点实验室培育基地,浙江杭州310021)
以杨梅蛋白酶解肽为研究对象,考察其相对分子量分布范围,并以DPPH自由基清除活性和α-葡萄糖苷酶抑制活性为指标,分别研究了温度、pH、糖、防腐剂和金属离子等5个因素对杨梅蛋白酶解肽抗氧化及降血糖活性的影响。结果表明,杨梅蛋白酶解肽分子量范围在118.9~4552.2u,且杨梅蛋白酶解肽有较强的热稳定性及耐酸性,而在碱性条件下,抗氧化活性丧失较快而降血糖活性略微上升;糖类能显著增加其抗氧化活性,增加顺序为:葡萄糖>乳糖>蔗糖;苯甲酸和NaCl对其抗氧化活性影响及苯甲酸对其降血糖活性影响都不显著(p>0.05),而NaCl在1.5%~2%范围内促进了降血糖活性;Cu2+和Zn2+均能降低抗氧化及降血糖活性,而Mg2+和K+对抗氧化活性影响不显著(p>0.05),但Mg2+对降血糖活性有较小增强作用,K+影响不显著(p>0.05)。
杨梅,杨梅蛋白酶解肽,抗氧化,降血糖,稳定性
杨梅(Myrica rubra Sieb.et Zucc)是杨梅科杨梅属的亚热带多年生常绿乔木果实,水分含量87.1%~ 90.9%,总糖含量为9.1%,蛋白质含量在0.14%~0.34%[1-3]。《本草纲目》中记载:“杨梅味酸甜、性温、无毒,能止渴、和五脏、涤肠胃、除烦溃恶气”。目前针对杨梅功能活性的研究集中于其酚类化合物[4-5],而杨梅蛋白组分酶解肽的活性研究较为少见。生物酶解肽通常用蛋白酶解法来制备[6],其主要由大量的不同α-氨基酸和肽键组成,在220nm处有最大光吸收。因其特有的分子结构而极易在加工制备和贮藏过程中的不利因素影响下,发生消旋化、脱酰化、链裂解及重排等,而发生降解[7]。因此研究加工和贮藏过程外在因素对酶解肽稳定性的影响是十分必要的。目前已有大量酶解肽抗氧化活性的稳定性研究,Chao-Zhi Zhu等[8]研究得出金华火腿酶解肽在NaCl添加量小于6%,温度低于60℃时具备稳定的抗氧化活性。Shiyuan Dong等[9]研究得出β-乳球蛋白酶解肽和葡萄糖发生美拉德反应后能提高DPPH自由基清除活性、总抗氧化活性和铁离子的螯合能力。但有关蛋白酶解肽在降血糖活性稳定性方面的研究少见报道。
本文采用碱溶酸沉法提取杨梅中蛋白组分,先后采用胃蛋白酶和胰蛋白酶获取杨梅蛋白酶解肽,并考察其相对分子量分布范围,选用温度、pH、糖、防腐剂和金属离子5个影响因素,以清除DPPH自由基活性保持率和抑制α-葡萄糖苷酶活性保持率为指标,对杨梅蛋白酶解肽的抗氧化及降血糖活性的稳定性进行研究。
1 材料与方法
1.1材料与仪器
杨梅购于杭州文辉大桥水果批发市场并选用新鲜成熟的“东魁杨梅”品种;胃蛋白酶(3000U/g)、胰蛋白酶(10000U/g) 中国医药(集团)上海化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(DPPH,>97%)、4-硝基苯基-α-D-呋喃葡萄糖苷(PNPG,>99%)、α-葡萄糖苷酶(Intestinal acetone powders from rat)美国sigma公司;K2SO4、MgSO4、ZnSO4、CuSO4、Na2CO3、无水乙醇(≥99.7%)分析纯,上海凌峰化学试剂有限公司;HCl、NaOH分析纯,西陇化工股份有限公司;杆菌酶、乙氨酸-乙氨酸-酪氨酸-精氨酸德国Serva公司;细胞色素C、抑肽酶、乙氨酸-乙氨酸-乙氨酸上海源叶生物科技有限公司。
1500型全波长酶标仪美国Thermo公司;210 Plus双光束紫外可见分光光度计德国Analylik Jena公司;pH计梅特勒-托利多仪器有限公司;MW<5ku分子量截留管Thermo Fisher Scientific公司;EZ-2真空浓缩工作站美国Genevac公司;B-260型恒温水浴锅上海亚荣生化仪器厂;2690高效液相色谱仪、2996二极阵列检测器美国Waters公司。
1.2实验方法
1.2.1杨梅粗蛋白的提取及酶解肽的制备杨梅果实→去核打浆→按料液比1∶10加入蒸馏水→调pH为10,37℃摇床4h→浓缩过滤→调pH为2→离心得杨梅粗蛋白。并准确称取10g杨梅粗蛋白,参照钱方等[10]和龚丽芬等[11]的酶解工艺条件,按料液比1∶10加入蒸馏水→调pH为2,加5%胃蛋白酶→37℃摇床4h→调pH为8,加5%胰蛋白酶→37℃摇床4h→沸水浴10min→离心取上清液→用5ku截留管截留,滤液为实验样品(以下简称杨梅蛋白酶解肽),备用。
1.2.2杨梅蛋白酶解肽分子量的测定方法参照GB/T 22729-2008海洋鱼低聚肽粉附录A(高效凝胶过滤色谱法)[12]和陈季旺等[13]的测定方法,测定杨梅蛋白酶解肽的分子量。高效液相色谱仪:Waters 2690,检测器:Waters 2996二极阵列检测器;色谱柱:TSKge G2000 SWXL 300mm×7.8mm;流动相:乙腈-水-三氟乙酸(45∶55∶0.1,V/V);检测波长:220nm;柱温:30℃;流速:0.5mL/min。选取细胞色素C(MW=12500u)、抑肽酶(MW=6500u)、杆菌酶(MW=1450u)、乙氨酸-乙氨酸-酪氨酸-精氨酸(MW=451u)、乙氨酸-乙氨酸-乙氨酸(MW=189u)为相对分子量校正曲线所用标准品,以出峰时间为横坐标,以分子量的对数值(lg)为纵坐标做标准曲线,并测取杨梅蛋白酶解肽的分子量范围。
1.2.3杨梅蛋白酶解肽对DPPH自由基清除活性的测定参照Xican Li等[14]的测定方法,取2mL DPPH溶液(1×10-4mol/L,用无水乙醇配制)和0.1mL不同处理后的杨梅蛋白酶解肽溶液,加入同一试管中,漩涡混匀室温避光30min后,于517nm下测吸光值A样品,并以等体积无水乙醇代替DPPH溶液做空白组测吸光值A空白,以等体积蒸馏水代替样品溶液做对照组测吸光值A对照,用等体积无水乙醇和蒸馏水混合液空白调零。平行测定三次取平均值,计算处理组清除率S1。
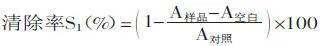
同时计算杨梅蛋白酶解肽未处理组对DPPH自由基的清除率S2,蒸馏水替代杨梅蛋白酶解肽做不同处理后对DPPH自由基的清除率S对照D,计算DPPH自由基活性保持率ηD:
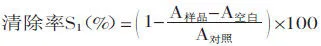
1.2.4杨梅蛋白酶解肽对α-葡萄糖苷酶抑制活性的测定参照Raju等[15]和Ashley等[16]的测定方法,取50μL不同处理后的杨梅蛋白酶解肽溶液,对照组用缓冲液代替。加入100μL 5mg/mL的α-葡糖糖苷酶溶液于37℃水浴10min后,加入50μL 5mmol/L的pNPG溶液,样品空白组和对照空白组用缓冲液代替,于37℃水浴30min,加入50μL 0.67mol/L的Na2CO3溶液终止反应。利用酶标仪测定405nm处吸光值,计算处理组抑制率S3。

同时计算杨梅蛋白酶解肽未处理组对α-葡萄糖苷酶活性的抑制率S4,蒸馏水替代杨梅蛋白酶解肽做不同处理后对α-葡萄糖苷酶活性的抑制率S对照α,计算抑制α-葡萄糖苷酶活性保持率ηα:

1.2.5温度对杨梅蛋白酶解肽抗氧化及降血糖活性的影响分别取杨梅蛋白酶解肽5mL,并在25、40、60、80、100℃水浴中加热处理1h,冷却至室温后定容至5mL,测其对DPPH自由基清除活性和α-葡萄糖苷酶抑制活性保持率。
1.2.6pH对杨梅蛋白酶解肽抗氧化及降血糖活性的影响用1mol/L的HCl和NaOH将杨梅蛋白酶解肽分别调pH至3~10,室温静置1h,同时用蒸馏水替代样品做对照。然后再将各组pH调回至7,测对DPPH自由基清除活性和α-葡萄糖苷酶抑制活性的保持率。
1.2.7不同糖对杨梅蛋白酶解肽抗氧化及降血糖活性的影响用杨梅蛋白酶解肽分别配制不同质量分数(2%、4%、6%、8%、10%)的葡萄糖、蔗糖和乳糖溶液,同时用蒸馏水替代样品做对照。将处理好的杨梅蛋白酶解肽溶液在100℃加热处理60min后,快速冷却至25℃,测DPPH自由基清除活性和α-葡萄糖苷酶抑制活性的保持率。
1.2.8防腐剂对杨梅蛋白酶解肽抗氧化及降血糖活性的影响用杨梅蛋白酶解肽分别配制不同质量分数(0.004%、0.008%、0.012%、0.016%和0.020%)的苯甲酸溶液和(0.5%、1.0%、1.5%和2.0%)NaCl溶液,同时用蒸馏水替代样品做对照。室温静置1h后,测DPPH自由基清除活性和α-葡萄糖苷酶抑制活性的保持率。
1.2.9不同金属离子对杨梅蛋白酶解肽抗氧化及降血糖活性的影响用杨梅蛋白酶解肽分别配制不同浓度(1、2、3、4、5mmol/L)的K2SO4、MgSO4、ZnSO4和CuSO4溶液,同时用蒸馏水替代样品做对照。静置2h后,测DPPH自由基清除活性和α-葡萄糖苷酶抑制活性的保持率。
1.3数据统计
所有实验数据均进行三次重复,实验结果以平均值±标准偏差(SD)表示。实验结果采用SPSS 16.0软件分析,通过One-way ANOVA检验中的邓肯多重范围检验来比较其组间差异显著性,显著性水平设置为p<0.05。
2 结果与分析
2.1杨梅蛋白酶解肽的相对分子量分布
5种标准样品的相对分子量分布液相色谱图如图1所示,以出峰时间为横坐标,以分子量的对数值(lg)为纵坐标做标准曲线如图2,得标准曲线方程为Y=-0.1804X+6.9425,R2=0.9442,并测得杨梅蛋白酶解肽的分子量分布范围为118.9~4552.2u。
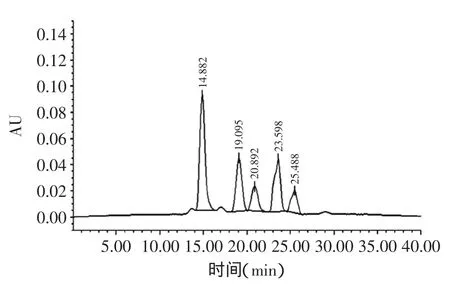
图1 5种标准样品的相对分子量分布液相色谱图Fig.1 The HPLC of relative molecular mass distribution of five standard sample
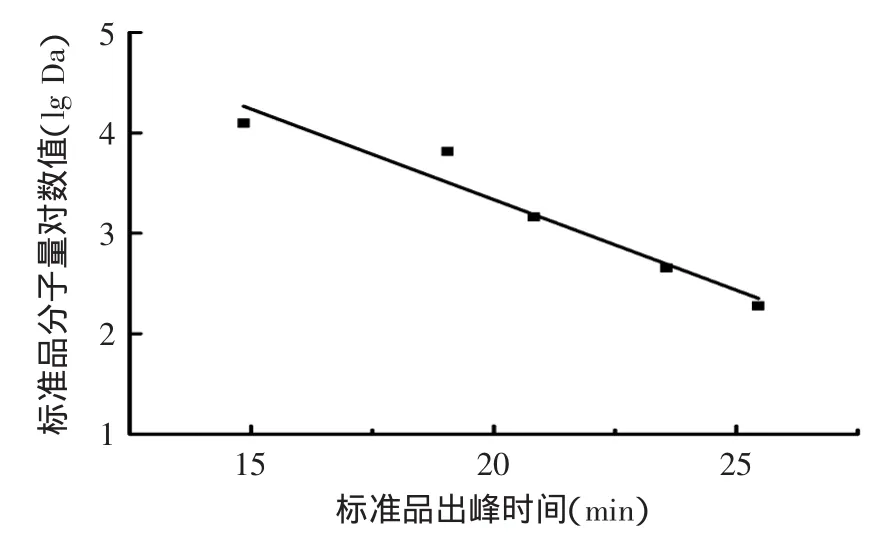
图2 相对分子量标准曲线Fig.2 The standard curve of relative molecular mass
2.2温度对杨梅蛋白酶解肽抗氧化及降血糖活性的影响
由图3所示,在25~100℃范围内,温度对杨梅蛋白酶解肽的抗氧化及降血糖活性影响均不显著(p>0.05),活性保持率都基本维持在100%左右,表明杨梅蛋白酶解肽有较强的热稳定性。
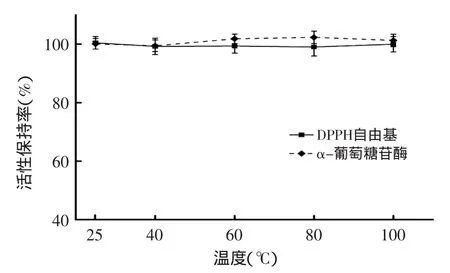
图3 温度对杨梅蛋白酶解肽抗氧化及降血糖活性的影响Fig.3 The influence of temperature on antioxidant and hypoglycemic activity of Myrica rubra peptide
2.3pH对杨梅蛋白酶解肽抗氧化及降血糖活性的影响
如图4所示,杨梅蛋白酶解肽随着pH的升高,清除DPPH自由基活性保持率总体呈现出先升后降的趋势,在pH3~5的酸性环境中,杨梅蛋白酶解肽可能部分变性导致抗氧化活性降低,但酸性环境为水解后肽段提供了大量氢供体,使得杨梅蛋白酶解肽DPPH自由基清除活性保持率仍在95%以上;在pH6~7时,DPPH自由基清除能力最强;当随着pH的继续升高,碱性条件使得杨梅蛋白酶解肽上的氨基等酸性基团解离出质子[17],与环境中羟基结合生成水,从而减少了提供氢供体能力,使得DPPH自由基清除活性保持率呈下降趋势。游丽君等[18]还认为这与碱性条件下杨梅蛋白酶解肽发生脱酰胺和消旋等作用有关,当pH=10时,DPPH自由基清除活性保持率为88%。而杨梅蛋白酶解肽随着pH的升高,对α-葡萄糖苷酶活性抑制能力呈现出先稳定后上升的趋势,可以看出当pH>7时,杨梅蛋白酶解肽在碱性条件下,肽链末端的α-氨基和其他侧链基团发生解离,使得蛋白质带负电,从而具备更优的抑制α-葡萄糖苷酶活性抑制能力[19]。
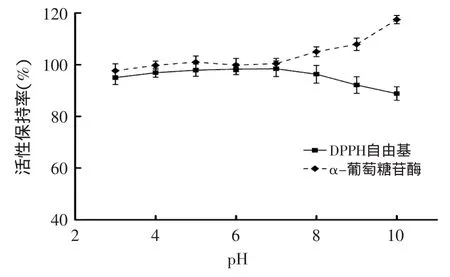
图4 pH对杨梅蛋白酶解肽抗氧化及降血糖活性的影响Fig.4 The influence of pH values on antioxidant and hypoglycemic activity of Myrica rubra peptide
2.4不同糖对杨梅蛋白酶解肽的抗氧化及降血糖活性影响
如图5所示,三种糖均对杨梅蛋白酶解肽清除DPPH自由基能力有所加强,加强顺序为葡萄糖>乳糖>蔗糖,且2%~10%浓度范围内,不同糖对抗氧化活性保持率影响差异显著(p<0.05),当葡萄糖、乳糖和蔗糖浓度达到10%时,DPPH自由基清除活性保持率分别达到空白样品的1.34、1.30和1.09倍,这一结果与杨梅蛋白酶解肽和糖发生美拉德反应密切相关,羰氨反应消耗杨梅蛋白酶解肽上的氨基,使得大量H+处于游离态,增加了自由基的氢供体,还有一系列中间体还原酮的生成,也提高了对DPPH自由基的捕获,从而增加了杨梅蛋白酶解肽的抗氧化活性[20]。在清除DPPH自由基能力中,葡萄糖>乳糖>蔗糖的影响结果也符合糖类影响美拉德反应速度的规律,即单糖>双糖,还原性糖>非还原性糖。
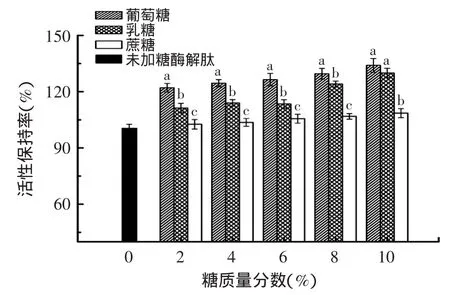
图5 不同糖对杨梅蛋白酶解肽抗氧化活性的影响Fig.5 The influence of different saccharides on antioxidant activity of Myrica rubra peptide
图6表示了杨梅蛋白酶解肽经葡萄糖和蔗糖处理,及葡萄糖和蔗糖本底溶液对α-葡萄糖苷酶抑制率的比较。可以看出在降血糖反应体系中:
对硝基苯-α-D-葡萄糖苷(PNPG)α-葡萄糖苷——→酶对硝基苯酚(PNP)+葡萄糖
杨梅蛋白酶解肽经葡萄糖和蔗糖(水解产生葡萄糖)的处理,增加了反应产物的量,抑制了上述反应体系的进行,导致对硝基苯酚(PNP)的量减少,从而使得吸光值降低,表现出了葡萄糖和蔗糖本底溶液的降血糖活性。因此,这并不能直观表现出葡萄糖和蔗糖对杨梅蛋白酶解肽降血糖活性的影响;而杨梅蛋白酶解肽中乳糖的添加对α-葡萄糖苷酶活性抑制能力并未有显著影响,随着浓度的升高,抑制率保持在57.2%~59.8%,而乳糖本底溶液未体现出降血糖活性。
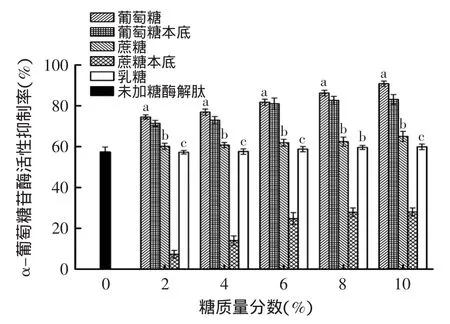
图6 不同糖对杨梅蛋白酶解肽降血糖活性的影响Fig.6 The influence of different saccharides on hypoglycemic activity of Myrica rubra peptide
2.5防腐剂对杨梅蛋白酶解肽的抗氧化及降血糖活性影响
NaCl和苯甲酸对杨梅蛋白酶解肽的抗氧化及降血糖活性影响分别如图7和图8所示,可以看出,随着NaCl和苯甲酸浓度的升高,对DPPH自由基的清除能力都无显著性差异(p>0.05)。但当NaCl浓度大于1.5%时,杨梅蛋白酶解肽对抑制α-葡萄糖苷酶活性保持率略微升高,且各浓度苯甲酸的添加对α-葡萄糖苷酶活性抑制能力影响不显著(p>0.05),而NaCl对人体安全无毒、代谢无残留,因此,在杨梅蛋白酶解肽的储藏运输中,加入低剂量的NaCl作为防腐剂是可行的。
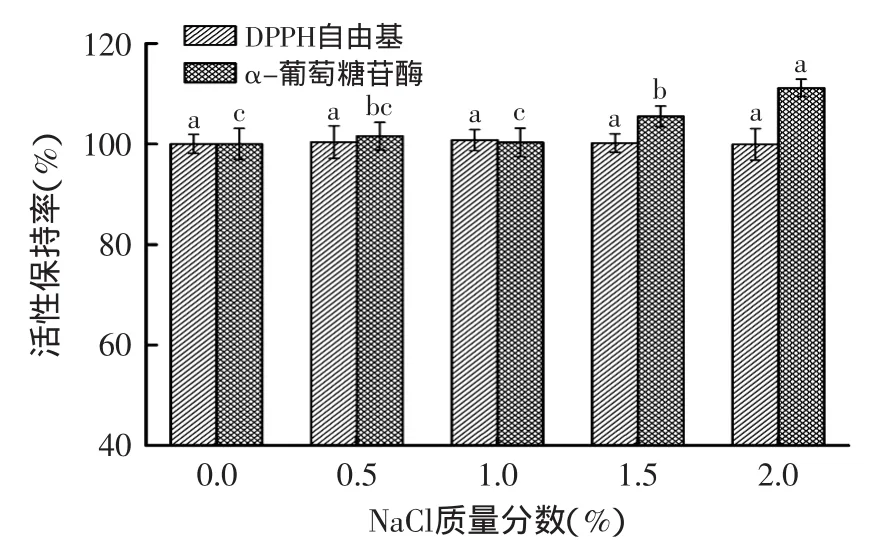
图7 NaCl对杨梅蛋白酶解肽抗氧化及降血糖活性的影响Fig.7 The influence of NaCl on antioxidant and hypoglycemic activity of Myrica rubra peptide
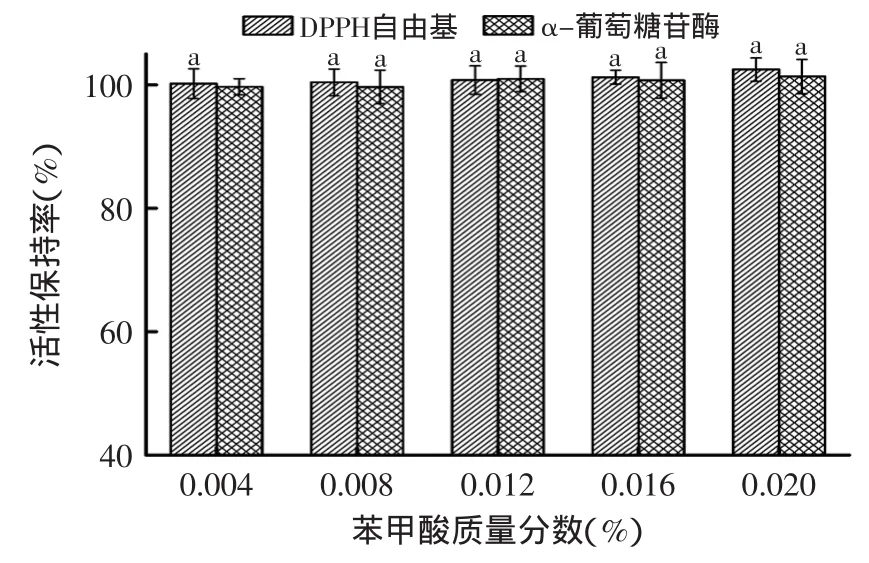
图8 苯甲酸对杨梅蛋白酶解肽抗氧化及降血糖活性的影响Fig.8 The influence of benzoic acid on antioxidant and hypoglycemic activity of Myrica rubra peptide
2.6不同金属离子对杨梅蛋白酶解肽抗氧化及降血糖活性的影响
如图9、图10所示,不同金属离子对杨梅蛋白酶解肽抗氧化及降血糖的活性影响均有不同,对清除DPPH自由基的活性保持率和α-葡萄糖苷酶抑制活性保持率由高到低都依次为Mg2+>K+>Zn2+>Cu2+。就清除DPPH自由基的活性而言,随着Mg2+和K+浓度的升高,活性保持率趋于平稳,分别达到98.1%和97.1%以上;而Zn2+和Cu2+对活性保持率有明显降低趋势,当浓度达到5mmol/L时,Zn2+和Cu2+使杨梅蛋白酶解肽清除DPPH自由基的活性保持率下降至80.9%和78.7%。
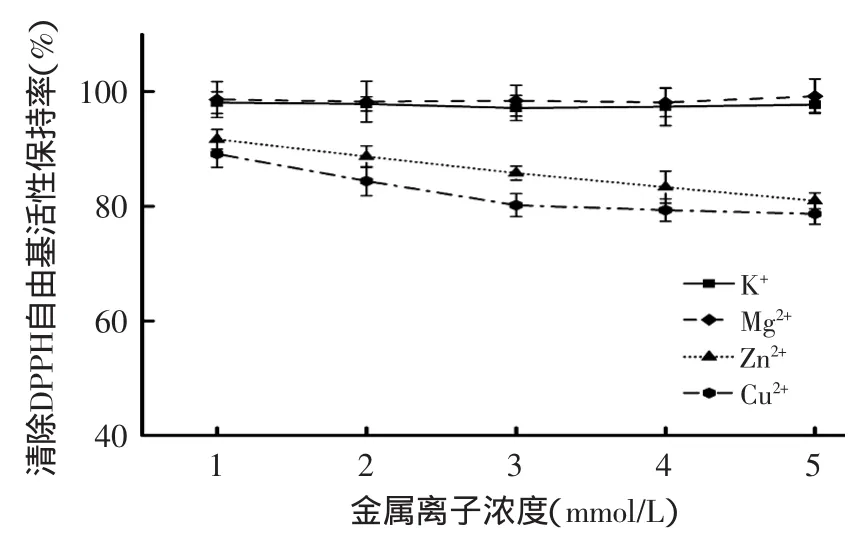
图9 金属离子对杨梅蛋白酶解肽抗氧化活性的影响Fig.9 The influence of different metal ions on antioxidant activity of Myrica rubra peptide
而对α-葡萄糖苷酶抑制活性保持率而言,随着金属离子浓度的升高,K+对其影响均不显著,而Mg2+的添加使得活性保持率略微上升,这表明杨梅蛋白酶解肽与Mg2+可能发生螯合作用,Mg2+起到桥梁作用,增加了对α-葡萄糖苷酶的结合位点,使得活性保持率有较小的增强作用[21]。但随其浓度升高会对人体产生危害作用,因此其安全剂量还需进一步考虑;而Zn2+和Cu2+对α-葡萄糖苷酶抑制活性明显降低,并具有显著性差异(p<0.05),当Zn2+和Cu2+添加浓度为5mmol/L时,活性保持率分别降至86.4%和68.0%,这与Zn2+和Cu2+使杨梅蛋白酶解肽的非极性共价键发生破坏密切相关,进一步导致溶解度降低、疏水基团外露等理化性质改变,从而使其生物学活性下降。综上表明,杨梅蛋白酶解肽在加工和保存过程中尽量不要用锌、铜等材料制作的容器,以免丧失生物活性和对人体产生毒害作用。
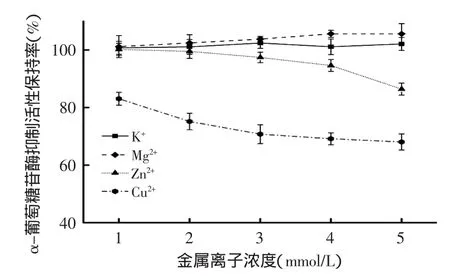
图10 金属离子对杨梅蛋白酶解肽降血糖活性的影响Fig.10 The influence of different metal ions on hypoglycemic activity of Myrica rubra peptide
3 结论
杨梅蛋白酶解肽分子量范围在118.9~4552.2u,其抗氧化及降血糖活性有良好的耐热性和耐酸性,而在碱性条件下,抗氧化活性丧失较快而降血糖活性略微上升。葡萄糖、乳糖、蔗糖均能增强杨梅蛋白酶解肽的抗氧化活性且增强程度依次为葡萄糖>乳糖>蔗糖,而葡萄糖和蔗糖并不能直观描述出对杨梅蛋白酶解肽降血糖活性的影响,但乳糖对杨梅蛋白酶解肽降血糖活性影响不明显。苯甲酸和NaCl对杨梅蛋白酶解肽抗氧化活性影响都不显著,低剂量NaCl能促进降血糖活性,因此推荐使用低剂量NaCl作为防腐剂;Zn2+和Cu2+均能降低杨梅蛋白酶解肽的抗氧化及降血糖活性,Mg2+和K+对抗氧化活性影响不显著,Mg2+对降血糖活性有较小增强作用,K+无明显影响。因此,在加工和保存过程中尽量不要使用Cu2+、Zn2+等材料制作的器皿。本实验主要探索研究了通过胃蛋白酶和胰蛋白酶酶解杨梅蛋白制备所得的杨梅蛋白酶解肽,但不同的酶对蛋白质的酶切位点不同,可能导致所得多肽含量和组成也会不同,也会影响其活性的测定,因此在后续研究中,杨梅蛋白在不同酶的酶解条件下的活性测定有待深入研究。
[1]吴亚梅,陈健,李维锋,等.杨梅的综合研究与利用[J].食品科技,2007,10:75-78.
[2]张泽煌,钟秋珍,林旗华.杨梅果实氨基酸组成及营养评价[J].热带作物学报,2012,33(12):2279-2283.
[3]龚洁强,王允镔,林媚,等.杨梅果实品质与营养成分分析[J].浙江柑橘,2004,21(1):31-32.
[4]孔令明,李芳,陶永霞,等.多肽的功能活性与研究进展[J].中国食品添加剂,2009(3):71-73.
[5]Sun C,Zheng Y,Chen Q.Purification and anti-tumour activity of cyanidin-3-O-glucoside from Chinese bayberry fruit[J].Food Chemistry,2012,131(4):1287-1294.
[6]KARL E M,OANH H,REIDAR B.C-Methylated Dihydrochalcones from Myrica gale:Effectsas antioxidiants and as scavengers of l,l-DiPhenyl-2-Pricrylhydrazyl[J].Pharmacologyand Toxicology,1996,78(2):111-116.
[7]于志鹏,赵文竹,于一丁,等.蛋清蛋白质降压肽的化学及酶稳定性研究[J].食品科学,2010,31(9):23-26.
[8]Zhu C Z,Zhang W G,Kang Z L,et al.Stability of an antioxidant peptide extracted from Jinhua ham[J].Meat Science,2014,96:783-789.
[9]Dong S Y,Panya A,Zeng M Y,et al.Characteristics and antioxidantactivityofhydrolyzedβ-lactoglobulin-glucose Maillard reaction products[J].Food Research International,2012,46:55-61.
[10]钱方,邓岩,刘阳,等.胃蛋白酶水解大豆蛋白的研究[J].中国乳品工业,2001,29(3):10-13.
[11]龚丽芬,郑志福,陈碧娥.胰蛋白酶酶解文蛤的工艺条件[J].氨基酸和生物资源,2003,25(2):45-47.
[12]中国食品发酵工业研究院.GB/T 22729-2008海洋鱼低聚肽粉[S].2008.
[13]陈季旺,孙勤,夏文水.鱼降压肽的大孔吸附树脂脱盐及理化性质[J].2009,30(24):158-162.
[14]Li X C,Lin J,Gao Y X,et al.Antioxidant activity and mechanism of Rhizoma Cimicifugae[J].Chemistry Central Journal,2012,6(1):140.
[15]Raju B C,Tiwari A K,Kumar J A,et al.a-Glucosidase inhibitory antihyperglycemic activity of substituted chromenone derivatives[J].Bioorganic&Medicinal Chemistry,2010,18:359-365.
[16]Ashley S B,Derek S,Gordon J M.Berry components inhibit a-glucosidase in vitro:Synergies between acarbose and polyphenols from black currant and rowanberry[J].Food Chemistry,2012,135:929-936.
[17]沈同.生物化学[M].北京:高等教育出版社,1991:163-175.
[18]游丽君,赵谋明,Regenstein J,等.加工和贮藏条件对泥鳅多肽抗氧化活性的影响[J].江苏大学学报,2011,41(2):579-583.
[19]杨志敏,蒋立科.生物化学[M].北京:高等教育出版社,2005:156-166.
[20]Liu P,Huang M,Song S,et al.Sensory characteristics and antioxidant activities of maillard reaction products from soy protein hydrolysates with different molecular weight distribution[J].Food Bioprocess Technol,2012,5:1775-1789.
[21]王子怀,胡晓,李来好,等.肽-金属离子螯合物的研究进展[J].食品工业科技,2014,35(8):359-362.
Study on antioxidant and hypoglycemic activity stability from Myrica rubra peptide
ZHANG Yi-fan1,2,WANG Qiang1,2,WANG Wei2,WU Li-yu2,ZHANG Yu2,ZHANG Cheng-hui1,*
(1.College of Food Science and Technology,Hainan University,Haikou 570228,China;2.Institute of Quality and Standard for Agriculture Products,Zhejiang Academy of Agricultural ScienceLaboratory for Risk Assessment of Agricultural Product Quality and Safety,Ministry of Agriculture,Zhejiang Key Laboratory of Food Safety,State Key Laboratory Breeding Base for Zhejiang Sustainable Pest and Disease Control,Hangzhou 310021,China)
The stability of antioxidant and hypoglycemic activity from Myrica rubra peptide were determined with the effects of temperature,pH,saccharides,antiseptics and metal ions on the DPPH radicals scavenging activity and α-glucosidase inhibition activity assessed,but also investigated its relative molecular mass distribution.The result showed that the relative molecular mass distribution of Myrica rubra peptide range from 118.9~4552.2u with an excellent heat-resistant and heat-resistant ability.But antioxidant activity lost and hypoglycemic activity rose slightly in the alkali environment.Saccharides could increase the antioxidant activity significantly in the order of glucose>lactose>sucrose.Both benzoic acid and NaCl had no effects on antioxidant activity.Benzoic acid had no significant effects on hypoglycemic activity(p>0.05),but NaCl improved the hypoglycemic activity from 1.5%to 2%.Both Cu2+and Zn2+reduced the antioxidant and hypoglycemic activity.Mg2+and K+had no significant effects on antioxidant activity(p>0.05),but hypoglycemic activity was slightly enhanced by Mg2+and K+had no significant effects on hypoglycemic activity(p>0.05).
Myrica rubra;peptide;antioxidant;hypoglycemic;stability
TS255.1
A
1002-0306(2015)14-0086-06
10.13386/j.issn1002-0306.2015.14.008
2014-10-20
张一帆(1989-),男,在读硕士研究生,研究方向:功能性食品。
章程辉(1967-),男,博士,研究员,研究方向:热带农产品质量安全与无损检测技术研究。
农业部农产品质量安全风险评估实验室(杭州)开放课题;国家自然科学基金青年科学基金(31101390);浙江省自然科学基金(LY13C200015)。
