链霉菌生物活性物质分离纯化技术研究进展
2015-11-07师瑞芳李师翁
王 凯,李 婷,师瑞芳,李师翁,*
(1.兰州交通大学化学与生物工程学院,甘肃兰州730070;2.甘肃省极端环境微生物资源与工程重点实验室,甘肃兰州730070;3.中科院寒区旱区环境与工程研究所,甘肃兰州730030)
链霉菌生物活性物质分离纯化技术研究进展
王凯1,李婷2,师瑞芳3,李师翁1,*
(1.兰州交通大学化学与生物工程学院,甘肃兰州730070;2.甘肃省极端环境微生物资源与工程重点实验室,甘肃兰州730070;3.中科院寒区旱区环境与工程研究所,甘肃兰州730030)
放线菌尤其是链霉菌是微生物生物活性天然产物的主要产生菌,链霉菌属的很多菌能产生多种抗生素、抗肿瘤药物及酶等重要活性代谢产物,具有广泛的商业和医用开发价值。本文对链霉菌产生的生物活性物质分离纯化方法进行了综述,并对发展趋势进行了展望。
链霉菌,生物活性物质,分离纯化技术
链霉菌属革兰氏阳性放线菌,其具复杂而庞大的次级代谢调控网络,可产生大量具重要应用价值的次级代谢产物,除最主要的抗生素类外,还包括抗肿瘤剂、免疫抑制剂、抗虫剂[1]以及胞外水解酶类(几丁质酶、果胶酶、纤维素酶)[2]等生物活性产物,它们在医药、农业、食品、化工等领域具有重要的商业和药用价值。然而这些活性代谢产物存在于物质成分复杂的发酵液中,给其规模开发和应用带来困难,因此选择合理高效的分离纯化手段是有效解决这一问题并获得高纯度活性产物的关键。本文就目前主要的链霉菌生物活性物质分离纯化方法的研究进展作一综述。
1 链霉菌生物活性物质研究概况
过去十年,不同环境中分离的链霉菌分泌的生物活性新型代谢物数量在不断增长。根据其化学结构的不同主要分为多肽、醌类、大环内酯类、萜烯类、聚酮类、吲哚类、酶、酶抑制剂以及脂类等[3]。数据显示,在近10000种放线菌产生的生物活性化合物中,有7600多种来自链霉菌属,约占74%[4],显示了链霉菌作为药物产生者的巨大价值。国内外研究者也纷纷从链霉菌中分离纯化各种活性代谢产物。例如Usama W H等[5]从Streptomyces sp.Mei37分离到五个异喹啉醌生物碱,这些生物碱对8种肿瘤细胞具有抑制作用。Eric D M[6]对链霉菌产物进行分离得到三种具细胞毒性的环肽。Sebastian M[7]从Streptomyces sp. CS495中分离得到一种碱性几丁质酶。Taechowisan T等[8]从Streptomyces sp.Tc052中分离到4个黄酮类化合物,其中有两种可以作为神经保护剂等。而在已经分离的16500多种抗生素中,从链霉菌中分离的就有8366种,约占51%(表1),并且由链霉菌产生的9000多种生物活性物质中,目前已有100~120多种得到应用,占微生物活性物质应用品种总数的70%~75%[4]。由此可见,从链霉菌属中可提取分离得到多种多样的活性代谢产物,它们在人类生活中发挥着重要作用。
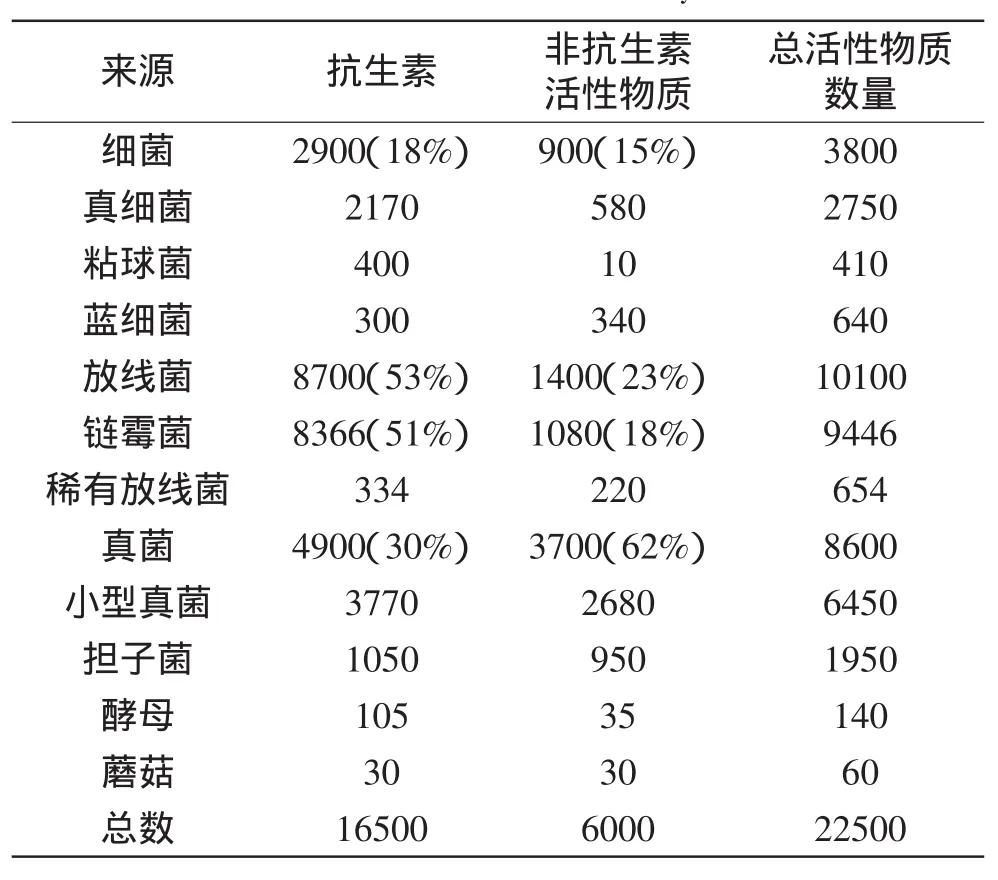
表1 微生物产生的生物活性物质[4]Table 1 Bioactive microbial secondary metabolites[4]
2 链霉菌生物活性物质分离纯化特点
生化分离纯化技术作为生物技术产业中关键技术,其具有特殊要求。尤其对于某些生物活性物质(酶、蛋白质等)具有生理活性和药理作用,因而在分离纯化中,必须在保证其活性的前提下进行分离操作。因此,从链霉菌发酵液中提取、分离、纯化生物活性物质是极其复杂的工艺过程,主要具有以下特点:
a.原料发酵液中常存在和目的分子结构、理化性质相似的同分异构体或者结构类似物,普通分离法难分离,因此,需借助高效分子识别技术纯化目标产物。同时,需借助多种分离技术来完成,致使分离步骤增多,能源和材料消耗增大,分离纯化成本增加。研究表明,生物产品分离纯化费用通常占总生产成本的80%[9]。魏茂龙[10]对吡啶霉素链霉菌中pyr2缺失突变株HTT12发酵产物依次进行了离心、萃取、反相硅胶柱层析、凝胶柱层析、半制备型HPLC分离,然后进行LC-MS、二级质谱分析,经过复杂繁琐的纯化及分析步骤最终分离得到两种吡啶霉素类似物HTT12-1和HTT12-3。
b.链霉菌生物活性物质结构的复杂性和多样性,致使所采用的操作方法通用性较差,常无固定的操作方法,因此在分离过程中需根据被分离物质的性质选择经济及分离效率高的分离法。
c.多数链霉菌生物活性物质只能在适合的温度和条件下发挥作用,其对pH、温度较为敏感,外界环境的变化很可能造成活性物质的活性降低或失活,因此分离纯化中通常需采用保护剂和缓冲系统等措施来保持活性。李汉广等[11]探索Streptomycete 702发酵液中菌丝体浸提条件时将菌丝体置于不同温度和不同pH下的有机溶剂中进行优化分离。结果表明,当Streptomycete 702在pH6.5(缓冲液∶磷酸氢二钠-柠檬酸),温度30℃,时间12h时其浸提效果最好,浸提完成时优化后的浸提液效价较优化前高出17%。因而,选择经济高效的分离法在链霉菌活性物质分离纯化中尤为重要。
3 链霉菌生物活性物质分离纯化技术及其进展
鉴于上述有关链霉菌生物活性物质的特点,因而在对其进行分离纯化时需要采用合理的分离手段,方可分离得到目标产物。目前链霉菌生物活性物质的分离纯化常用的方法主要包括:溶媒萃取法、色谱法(吸附色谱、凝胶色谱、离子交换、高效液相色谱)和膜分离法(纳滤、超滤)。其中运用最多的是色谱法,当然,实际操作中根据被分离物质的差异,多种分离技术的联合使用将会使分离效果到达最佳。
3.1预分离
发酵液成分通常比较复杂,因而在分离纯化之前必须对发酵液进行预处理,除去杂质,分离菌丝体,同时一般还要对滤液进行改性,为进一步的提纯做准备。对于胞外代谢物,发酵液经离心过滤,上清液进行硫酸铵分级沉淀或超滤等法进行浓缩;链霉菌的胞内产物需要破碎细胞后分离,除使用醇、丙酮沉淀外,多采用硫酸铵沉淀浓缩法。Beg等[12]将链霉菌QG-11-3发酵液溶解于60%的硫酸铵溶液中,隔夜(4℃),离心,将沉淀溶于100mmol/L的甘氨酸溶液中,分别采用NaOH缓冲液(pH8.6)和磷酸盐缓冲液(pH3.0)透析24h得到部分纯化的木聚糖酶(96IU/mL)和果胶酶(46IU/mL)。Pradeep G C等[13]将Streptomyces sp.CS 495发酵得到的粗样品通过30%~80%硫酸铵分级沉淀,然后离心(6000r/min,1h,4℃),回收蛋白质,用5ku的滤膜进行超滤,超滤液经过透析(10mmol Tris/HCl,pH7.0),经过Sepharose CL-6B柱(85cm×1.7cm;预平衡:10mmol Tris/HCl,pH7.0;洗脱流速:30mL/h)纯化,得到纯化7倍的碱性几丁质酶。可见,作为预分离的主要手段沉淀、离心在分离初期发挥重要作用。
3.2溶媒萃取法
萃取主要应用于整个分离纯化过程的前阶段,得到的是粗分离物质。萃取中使用的溶剂主要是亲水和亲脂性的有机溶剂,如甲醇、乙醇、丙酮、氯仿、乙酸乙酯等。例如在对螺旋霉素、红霉素、麦迪霉素等的分离中多采用溶媒萃取法[14]。Makoto等[15]将Streptomycesviolaceusniger的发酵液离心后(6000r/min,20min,5℃)通过80%丙酮萃取,然后用丁醇提取,再离心,经过离心分配色谱技术(流动相∶BuOH∶EtOH∶H2O=10∶2.5∶10;流速:3mL/min)得到粗产物,最后通过制备型HPLC(20mm×250mm;流动相:80%甲醇;流速:9.9mL/min)分离得到了三种大环内酯类抗生素RS-22A、B和C,三种化合物对真菌和革兰氏阳性菌均显示了良好的抑菌活性;Slim S[16]通过对链霉菌TN17发酵离心过滤的发酵液获得的有机相旋转蒸发干燥,得到提取物,溶解进5mL的二氯甲烷和甲醇中(9∶1)进行萃取,将得到的提取物使用Sephadex LH-20柱(洗脱液为二氯甲烷∶甲醇=9∶1)进行层析,最终通过TLC检测得到三个有效活性组分,三者均对革兰氏阳性菌以及真菌有抑制作用。当然随着萃取分离技术的不断发展,诸如固相微萃取技术[17]等也逐渐用于生物制品的分离工业中,与溶媒萃取相比它们更加高效环保。
3.3色谱法
色谱技术已经广泛应用于链霉菌次级代谢产物的分离纯化中。根据分离原理的不同,色谱法分为吸附色谱法、离子交换色谱法、凝胶色谱法以及高效液相色谱法。
3.3.1吸附色谱法吸附色谱法也称液-固色谱法,它是基于溶质和固体吸附剂上的固定活性位点之间的相互作用。可以将吸附剂装填于柱中。最常用的吸附剂是硅胶、大孔吸附树脂等。
硅胶柱色谱法一次性层析获得产品的纯度通常不高,因而实际使用中需进行多次反复层析以期获得高纯度的产品。Houssam M等[18]对Streptomyces albidoflavus-143发酵液离心(5000r/min,20min)过滤,对上清液进行旋蒸浓缩后用石油醚沉淀(5000r/min,15min),继而通过TLC(展开剂为氯仿∶甲醇=24∶1)分离单一组分,最后通过硅胶柱(2cm×25cm;洗脱剂为氯仿∶甲醇=9∶1)吸附收集组分,得到一种分子式为C22H36O6的大环内酯类抗生素。段传人等[19]通过对海洋链霉菌Streptomyces sp.SCSIO 1666发酵液首先进行离心(10min,3500r/min)弃上清,经过丙酮萃取后进行乙醇洗脱,得到的产物通过100~200目硅胶柱层析(氯仿-甲醇10∶0~5∶5梯度洗脱),再通过反相硅胶(依次进行甲醇-水20%~100%梯度洗脱和氯仿-甲醇10∶0~8∶2梯度洗脱),减压蒸干后得到替达霉素A(Tirandamycins A)。当改变萃取剂时,使用乙酸乙酯对离心后的发酵液萃取3次,得到产物过100~200目硅胶梯度柱层析,氯仿-甲醇(10∶0~5∶5)梯度洗脱,再经300~400目硅胶梯度柱层析,洗脱,蒸干后经反相硅胶柱(20%~100%甲醇-水梯度洗脱)最后得到替达霉素B(Tirandamycins B)。
大孔吸附树脂可以有效地吸附具有不同化学性质的各类化合物。吸附性能主要取决于吸附剂的表面性质(亲水性和疏水性)。根据树脂的表面性质分为非极性、中极性和极性三种类型[20]。在抗生素工业中,大孔吸附树脂的应用正在日益得到发展,应用相当普遍。张珊珊[21]在星海链霉菌抑菌活性物质的分离纯化中先后使用大孔吸附树脂HP-20(静态吸附2h,对为吸附的组分用等体积的50%和100%乙醇液态解析1h)和葡聚糖凝胶Sephadex LH-20(1cm× 17cm;3倍柱体积水洗脱,10倍浓缩)进行分离发现,大孔吸附树脂HP-20可有效的吸附发酵液中无活性的杂质,葡聚糖凝胶Sephadex LH-20可有效分离活性组分。最后得到一种对耐甲氧西林金黄色葡萄球菌菌株具有抑制活性的氨基糖苷类化合物。而在大孔吸附树脂分离过程中由于分离物质的性质、洗脱剂的性质、吸附的流速、树脂的性能等因素的作用均会影响到大孔吸附树脂的分离效果,因而在分离中需要筛选分离效果较好的树脂及分离条件进行吸附分离。王海燕等[22]比较了不同树脂对那他霉素分离效果后选择大孔吸附树脂HZ-816进行分离纯化,当流速为1.0mL/min,洗脱剂为pH11的80%乙醇溶液时,吸附率和解吸率高,洗脱液杂质少,解吸收率大于90%,产品纯度大于98%。这一方法生产成本低、安全、收率高,可见具有很高的应用价值。张楠等[23]对吸水链霉菌(Streptomyces hygroscopicus)BS-112通过大孔吸附树脂X-5(40cm×2.6cm;振荡吸附2.5h,3倍去离子水洗脱后用75%乙醇解析;流速:0.5mL/min;对活性组分减压旋蒸)和硅胶柱层析(60cm×2.6cm,200~300目硅胶;洗脱液:甲醇∶氯仿=3∶2;流速:1.0mL/min;活性组分减压旋蒸)分离,最后进行HPLC进一步纯化(色谱条件为:色谱柱BEH C18,2.1mm× 50mm,1.7μm;柱温30℃;检测波长305nm;进样量0.2μL;以0.2mL/min的流速洗脱15min)得到4种抗真菌活性组分(Tetrins A和B,Tetramycins A和B),它们对黄曲霉均具有良好的抑制作用。
3.3.2凝胶色谱法近年来凝胶色谱法广泛用于分离小分子化合物。凝胶色谱的固定相一般是交联度很高的聚丙烯酰胺、葡聚糖和琼脂糖的凝胶。因其操作简便快捷、数据可靠且重现性好,自动化程度高等优点,应用十分广泛。Yang P等[24]对一种新分离的Streptomyces diastaticus代谢产物进行硅胶柱层析(硅胶为200~400目;洗脱剂:氯仿∶甲醇=40∶1)和葡聚糖凝胶Sephadex LH-20(洗脱剂:氯仿∶甲醇=1∶1)过滤,然后进一步提高C18快速柱层析(洗脱剂:甲醇∶水= 4∶1),最终得到两种化合物寡霉素A和C,这是首次在S.diastaticus中发现寡霉素A和C。何峰[25]对链霉菌H03发酵产物采用先沉淀(8000r/min,20min)、后透析(分子截留量:20000u,透析48h)、再经过Sephadex G-100柱层析(70cm×3cm;流动相:0.1mol/L NaCl溶液;流速:0.3mL/min)等技术纯化,得到具有抗菌活性的多糖(由甘露糖、葡萄糖、半乳糖组成2∶1∶1)。Lobna E[26]对Streptomyces TN262发酵产物经过两次乙酸乙酯萃取后,经过凝胶柱Sephadex LH-20(100cm×3cm;洗脱剂:二氯甲烷∶甲醇=5∶2)层析多次分离,收集得到八种组分,其中两种属于大环内酯类抗生素cineromycin B和2,3-dihydrocineromycin B。
3.3.3离子交换法离子交换法广泛用于抗生素等小分子生物制品的分离纯化。姬志勤等[27]对一株新放线菌-秦岭链霉菌Streptomyces qinlingnensis sp.nov的抑菌活性成分进行分离时采用HD-2弱酸阳离子交换树脂(分离初期需对上清液用草酸调pH3.5,静置过滤再调pH8.0,以4L/h流速洗脱;柱型:Na+型,再用2.5L/h流速的1mol/L HCl解析)结合硅胶柱层析(2.0cm×80cm;洗脱剂:甲醇∶丙酮∶氨水=5∶5∶1),最终分离得到二丙酮胺,该物质对多种病原真菌和细菌具有明显抑菌活性。杨晓燕[28]对吸水链霉菌发酵上清液进行硫酸铵分级沉淀,后用Hitrap Q HP阴离子交换柱(洗脱剂:20mmol/L pH7.5的Tris-HCl;流速:0.4mL/min,含1mol/L的NaCl)除去色素,再先后经Superdex 75 10/300 GL凝胶柱(洗脱剂:20mmol/L pH7.5的Tris-HCl;流速:0.4mL/min,含0.15mol/L的NaCl)和Hitrap Q HP阴离子交换柱(洗脱剂:20mmol/L pH8.5的Tris-HCl,含0.4mol/L的NaCl)分离得到高纯度的谷氨酰胺转氨酶。王泽根[29]利用阴离子交换树脂330对达托霉素的纯化工艺发现,当进行静态吸附,温度15~30℃,pH8.0~8.5,吸附时间为10h,洗脱剂为0.8mol/L NaCl水溶液时,达托霉素的纯度由2%提高到60%,回收率87.5%,纯化效果明显。
3.3.4高效液相色谱法HPLC法对样品的适应性广泛,不受样品的热稳定性等限制,并且分离效果好,灵敏度高。目前最常用如反相高效液相色谱(RP-HPLC)。与正相高效液相色谱相比较其具有柱效高、使用寿命更长的优点,几乎对各种类型的有机化合物都呈现良好的选择性。Ying等[30]将链霉菌Streptomyces griseoluteus P510的培养液进行乙酸乙酯萃取(pH2.0,体积比1∶1)和硅胶柱层析(25cm× 1cm;洗脱剂:乙酸乙酯;流速:1.0mL/min)后,然后经过C18反相高效液相层析(色谱柱:Agilent eclipse XDB-C185μm,4.6mm×250mm;流动相:甲醇∶水=50∶50;进样量为20μL;流速1mL/min;柱温30℃),最终得到2个纯抗菌片段吩嗪-1-羧酸(phenazine-1-carboxylic acid,PCA),1-羟基吩嗪(1-hydroxyphenazine,1-OHPHZ)。张辉等[31]采用大孔吸附树脂(无水乙醇洗脱)、硅胶柱层析(100~200目;洗脱液:氯仿∶甲醇=90∶10~70∶30梯度洗脱)和反相高效液相色谱(乙腈∶水=20∶80;流速1.5mL/min;λ=254nm)分离法对链霉菌HSHM-068主要次级代谢产物分离得到两个musacins类化合物。
目前,在色谱分离技术领域不断出现很多新型色谱技术,并且逐渐应用于链霉菌生物活性物质的分离纯化中。彭飞等[32]首次利用高速逆流色谱(溶剂系统:乙酸乙酯∶正丁醇∶水=8∶1∶10;上相作为固定相,下相为流动相;转速:890r/min,正转;流速:0.5mL/min)和结晶法(4℃静置过夜)结合的方法从S.castelarensis FIM95-F1的胞外分离纯化得到抗真菌抗生素S1。王娇艳[33]将高速逆流色谱技术(样品纯化前经0.22μm微孔滤膜处理;循环器温度20℃;转速850r/min)应用于抗霉素组分的分离中,该法可更大量且更快速的进行抗霉素组分的分离纯化。
3.4膜分离法
膜技术不仅高效、能耗低、无相变,而且容易与其他分离技术整合。目前在链霉菌活性物质分离纯化中应用有超滤,纳滤法(分别为1000~30000u,200~1000u)。韩少卿等[34]利用超滤(分子截留量:5000ku;料液浓度:8%;压力:0.22MPa)、纳滤(分子截留量:800u;料液浓度:2%;压力:1.5MPa;pH8.5)操作对产二素链霉菌(Streptomyces ambofabiens)发酵产物螺旋霉素进行板框过滤处理,收率可达76.3%,明显高于传统溶媒提取收率。Ana I等[35]研究了不同纳滤膜对Streptomyces clavuligerus发酵液中克拉维酸的分离效果,结果发现Desal DK(美国OSMONICS公司生产的一种纳滤膜)是最合适有效的过滤膜(分离条件:pH5.0;温度:15℃±2℃;压力:4.0MPa),其展现了很好的流通量,克拉维酸的截留率达到98.1%。膜过滤效率虽然明显,但是其多作为分离纯化操作的中间环节,经纯化的物质,需要进一步进行色谱分离,陆颖健[36]对海洋链霉菌GB-2抗菌物质分离超滤时,发现抗菌物质可以通过分子截留量≤1ku的超滤膜,滤液(pH4.0的盐酸溶液预处理12h,酸沉后的收集液分别经过乙酸乙酯和正己烷萃取,旋蒸浓缩)进一步经Sephadex LH-20色谱柱(2.6cm×100cm;甲醇∶水= 3∶7;流速:15mL/min)分离后得到两种抑菌物质,对蜡样芽孢杆菌等致病菌具有明显抑制作用。
综上可见,对于不同的分离对象需要选择合适的分离法,以达到预期效果。一些链霉菌生物活性物质的常用分离方法总结见表2。

表2 链霉菌生物活性物质常用分离方法Table 2 Separation and purification technologies of bioactive metabolites from Streptomyces
4 结语
链霉菌生物活性物质分离纯化技术发展的趋势将会是:
a.多种分离技术的联合使用。目前,针对目标物质的特点,如何将这些分离提取技术联用,以更短时间更低能耗提取得到更高产率物质,已成为天然产物分离提取方法的研究热点。如高速逆流色谱法和结晶法同时使用[32],大孔吸附树脂层析、中压制备液相色谱、高速逆流色谱制备型高效液相色谱结合的分离法[50]。多种分离方法的整合将会大大提高分离纯化的效率和产品纯度。
b.新兴分离技术,如逐渐被应用于天然产物分离的分子印迹技术(MIT),此外包括对传统分离技术在机理和材料上进行改进的超临界萃取、超临界流体色谱及液膜技术等。这些分离技术手段极大丰富了链霉菌活性物质分离手段。
c.吸附色谱、离子交换色谱及凝胶色谱仍然是当前生物活性物质分离中最主要的分离手段。层析过程的放大技术是天然产物分离过程中常用到的。工业生产过程需放大几十至几百倍,放大效应显著。因而,研究大型层析柱的放大效应及结构优化将是十分重要的课题。
在链霉菌活性代谢产物研究方面要加大对极端环境(高盐、高压、高寒等)、海洋等的研究,以期分离新的链霉菌和新型代谢产物。在分离纯化中要整合结构解析技术(红外、质谱等),实时分析分离物质的结构,提高新化合物发现的机会。对分离纯化过程要进行优化,提高产率的同时要缩短分离的流程、简化分离提纯步骤,积极开发具有反馈检测控制的工艺过程,提高产品纯度。
[1]Bentley S D,Chater K F,Cerdeno T,et al.Complete genome sequence of the model actinomycete Stretomyces coelicolor A3(2)[J].Nature,2002(417):141-147.
[2]Ganesh D,Rijuta G,Saratale,et al.Production and characterization of multiple cellulolytic enzymes by isolated Streptomyces sp.MDS[J].Biomass and Bioenergy,2012(47):302-315.
[3]Dharmaraj S.Marine Streptomyces as a novel source of bioactive substances[J].World Journal of Microbiology and Biotechnology,2010,26(12):2123-2139.
[4]Janos B.Bioactive microbial metabolites[J].Antibiotics,2005,58(1):1-26.
[5]Usama W H,Mohamed S,Khaled A S,et al.Mansouramycins A-D,cytotoxic isoquinolinequinones from a marine Streptomyces[J].Journal of Natural Products,2009(72):2120-2124.
[6]Miller E D,Kauffman C A,Jensen P R,et al.Piperazmycins:cytotoxic hexadepsipeptides from a marine-derived bacterium of the genus Streptomyces[J].Journal of Organic Chemistry,2007,72(2):323-330.
[7]Sebastian M,Agustinus J N,Widya A.Purification and characterization of Streptomyces sp.IK chitinase[J].Indonesian Journal of Biotechnology,2010,15(1):29-36.
[8]Taechowisan T,Chuaychot N,Chanaphat S,et al.Cytoprotective activity of chemical constituents isolated from Streptomyces sp[J]. International Journal of Biological Chemistry,2009,3(1):11-17.
[9]刘俊果.生物产品分离设备与工艺实例[M].北京:化学工业出版社,2009:1-2.
[10]魏茂龙.两株土壤链霉菌次级代谢产物谱分析及吡啶霉素生物合成基因pyr2的功能研究[D].上海:上海交通大学,2012.
[11]李汉广,周秋香,余晓斌.抗真菌链霉菌中新农抗702浸提工艺的优选[J].食品与发酵工业,2013(11):171-175.
[12]Beg Q K,Bhushan B.Production and characterization of thermostable xylanase and pectinase from streptomyces sp.QG-11-3[J].Industrial Microbiology and Biotechnology,2000(24):396-402.
[13]Pradeep G C,Yun H C,Yoon S C,et al.An extremely alkaline novel chitinase from Streptomyces sp.CS495[J].Process Biochenistry,2014(49):223-229.
[14]Yong M M.Comprehensive Biotechnology[M].NewYork:Pergaman Press,1985:439.
[15]Makoto U,Norio S,Kimie K,et al.RS-22A,B and C:new macrolideantibioticsfromantibioticsfromStreptomyces violaceusniger[J].The Journal Of Antibiotics,1995,48(4):289-293.
[16]Slim S,Lotfi M,Ahmed L.Purification and structure elucidation of three naturally bioactive molecules from the new terrestrial Streptomyces sp.TN17 strain[J].Natural Product Research,2011,25(8):806-814.
[17]吴芳华.固相萃取新技术研究进展[J].分析测试技术与仪器,2012,18(2):114-120.
[18]Houssam M,Bahobail A S.Antifungal macrodiode production by Streptomyces albidoflavus-143:fermentation,purification and biological activities[J].Journal of American Science,2011,7(3):13-23.
[19]段传人,姚月良,王中文,等.海洋链霉菌Streptomyces sp. SCSIO 1666活性代谢产物替达霉素A和B的发酵优化及分离鉴定[J].中国海洋药物杂志,2010,29(6):12-21.
[20]何炳林,黄文强.离子交换与吸附树脂[M].北京:人民卫生出版社,1995:352.
[21]张珊珊,赵心清,陈亮宇,等.星海链霉菌抑菌活性物质的分离纯化[J].微生物学通报,2011,38(10):1540-1545.
[22]王海燕,李晓露,王健,等.大孔树脂法分离纯化那他霉素的工艺研究[J].中国抗生素杂志,2010,35(3):194-198.
[23]Nan Z,Zhen S.Identification and characterization of antifungal active substances of Streptomyces hygroscopicus BS-112[J]. World Journal of Microbiology and Biotechnology,2013(29):1443-1452.
[24]Yang P,Li M,Zhao J.Oligomycins A and C,Major secondary metabolites isolated from the newly isolated strain[J].Folia Microbiologica,2010,55(1):10-16.
[25]何峰,杨英,周蓬蓬,等.链霉菌H03发酵液中具有抗菌活性多糖的分离纯化及其单糖组分分析[J].生命科学研究,2007,11(3):212-217.
[26]Lobna E,Mohamed S,Slim S.Bioactive secondary metabolites from a new terrestrial Streptomyces sp.TN262[J].Applied Biochemistry and Biotechnology,2010,162:579-593.
[27]姬志勤,魏少鹏,杨春平.秦岭链霉菌发酵液中二丙酮胺的分离及抑菌活性初步研究[J].西北农林科技大学学报,2009,36(2):148-153.
[28]杨晓燕,周哲敏,堵国成.吸水链霉菌谷氨酰胺转胺酶分离纯化方法改进及结构研究[J].生物技术通报,2011(4):199-203.
[29]王泽根.阴离子交换树脂对Streptomyces roseosporus发酵液中达托霉素的分离纯化研究[J].药物与临床研究,2011,19(4):318-321.
[30]Ying W,Qin L,Xue Z.Isolation and purification of a modified phenazine,griseoluteic acid,produced by Streptomyces griseoluteus P510[J].Research In Microbiology,2011,162(3):311-319.
[31]张辉,邓艾文,杜敏娜,等.海洋链霉菌HS-HM-068中两个musacins成分的分离及结构鉴定[C].浙江:2010年中国药学大会论文集,2010.
[32]彭飞,谢阳,江红,等.链霉菌FIM95-F1产生的抗真菌抗生素S1[J].天然产物研究与开发,2011(23):809-814.
[33]王娇艳.从2株链霉菌次级代谢产物中寻找新化合物以及抗霉素6个组分的高速逆流分离[D].福州:福建医科大学,2011.
[34]韩少卿,叶骥,薛强,等.超滤和纳滤膜分离技术提取螺旋霉素[J].中国抗生素杂志,2005,30(1):54-59.
[35]Ana I,Ana M,Brites A,et al.Nanofiltration of a clarified fermentation broth[J].Chemical Engineering Science,2006,61:2418-2427.
[36]陆颖健,刘姝,别小妹.海洋链霉菌GB-2抗细菌物质的溶解性质和分离纯化[J].食品科学,2008,29(7):306-310.
[37]Elleuch L,Shaaban M,Smaoui S,et al.Bioactive secondary metabolites from a new terrestrial Streptomyces sp.TN262[J]. Applied Biochemistry and Biotechnology,2010,162(2):579-593.
[38]Aibrohim D,Sutichai N,Wilunda C,et al.Antimalarial 20-membered macrolides from Streptomyces sp.BCC33756[J]. Tetrahedron,2013(69):8205-8208.
[39]黎晶晶,王旻.一株链霉菌脂肽类抗生素SMN的分离纯化及生物学活性的研究[J].安徽农业科学,2008,36(9):3717-3719.
[40]Fourrti B F,Fotso S,Ben Mehdi B A,et al.Purification and structure elucidation of antifungal and antifibacterial activities of newly isolated Streptomyces sp.Strain US80[J].Research In Microbiology,2005,156(3):341-347.
[41]Silva C S,Bovarotti E,Rodrigues M I.Evaluation of the effectsoftheparametersinvolvedinthepurificationof clavulanic acid from fermentation broth by aqueous two-phase systems[J].Bioprocess and biosystems engineering,2009,32(5):625-632.
[42]Neto A B,Bustamante M C,Oliveira J H,et al.Preliminary studies for cephamycin C purification technique[J].Applied Biochemistry and Biotechnology,2012,166(1):208-221.
[43]施跃峰,桑金隆,竺利红,等.新微生物农药抑霉菌素的研究[J].核农学报,2004,8(1):68-71.
[44]饶又启.中杀菌素链霉菌中的多烯抗生素[J].国外医药-植物药分册,2008(1):26-36.
[45]汪茂田,谢培山.天然有机化合物提取分离与结构鉴定[M].北京:化学工业出版社,2004.
[46]Arun D S,Prabhjot K G.Purification and characterization of heat-stableexo-inulinasefromStreptomycessp[J].Food Engineering,2007(79):1172-1178.
[47]胡博新,顾鸽青,冯军.链霉菌磷脂酶D的分离纯化及酶学性质[J].中国医药工业,2008,39(9):655-659.
[48]Jignasha T T,Satya P S.Organic solvent tolerance of an alkaline protease from salt-tolerant alkaliphilic Streptomyces clavuligerus strain Mit-1[J].Journal of Industrial Microbiology and Biotechnology,2009(36):211-218.
[49]Selvameenal L,Radhakrishnan M,Balagurunathan R. Antibiotic pigment from desert soil actinomycetes;biological activity,purification and chemical screening[J].Indian Journal of Pharmaceutical Sciences,2009,71(5):499-504.
[50]洪秀清.吸水链霉菌FIM99501次级代谢产物的研究-分离纯化、结构鉴定[D].福州:福建医科大学,2010.
Separation and purification technologies of bioactive metabolites from Streptomyces
WANG Kai1,LI Ting2,SHI Rui-fang3,LI Shi-weng1,*
(1.School of Chemical and Biological Engineering,Lanzhou Jiaotong University,Lanzhou 730070,China;2.Key Laboratory of Extreme Environmental Microbial Resources and Engineering Gansu Province,Lanzhou 730070,China;3.Cold and Arid Regions Environmental and Engineering Research Institute,Chinese Academy of Sciences,Lanzhou 730030,China)
A large number of bioactive substances,such as antibiotics,antineoplastic drugs and enzymes were mainly derived from actinomycetes,especially from streptomyces.Streptomyces could produce many active metabolites which had tremendous commercial and medical exploitation value.In this paper,the separation and purification technologies of bioactive microbial metabolites were reviewed and the research trends were discussed.
Streptomyce;bioactive microbial metabolites;separation and purification technologies
TS201.1
A
1002-0306(2015)14-0373-06
10.13386/j.issn1002-0306.2015.14.069
2014-10-13
王凯(1989-),男,在读硕士研究生,研究方向:资源微生物。
李师翁(1963-),男,博士,教授,研究方向:环境分子生物学。
国家自然科学基金资助项目(31260090)。
