口服屈螺酮炔雌醇片治疗女性中度寻常痤疮的多中心、随机、安慰剂对照临床研究
2015-11-07张国毅林彤孙秋宁李恒进赖维顾军陆前进郭在培王宝玺
张国毅 林彤 孙秋宁 李恒进 赖维 顾军 陆前进 郭在培 王宝玺
·论著·
口服屈螺酮炔雌醇片治疗女性中度寻常痤疮的多中心、随机、安慰剂对照临床研究
张国毅 林彤 孙秋宁 李恒进 赖维 顾军 陆前进 郭在培 王宝玺
目的 评估口服避孕制剂屈螺酮炔雌醇片(YAZ)治疗女性中度寻常痤疮的疗效和安全性。方法采用多中心、随机、双盲、安慰剂对照研究。入选患者按照随机数字表分为YAZ组和安慰剂组,分别口服YAZ和安慰剂。两组患者在月经的第1天服药,每日1片,连续服用24 d,后服用4 d无活性药片,28 d为1个周期,共治疗6个周期。分别于治疗第1、3、6周期及治疗结束后8~15 d,对丘疹、脓疱、结节、开放性粉刺和闭合性粉刺进行计数,评估疗效和安全性。结果 7个中心179例女性中度寻常痤疮患者入组,173例入选全分析集,146例完成治疗研究,143例入选符合方案集。治疗6个周期后,全分析集YAZ组和安慰剂组皮损总数平均减少66.8%和37.7%;符合方案集YAZ组和安慰剂组皮损总数平均减少72.6%和55.6%。YAZ组和安慰剂组在第6周期的炎性皮损数与基线期相比分别减少75.5%和60.9%,非炎性皮损数分别减少69.3%和50.2%。在YAZ组中,研究者评定:改善患者比例93.7%(74/79),安慰剂组78.1%(57/73)。本研究中未出现严重的不良事件。治疗期间YAZ组不良反应发生率为25.3%(22/87),安慰剂组为4.7%(4/86)。结论 YAZ治疗女性中度寻常痤疮有效且安全。临床试验注册 ClinicalTrials.gov Identifier:NCT00818519。
痤疮,寻常;雄激素拮抗药;随机对照试验;炔雌醇;屈螺酮;避孕药,女用
痤疮的发生有多种病因学理论,但体内雄激素水平升高与痤疮发生之间的相关性早已被证实[1]。屈螺酮(DRSP)是具有抗肾上腺盐皮质激素和抗雄激素活性的孕激素,可与乙炔雌二醇(EE)联合使用治疗育龄期女性中度寻常痤疮[2-6]。2007年1月,口服避孕制剂屈螺酮炔雌醇片(含屈螺酮3 mg、乙炔雌二醇 20 μg,商品名:YAZ®,中文名:优思悦,进口药品注册证号:H20140972)首次得到美国食品药品监督管理局(FDA)的批准,适用于接受口服避孕药的女性中度痤疮。我们于2008年12月至2010年5月,在全国7个研究中心对屈螺酮炔雌醇片(简称YAZ)治疗女性中度寻常痤疮的疗效和安全性进行评价,并与安慰剂进行对照研究。
对象与方法
一、对象
1.入选标准:①签署知情同意书;②女性寻常痤疮患者,年龄14~45岁,吸烟者年龄<30岁;③患者至少出现40个皮损,至少20个炎性皮损(丘疹或脓疱)、20个非炎性皮损(粉刺)、<3个小结节,在研究者总体评估量表(ISGA)中不归入0度、1度或2度;④宫颈涂片正常,不需要进一步随访(在筛选访视时进行宫颈涂片检查或在之前6个月内检查并且结果正常),处女免除宫颈涂片检查;⑤筛选期前3个月内至少有1次月经;⑥筛选访视和随机分组访视的妊娠试验为阴性;⑦所有需要避孕的患者在研究期间必须使用非激素类避孕方法;⑧同意不使用任何局部或其他系统抗痤疮治疗;⑨可以使用不致粉刺的化妆品、保湿剂和面部清洁剂。
2.排除标准:砂纸样粉刺或聚合性痤疮;妊娠、哺乳期;肥胖;对研究药物的任何成分过敏;有影响患者安全的有显著临床意义的实验室检查结果;可对身体系统功能产生影响并可导致研究药物吸收改变、过度蓄积、代谢受损或排泄改变的任何疾病或状况;任何可能在治疗期间加重的疾病或状况;使用其他类固醇激素、肝素、香豆素、乙内酰脲、巴比妥类药物、苯妥英、扑米酮、卡马西平、利福平、灰黄霉素、托吡酯、非尔氨酯、利托那韦和含圣约翰草的产品、螺内酯以及持续使用抗生素;在入选研究前3个月内参加另一项临床研究;患者为研究人员的家属或研究人员;初始痤疮皮损计数前无洗脱期。为确保稳定的基线状态,初始痤疮皮损计数前必须有以下洗脱期:①3个月内不得使用避孕植入剂(例如左炔诺孕酮)或激素类宫内节育器/系统(例如左炔诺孕酮宫内节育系统);②2个月内不得使用口服避孕药;③6个月内不得全身使用异维A酸或注射型避孕药(如醋酸甲羟孕酮注射液);④8周内不得使用其他全身性处方类抗痤疮药物(如抗生素);⑤4周内不得使用局部维A酸;⑥2周内不得使用其他局部抗痤疮药物(如抗生素、过氧苯甲酰)。
3.退出标准:①首次出现静脉炎或血块(血栓形成,栓塞),即:腿部异常疼痛或肿胀,呼吸或者咳嗽时伴有不明原因刺痛,胸部压榨感或疼痛;②手术前(6周前);③需要长期制动(事故后);④首次发生或发作更为频繁的严重偏头痛;⑤突然发生的感觉异常(视觉、听觉等);⑥运动障碍(特别是瘫痪);⑦妊娠;⑧反复、大量、持续的周期内出血;⑨有临床意义的血压升高;⑩有临床意义的血钾升高;11○出现肝炎、黄疸、全身瘙痒、胆汁排泄异常(胆汁淤积)和肝功能异常;12○治疗时癫痫发作;13○上腹部异常症状,不能快速自发缓解;14○患者可以因下述原因退出研究:患者或其法定监护人要求;基于健康考虑;申办者要求。
二、研究方法及观察指标
采用多中心、随机、双盲、安慰剂对照的临床研究。本研究符合国家食品药品监督管理局药物临床研究批件(批件号:2008L10381,临床试验注册号:ClinicalTrials.gov Identifier:NCT00818519)的要求,并得到中国医学科学院皮肤病医院伦理委员会批准。医师记录患者基本情况与反应;丘疹、脓疱、结节、开放性和闭合性粉刺等由经过统一培训的护士或其他医务人员计数。在每次访视中,记录炎性皮损数目、非炎性皮损数目、总皮损数目,并与治疗前基线比较,得出ISGA量表。在末次访视中进行研究者/患者总体评估。治疗前后进行妇科检查(包括宫颈涂片),血尿常规、血清化学检查(钾、钠、肌酐、总蛋白、白蛋白),肝功能检查(碱性磷酸酶、γ谷氨酰转移酶、丙氨酸转氨酶、天冬氨酸转氨酶、胆碱酯酶),糖化血红蛋白A1 C检查,血脂检查,β人绒毛膜促性腺激素检查,乳腺B超。每次访视进行尿妊娠实验,一般体检,血压、心率和身高、体重测定,分析不良事件发生等情况。分别于治疗第1、3、6周期末及治疗结束后8~15 d评估疗效和安全性。
三、用药方法与疗程
月经的第1天作为服药的第1天,YAZ组每日口服YAZ 1片,安慰剂组口服安慰剂(粉色药片)1片,连续服用24 d后,继续服用4 d无活性的白色药片,28 d为1个周期,共治疗6个周期。受试药物批号为R23501,对照药物批号为R23501,均由德国拜耳医药保健有限公司提供。
四、评分标准
ISGA量表:0分:正常,皮肤洁净无痤疮皮损;1分:皮肤基本洁净,有少量非炎性皮损,几乎无炎性丘疹(丘疹已经缓解,可留有色素沉着,不是粉红色),无结节;2分:少量丘疹或脓疱,炎症轻微,有粉刺,无结节;3分:多个粉刺(非炎性病变为主),部分炎性皮损,可有一个小结节或无结节;4分:多个炎性皮损,甚至很多粉刺,可有少数结节或者无结节;5分:大量炎性皮损为主,不同数量的粉刺,很多丘疹、脓疱或结节。
研究者总体改善评分(IOIR):疾病的体征和症状与基线时相比,1分:洁净,完全清除;2分:改善非常好,清除 >75%;3分:改善很好,清除50% ~75%;4分:中度改善,清除 <50%;5分:无改善,未清除;6分:恶化或加重。改善率为洁净、改善非常好、改善很好和中度改善率的总和。
患者总体自我评估(SOSR):1分:改善非常好;2分:改善很好;3分:有些改善;4分:无改善;5分:恶化。改善率为改善非常好、改善很好和有些改善率的总和。
五、疗效评价
主要疗效指标:第6个周期末,痤疮皮损总数与基线相比变化的百分比(粉刺、丘疹、脓疱和结节)。次要疗效指标:①6分制ISGA评分为“0”或“1”的患者百分比;②炎性皮损计数(包括丘疹、脓疱、结节)及非炎性皮损计数(包括开放粉刺和闭合粉刺)分别与基线相比的变化百分比;③丘疹、脓疱、结节、开放粉刺、闭合粉刺数分别与基线比较的变化百分比;④IOIR和SOSR显示“改善”的患者百分比。依从性=每例患者服用药物总片数/患者研究持续时间(d)。
六、安全性评价
主要根据不良事件(AE)发生情况、实验室检查、一般体检和妇科检查(包括宫颈细胞涂片)、生命体征和体重变化进行评价。
七、统计学分析
使用软件包SAS 9.1版进行统计评估。通过描述性统计方法对所有指标进行分析。定量数据以可评估数据个数和缺失值个数、平均值、标准差、最小值、四分位数、中位数和最大值进行分析汇总。分类数据以频数表进行分析汇总。主要疗效指标采用全分析集和符合方案集进行分析。主要疗效指标和全部其他指标采用描述性统计分析。
结 果
一、病例资料
全国7个研究中心共有193例患者参加筛选179例入组,按随机数字表法分组为YAZ组89例安慰剂组90例。173例适合入选全分析集,分别为YAZ组87例,安慰剂组86例。146例完成治疗研究,其中YAZ组75例,安慰剂组71例。173例全分析集患者均为女性,年龄14~44岁;YAZ组平均年龄24.0岁(16~44岁),安慰剂组平均年龄23.4岁(14~43岁)。两组的平均体重、身高、体重指数、教育程度、性关系/性生活情况具有可比性。基线期总皮损数YAZ组为86±78.3,安慰剂组为87±80.8两组患者依从性均较高且相等,平均值为0.99。
二、疗效评价
1.痤疮皮损计数变化:第6周期末,全分析集YAZ组和安慰剂组痤疮皮损总数平均减少66.8%和37.7%符合方案集中YAZ组(n=74)和安慰剂组(n=69)基线期皮损总数分别为83.7±39.8和79.0±36.6,第6周期末为22.4±27.7和33.0±25.5,分别减少72.6%±27.4%和55.6%±32.5%。第6周期末,两组的皮损总数减少情况在符合方案集中优于全分析集。见表1。
在全分析集中,YAZ组和安慰剂组在第6周期末的炎性皮损数相对基线期分别减少75.5%和60.9%;在第6周期末非炎性皮损数相对基线期分别减少69.3%和50.2%。YAZ组闭合性粉刺和丘疹计数的减少程度较高,两组脓疱和结节计数减少程度相等,安慰剂组开放性粉刺计数减少程度较高。见表1
2.研究者与患者评分结果:第6周期末,研究者与患者自我评定,YAZ组与安慰剂组比较,改善率和ISGA量表中处于“0、1”分级的患者百分比较高。YAZ组研究者评定为改善的患者比例(93.7%74/79)> 安慰剂组(78.1%,57/73),自我评定为改善的患者百分比(94.9%)>安慰剂组(84.9%)。见表2第3周期末,ISGA量表评定为“0”或“1”的患者百分比非常相似,均 <5%,而在第6周期末,YAZ组中49.3%的患者评定为“0”或“1”,而安慰剂组中仅为18.3%。
三、安全性评价
在研究中,未出现严重不良事件。安慰剂组2例患者因痤疮加重停止治疗;YAZ组1例患者因乳房疼痛停止治疗,另1例患者因纤维囊性乳房疾病停止治疗。
治疗期间,YAZ组22例(25.3%,22/87)和安慰剂组4例(4.7%,4/86)出现与研究药物相关的不良反应,有月经过多、子宫不规则出血、乳房胀痛、腹痛、月经紊乱、阴道出血、腹泻、恶心、呕吐、乳房肿块、月经过少、纤维囊性乳腺疾病等。两组在治疗期间均未出现实验室不良事件,在终末访视中YAZ组7例(8.0%)和安慰剂组5例(5.8%)出现实验室不良事件。非实验室不良事件均为中度或轻度。在接受宫颈涂片的患者中,检查结果未发现异常。
表1 女性寻常痤疮患者经屈螺酮炔雌醇片(YAZ)治疗6个周期末皮损计数变化(±s)

表1 女性寻常痤疮患者经屈螺酮炔雌醇片(YAZ)治疗6个周期末皮损计数变化(±s)
注:a:YAZ组和安慰剂组病例数分别为75例和71例
组别 例数 皮损总数 炎性皮损总数 非炎性皮损总数基线 第6周期 下降(%) 基线 第6周期a 下降(%) 基线 第6周期a 下降(%)YAZ组 87 80.8±37.6 25.4±27.9 66.8±31.4 32.3±13.9 7.7±8.3 75.5±28.1 48.6±32.8 14.6±22.1 69.3±33.8安慰剂组 86 78.3±35.5 46.3±88.6 37.7±118.7 31.4±14.7 11.9±9.2 60.9±29.9 46.3±29.0 20.5±20.8 50.2±49.9
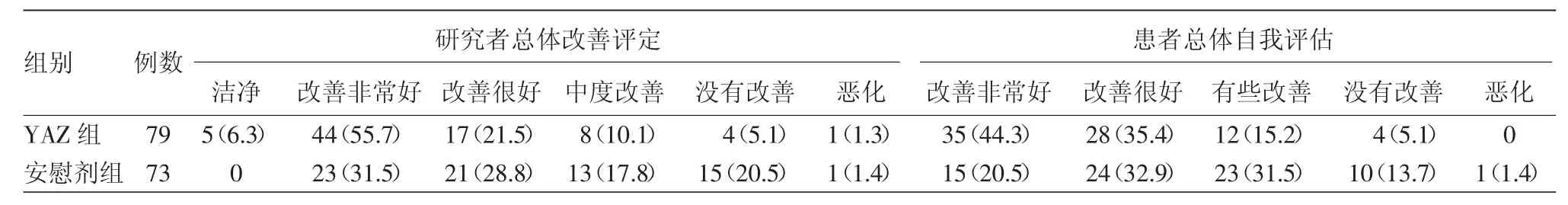
表2 女性寻常痤疮患者经屈螺酮炔雌醇片(YAZ)治疗第6周期末研究者总体改善和患者总体自我评估结果比较[例(%)]
讨 论
屈螺酮是目前药理学特性最接近天然孕酮的一种新型孕激素,是17α螺内酯的衍生物,兼具抗盐皮质激素和抗雄激素活性的独特优势[2-4]。3 mg屈螺酮的药理学活性与25 mg螺内酯相当[3]。屈螺酮的抗雄激素机制包括与雄激素受体结合,阻断皮肤雄激素受体(皮脂腺和毛囊)激活;抑制垂体促性腺激素分泌,抑制卵巢雄激素生成。同时,屈螺酮不会抵消雌激素诱导的肝脏性激素结合球蛋白合成,也不会阻断雄激素与性激素结合球蛋白结合[5]。含屈螺酮复方口服避孕药没有其他孕激素类制剂的体液潴留、体重增加、乳房胀痛、恶心、头痛、高血压等不良反应[6-7],没有观察到增加血管血栓栓塞性疾病或心律失常的风险[8-9]。
本研究表明,YAZ 6个周期末治疗中度寻常痤疮女性患者疗效优于安慰剂。全分析集YAZ组和安慰剂组痤疮皮损总数平均减少66.8%和37.7%,符合方案集中分别为72.6%和55.6%;在全分析集中YAZ组和安慰剂组炎性皮损数分别减少75.5%和60.9%,非炎性皮损数分别减少69.3%和50.2%。Maloney 等[10]报道,经过 6 个周期末的治疗,YAZ 组和安慰剂组痤疮皮损总数分别减少46%和31%;炎症皮损减少51%和34%;非炎症皮损减少42%和26%。Koltun等[11]报道,经过6个周期末的治疗,YAZ组和安慰剂组痤疮皮损总数减少42%和25%,炎症皮损减少48%和32%,非炎症皮损减少39%和18%。与上述两项试验相比,本研究中YAZ与安慰剂治疗后患者痤疮皮损总数差异更大。
经过6个周期末的治疗,YAZ组中研究者评定为改善和自我评定为改善的患者百分比均 >安慰剂组。在第6周期末,ISGA量表评定显示YAZ组中49.3%评定为“0”或“1”,而安慰剂组中仅为18.3%,明显高于 Maloney 等[10-11]的报道。
本研究中,未出现严重不良事件。在治疗期间出现与研究药物相关的不良事件发生率YAZ组为25.3%,安慰剂组为4.7%。两组各有2.3%出现导致停药的不良事件。大多数不良事件在研究中不需停药,可自行消退。本研究结果显示,YAZ治疗中国女性中度寻常痤疮是有效和安全的。
声明 本研究由德国拜耳医药保健有限公司资助
[1]Thiboutot DM.Acne.An overview of clinical research findings[J].Dermatol Clin,1997,15(1):97-109.
[2]Fuhrmann U,Krattenmacher R,Slater EP,et al.The novel progestin drospirenone and its natural counterpart progesterone:biochemical profile and antiandrogenic potential [J].Contraception,1996,54(4):243-251.
[3]Krattenmacher R.Drospirenone:pharmacology and pharmacokinetics of a unique progestogen [J].Contraception,2000,62(1):29-38.
[4]Oelkers W,Berger V,Bolik A,et al.Dihydrospirorenone,a new progestogen with antimineralocorticoid activity:effects on ovulation,electrolyte excretion,and the renin-aldosterone system in normal women [J].J Clin Endocrinol Metab,1991,73(4):837-842.
[5]Muhn P,Fuhrmann U,Fritzemeier KH,et al.Drospirenone:a novel progestogen with antimineralocorticoid and antiandrogenic activity[J].Ann N Y Acad Sci,1995,761:311-335.
[6]Bachmann G,Sulak PJ,Sampson-Landers C,et al.Efficacy and safety ofa low-dose 24-day combined oralcontraceptive containing 20 micrograms ethinylestradiol and 3 mg drospirenone[J].Contraception,2004,70(3):191-198.
[7]Klipping C,Marr J.Effects of two combined oral contraceptives containing ethinyl estradiol 20 microg combined with either drospirenone or desogestrel on lipids,hemostatic parameters and carbohydrate metabolism[J].Contraception,2005,71(6):409-416.
[8]Dinger JC,Heinemann LA,Kühl-Habich D.The safety of a drospirenone-containing oral contraceptive:final results from the European Active Surveillance Study on oral contraceptives based on 142,475 women-years of observation[J].Contraception,2007,75(5):344-354.
[9]Seeger JD,Loughlin J,Eng PM,et al.Risk of thromboembolism in women taking ethinylestradiol/drospirenone and other oral contraceptives[J].Obstet Gynecol,2007,110(3):587-593.
[10]Maloney JM,Dietze P Jr,Watson D,et al.Treatment of acne using a 3-milligram drospirenone/20-microgram ethinyl estradiol oral contraceptive administered in a 24/4 regimen:a randomized controlled trial[J].Obstet Gynecol,2008,112(4):773-781.
[11]Koltun W,Lucky AW,Thiboutot D,et al.Efficacy and safety of 3 mg drospirenone/20 mcg ethinylestradiol oral contraceptive administered in 24/4 regimen in the treatment of acne vulgaris:a randomized,double-blind,placebo-controlled trial[J].Contraception,2008,77(4):249-256.
An oral contraceptive containing ethinyl estradiol and drospirenone for the treatment of women with moderate acne vulgaris:a randomized,multicenter,placebo-controlled clinical trial
Zhang Guoyi*,Lin Tong,Sun Qiuning,Li Hengjin,Lai Wei,Gu Jun,Lu Qianjin,Guo Zaipei,Wang Baoxi.*Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China
ObjectiveTo evaluate the efficacy and safety of an oral contraceptive containing ethinyl estradiol and drospirenone (YAZ) in the treatment of women with moderate acne vulgaris.MethodsA multicenter,randomized,double-blind,placebo-controlled clinical trial was conducted.Totally,179 female patients with moderate acne vulgaris were enrolled into this study from 7 research institutions in China,and randomly divided into YAZ group and placebo group by a random number table to be treated by oral YAZ and placebo respectively.In one cycle of treatment,patients administrated YAZ or placebo (one tablet once daily)from the 1stto 24thday of the menstrual cycle followed by a 4-day treatment with inactive tablets.All the patients
six cycles of treatment without a treatmentfree interval.Efficacy and safety were evaluated according to the number of papules,pustules,nodules,open and closed comedones after 1,3 and 6 cycels of treatment and within 8-15 days after the end of treatment.ResultsFinally,173 patients were eligible for the full analysis set (FAS),146 completed the study,and 143 were eligible for the per protocol set(PPS).After 6 cycles of treatment,the total number of lesions was meanly reduced by 66.8%and 37.3%in the YAZ group and placebo group respectively in the FAS,72.6%and 55.6%respectively in the PPS.The number of inflammatory and noninflammatory lesions decreased by 75.5%and 69.3%in the YAZ group respectively after 6 cycles of treatment when compared to baseline,and by 60.9%and 50.2%in the placebo group respectively.The proportion of subjects rated as"improved"by investigators was 93.7%(74/79)in the YAZ group and 78.1%(57/73)in the placebo group.There were no serious adverse events in this study.The incidence rate of adverse reactions was 25.3%(22/87)in the YAZ group,and 4.7% (4/86)in the placebo group.ConclusionSix cycles of treatment with oral YAZ are effective and safe for female patients with moderate acne vulgaris.Trial registration numberClinicalTrials.gov Ref.No:NCT00818519.
Acne vulgaris;Androgen antagonists;Randomized controlled trials;Ethinyl estradiol;Drospirenone;Contraceptive agents,female
Wang Baoxi,Email:wangbx@ncstdlc.org
10.3760/cma.j.issn.0412-4030.2015.02.005
210042南京,中国医学科学院北京协和医学院皮肤病研究所(张国毅、林彤、王宝玺);中国医学科学院北京协和医学院北京协和医院皮肤科(孙秋宁);解放军总医院皮肤科(李恒进);中山大学附属第三医院皮肤科(赖维);上海长海医院皮肤科(顾军);中南大学湘雅二医院皮肤科(陆前进);四川大学华西医院皮肤科(郭在培)
王宝玺,Email:wangbx@ncstdlc.org
2014-07-23)
(本文编辑:尚淑贤)
