苯丙氨酸解氨酶仿生固定化及其稳定性研究
2015-11-04崔建东梁龙昊刘容麟河北省发酵工程技术研究中心生物科学与工程学院河北科技大学河北石家庄050000
崔建东,梁龙昊,韩 丛,刘容麟(河北省发酵工程技术研究中心,生物科学与工程学院,河北科技大学,河北石家庄050000)
苯丙氨酸解氨酶仿生固定化及其稳定性研究
崔建东,梁龙昊,韩丛,刘容麟
(河北省发酵工程技术研究中心,生物科学与工程学院,河北科技大学,河北石家庄050000)
利用仿生硅化技术包埋固定化苯丙氨酸解氨酶(PAL),研究固定化条件对PAL固定化的影响及固定化PAL的稳定性。优化的固定化酶制备条件:0.06 mL浓度为6 mg/mL诱导剂聚乙烯亚胺(PEI),25 mmol/L磷酸盐(pH7.0)作为固定化反应介质体系,2 mL浓度为1 mol/L正硅酸甲酯(TMOS)水解液和1 mL(2 U/mL)酶液添加量,所得固定化酶的酶活最大回收率是70%。与游离酶相比,固定化PAL的温度稳定性、pH和储存稳定性,以及变性剂耐受性都有较大提高,重复使用5次,固定化PAL仍能保持初始酶活的40%。
苯丙氨酸解氨酶,仿生硅化,氧化硅,固定化酶,聚乙烯亚胺
苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)是连接初级代谢和苯丙烷类代谢、催化苯丙烷类代谢第一步反应的酶,是苯丙烷类代谢的关键酶和限速酶[1]。存在于各种植物和少数微生物中,PAL可催化L-苯丙氨酸脱氨生成反式肉桂酸,具有广泛的医药和工业应用价值。在医药方面主要被用来治疗某些肿瘤,还可以诊断和治疗苯丙酮尿症[2];在生物化工领域被用来酶法生产L-苯丙氨酸。但在应用过程中,该酶表现出较低的酶活和稳定性,限制了其广泛应用。
仿生矿化技术是近年发展起来的一种新的固定化酶方法。该技术是人们通过模拟自然界某些生物体能够在常温下精确控制体内矿物的形成而发展起来的一种技术。与传统固定化酶方法相比,该技术避免了固定化过程中酸碱催化剂、高速搅拌以及高温等对酶分子天然活性构象的破坏,有利于酶活保留。且反应条件温和、快速,目前已经被成功应用在氨基酸氧化酶[3]、脂肪酶[4]、碳酸酐酶[5]等多种酶的固定化中。但关于仿生硅化过程用于PAL固定化方面尚未见报道。
本研究以聚乙烯亚胺为诱导剂,通过模拟仿生硅化过程,将仿生硅化用于PAL的固定化,优化了固定化制备条件,并考察了固定化PAL的催化稳定性。
1 材料与方法
1.1材料与仪器
粘红酵母(Rhodotorula gluinis)中国工业微生物菌种保藏管理中心(CICC32913);聚乙烯亚胺(PEI) 阿拉丁试剂(上海)有限公司;正硅酸甲酯(TMOS)阿拉丁试剂(上海)有限公司;反式肉桂酸阿拉丁试剂(上海)有限公司;其他试剂均为市售分析纯。
S-4800-Ⅰ型场发射扫描电子显微镜日本HITACHI;752型紫外分光光度计上海光谱仪器有限公司;TGL-16C型离心机上海安亭科学仪器厂;HC-3018型高速离心机安徽中科中佳科学仪器有限公司;85-1B磁力搅拌器巩义市予华仪器有限责任公司;FD-27真空冷冻干燥机北京德天佑科技发展有限公司。
1.2实验方法
1.2.1PAL的提取将粘红酵母接于培养基(葡萄糖5 g/L,蛋白胨10 g/L,NaCl 5 g/L,KH2PO40.5 g/L,(NH4)2HPO41 g/L,L-苯丙氨酸0.5 g/L,pH5.5)中,在28℃,150 r/min条件下发酵培养21 h,培养后的粘红酵母利用微珠涡流法进行细胞破碎提取PAL粗酶液[6]。
1.2.2仿生硅化固定化苯丙氨酸解氨酶取0.152 g TMOS与1 mmol/L盐酸溶液混合,振荡10 min,制得浓度为1 mol/L TMOS水解液。取一定量的PAL酶(溶解在25 mmol/L磷酸盐,pH7.0)与一定量的PEI充分混匀后,加入浓度为1 mol/L TMOS水解液,混合5 min后,混合物经10000×g离心5 min,得到的沉淀物用去离子水洗涤3次,即得固定化PAL。
1.2.3单因素实验优化固定化PAL制备条件在粗酶液量1 mg/mL、PEI浓度是6 mg/mL条件下,考察TMOS水解液浓度(0.5、0.8、1、1.2、1.5 mmol/L)对固定化PAL酶活回收率的影响;在粗酶液量1 mg/mL、TMOS浓度是1 mmol/L条件下,考察不同PEI浓度(2、4、6、8、10 mg/mL)对固定化PAL酶活回收率的影响;在TMOS浓度是1 mmol/L、PEI浓度是6 mg/mL条件下,考察粗酶液量(0.2、0.5、0.8、1、1.2 mg/mL)对固定化PAL酶活回收率的影响;在粗酶液量1 mg/mL、TMOS浓度是1 mmol/L、PEI浓度是6 mg/mL条件下,考察不同缓冲液体系(25 mmol/L Tris-HCl,pH7.0,25 mmol/L磷酸盐,pH7.0或去离子水)对固定化PAL酶活回收率的影响。
1.2.4固定化PAL的形态观察固定化PAL样品经真空冷冻干燥后,在真空条件下喷铂金后利用电子扫描显微镜(电子发射电压60~100 kV)检测。
1.2.5酶活测定方法以紫外分光光度法测定PAL的酶活[7]。酶促反应液包括0.1 g的酶样品,2.5 mL 50 mmol/L L-苯丙氨酸和2 mL 25 mmol/L Tris-HCl,pH8.8,在30℃振荡保温10 min,然后加入0.2 mL 6 mol/L盐酸终止反应。10000×g离心5 min,取上清在278 nm下测吸光值。根据反式肉桂酸标准曲线方程:Y= 14.083X-0.5621,R2=0.9999,计算酶活。一个酶活力单位定义为每分钟催化L-苯丙氨酸生成1 μmol反式肉桂酸的酶量。
1.2.6酶活回收率

1.2.7固定化PAL的稳定性考察对于温度稳定性,将游离酶和固定化PAL分别置于60℃下处理15、30、45、60 min后,分别检测酶活。对于pH稳定性,将游离酶和固定化PAL分别置于pH为3、5、7、8和11的缓冲液中处理30 min后,检测酶活。对于变性剂稳定性,将游离酶和固定化PAL分别置于2%SDS、20%乙醇和6 mol/L尿素中处理15 min,检测酶活。对于储存稳定性,将游离酶和固定化PAL分别保存在25 mmol/L磷酸盐(pH7.0)中,于25℃放置1、5、15、25 d,并在相对应的储存时间检测酶活。
1.2.8固定化PAL的重复使用稳定性考察转化液的配制[8]:740 mg反式肉桂酸溶解到45 mL氨水(0.28 mol/L)中,用硫酸调pH为10,去离子水定容到100 mL。
重复使用稳定性实验:将固定化PAL与转化液按照1∶4(v/v)在30℃条件下进行第一轮转化反应,转化1 h后,10000×g离心5 min分离出固定化酶,用Tris-HCl(pH8.8)缓冲液洗涤后,在固定化酶中加入新的转化液进行第二轮转化,依此分批转化,每次转化后分别检测固定化酶剩余的酶活。直到检测不到酶活为止。
1.2.9统计分析所有实验重复进行3次,利用SAS软件(v8.0)进行统计分析。
2 结果与分析
2.1固定化PAL制备条件优化
2.1.1TMOS水解液浓度对固定化酶的影响从图1可以得出,TMOS水解液浓度对固定化PAL酶活有显著影响(p<0.05),随着TMOS水解液浓度的增加,固定化酶的酶活回收率增加;在TMOS水解液浓度为1 mol/L时,酶活回收率最高;但随着TMOS水解液浓度的进一步增加,酶活回收率开始下降。这可能是由于反应体系中PEI的浓度一定,PEI只能催化聚合一定量的TMOS形成氧化硅,对游离酶进行包埋,但当TMOS浓度过大时,剩余的TMOS不能被PEI催化聚合形成氧化硅,导致对PAL的包埋率下降,使酶活回收率降低[4]。
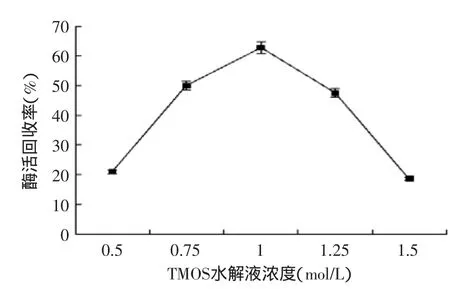
图1 TMOS水解液浓度对酶活的影响Fig.1 Effect of TMOS concentration on activity
2.1.2PEI浓度对固定化酶的影响由图2可以看出,随着PEI浓度增加,固定化酶的酶活也在增加,当PEI浓度达到6 mg/mL时,酶活回收率达到最高,而随着PEI浓度的继续增加,酶活开始下降。这可能是由于TMOS硅前体的量一定,PEI只能沉淀一定量的硅胶对酶进行包埋,而过剩的PEI对酶形成静电屏障,使酶无法与硅前驱体相互吸引,导致包埋效率降低[4],从而使酶活回收率下降。
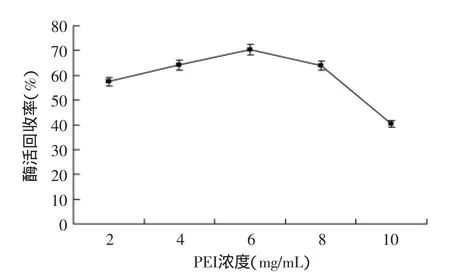
图2 PEI浓度对酶活的影响Fig.2 Effect of PEI concentration on on activity
2.1.3酶量对固定化酶的影响从图3可知,当PAL酶量小于1 mg/mL时,随着酶浓度的增加,固定化酶的酶活回收率增加,当酶浓度达到1 mg/mL时,酶活回收率达到最高,达到70%以上。但当酶浓度高于1 mg/mL时,固定化酶的酶活回收率并没有继续显著增加(p>0.05),反而有所降低。这是由于当酶浓度过高时,多余的酶分子不能被包埋在硅胶中,且酶浓度过高也会使纳米级氧化硅载体包埋过量的酶分子,使被包埋的酶分子无法正常伸展形成正确的空间构象[9],导致固定化酶酶活有所下降。

图3 酶量对固定化酶酶活的影响Fig.3 Effect of PAL concentration on activity
2.1.4不同缓冲液体系对固定化酶的影响研究表明,仿生硅化过程中,反应介质对诱导形成的仿生氧化硅的形态有较大影响[10],而氧化硅载体形态又会直接影响固定化酶的最终酶活。结果见图4,当用磷酸盐作为反应介质时,固定化酶的酶活回收率最高,而水作为反应介质时固定化酶的酶活回收率最低,可能是由于缓冲液中的阴离子充当了离子交联剂,促进带正电的PEI与酶分子通过分子间或分子内静电作用自组装形成聚合体,进而为硅前体的缩聚提供模板[10],使酶分子更多的包埋在硅胶中。
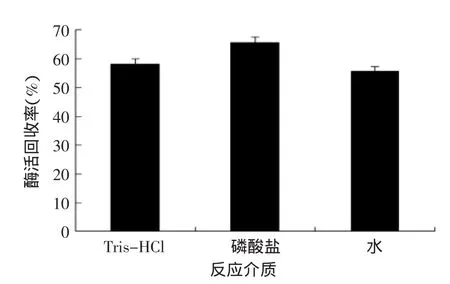
图4 不同缓冲液对固定化酶酶活的影响Fig.4 Effect of buffer on activity
2.2固定化PAL扫描电镜形态观察
图5是扫描电镜观察的固定化PAL的图片。从图5中可以看出,在同样的标尺下(500 nm),当没有包埋酶分子时,PEI诱导TMOS硅前体所形成的氧化硅颗粒非常小,大致呈微球型,颗粒与颗粒之间团聚的非常致密(图5A)。而包埋有PAL的固定化酶氧化硅颗粒明显增加,呈现出较大的球形颗粒,且颗粒之间出现较多空隙(图5B)。说明在固定化过程中,酶的加入有助于阻止硅前体缩合形成的颗粒进一步相互连接团聚。这种较疏松的结构有利于酶促反应过程中底物和产物的传递。

图5 固定化酶的电镜图片(105×)Fig.5 SEM images(105×)
2.3固定化PAL催化稳定性
2.3.1固定化PAL温度稳定性图6是固定化PAL的温度稳定性实验结果。图6表明,与游离酶相比,固定化酶具有更高的耐受高温的能力。在60℃下处理30 min时,游离酶损失了初始酶活的50%以上,而固定化酶仅损失了20%左右的酶活;当处理1 h后,游离酶几乎丧失了所有酶活,而固定化酶却还能保留40%以上的酶活。说明当酶分子被包埋在仿生氧化硅中后,酶分子的天然空间构象得以保持[11],特别是由于有氧化硅的外层保护,温度的传递速度减缓,使高的温度不能直接作用于酶分子,从而降低了酶的失活率。
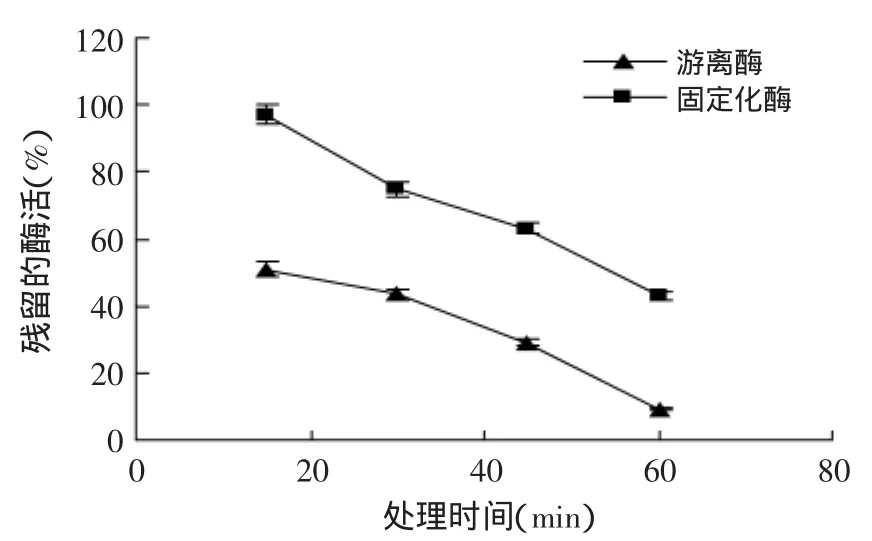
图6 固定化PAL的温度稳定性Fig.6 Thermostability of encapsulated PAL
2.3.2固定化酶pH稳定性图7是固定化酶的pH稳定性实验结果。图7表明,固定化酶耐受极端pH的能力明显高于游离酶;游离酶在pH3~8时均有一定的酶活保留率,但固定化酶的酶活保留率要高于游离酶;当趋向于强碱条件时,游离酶酶活损失较大,而固定化酶却能保留较高的酶活;在pH11的条件下处理30 min,游离酶仅能保留47%的酶活,而固定化酶基本不失活。这可能是由于PAL被包埋在氧化硅载体中后,防止了极端pH条件下大量OH-和H+对酶分子的攻击,使酶活性中心的结构保持下来,保护酶不失活[12]。
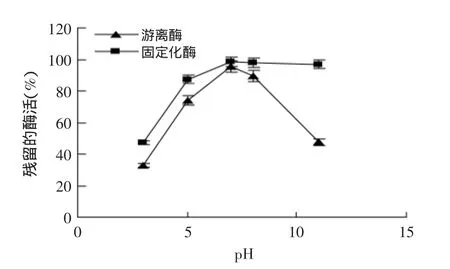
图7 固定化PAL的pH稳定性Fig.7 pH-stability of encapsulated PAL
2.3.3固定化酶变性剂稳定性图8是固定化酶对变性剂的稳定性实验结果。图8表明,在变性剂作用下,游离酶和固定化酶都有不同程度的失活,但固定化酶表现出对变性剂更高的耐受性。特别是当用2% SDS处理30 min后,游离酶基本失活,只能残留12%的酶活,但固定化酶还能保留47%的酶活。固定化酶对变性剂的耐受可能是由于游离的酶分子被包埋在仿生氧化硅载体中,氧化硅载体阻碍了变性剂与酶分子的直接接触,使酶分子的活性结构得以保持,导致酶活被保留下来[4,13]。

图8 固定化PAL的变性剂稳定性Fig.8 Encapsulated PAL against denaturants
2.3.4固定化酶储存稳定性固定化酶的储存稳定性是评价固定化酶应用价值的重要指标[13]。图9是固定化PAL储存稳定性实验结果,在储存过程中,游离酶和固定化酶酶活都有所下降,但固定化酶储存稳定性显著优于游离酶(p<0.05),在储存到第25 d时,游离酶已经完全失活,但固定化酶还能保留24%的酶活。说明PAL经过仿生硅化固定化后储存稳定性有显著改善,这个结果和张羽飞[14]的研究结果一致。

图9 固定化PAL的储存稳定性Fig.9 Storage stability of encapsulated PAL
2.4固定化PAL重复使用性
图10是固定化酶的重复使用稳定性实验结果。图10表明,经过仿生硅化包埋的PAL具有一定的重复使用稳定性,连续重复使用5次后固定化酶仍然能保留近40%的酶活。但是,使用到第7次后,固定化酶基本检测不到酶活。这可能是由于仿生硅化包埋的PAL的颗粒是纳米级的,颗粒较小,在反复离心回收过程中,部分颗粒太小的固定化酶难以回收,导致损失,同时高速离心产生的剪切力也会使固定化酶颗粒被打碎,使酶泄漏,导致酶活损失。

图10 固定化酶重复使用稳定性Fig.10 Recycling stability of encapsulated PAL
3 结论
本研究首次将温和的仿生硅化过程用于PAL酶的固定化,固定化的最佳条件是:0.06 mL浓度为6 mg/mL聚乙烯亚胺作为诱导剂,25 mmol/L磷酸盐(pH7.0)作为固定化的反应介质体系,2 mL浓度为1 mol/L正硅酸甲酯水解液和酶液添加量1 mg/mL(2 U/mL),所得固定化酶的酶活最大回收率是70%。与游离酶相比,固定化酶表现出优越的温度、pH、变性剂和储存稳定性,此外,固定化酶还具有一定的重复使用稳定性,在连续重复使用5批次后,固定化酶还能保持初始酶活的近40%。上述结果表明这种固参考文献
定化酶方法在工业应用中具有较好的实用前景。
[1]崔建东,李艳,牟德华.苯丙氨酸解氨酶(PAL)的研究进展[J].食品工业科技,2008(7):306-308.
[2]贺立红,张进标,宾金华.苯丙氨酸解氨酶的研究进展[J].食品科技,2006(7):31-34.
[3]Kuan I C,Wu J Ch,Lee Sh L,et al.Stabilization of D-amino acid oxidase from Rhodosporidium toruloides by encapsulation in polyallylamine-mediatedbiomimeticsilica[J].Biochemical Engineering Journal,2010,49:408-413.
[4]王静云,马翠丽,包永明.脂肪酶仿生固定化及性质[J].分子催化,2011(4):341-347.
[5]Forsyth C,Yip T W S,Siddharth V,et al.CO2sequestration by enzyme immobilized onto bioinspired silica[J].Chemical Communications,2013,49:3191-3193.
[6]Cui J D,Zhang S,Sun L M.Cross-linked enzyme aggregates of phenylalanine ammonia lyase:novel biocatalysts for synthesis of L-Phenylalanine[J].Applied Biochemistry and Biotechnology,2012,167:835-844.
[7]江柯.粘红酵母(Rhodotorula glutinis)CIBAS A1401苯丙氨酸解氨酶(PAL)的分离纯化与性质研究[D].四川:四川大学,2004.
[8]李连连,崔建东.以大孔硅胶为载体的苯丙氨酸解氨酶交联酶聚体的制备及性质研究[J].食品工业科技,2014(11):160-165.
[9]Wang J Y,Ma C L,Bao Y M,et al.Lipase entrapment in protamine-induced bio-zirconia particles:characterization and application to the resolution of(R,S)-1-phenylethanol[J]. Enzyme and Microbial Technology,2012,51:40-46.
[10]Kroger N,Lorenz S,Brinner E.Self-assembly of highly phosphorylatedsilaffinsandtheirfunctioninbiosilica morphogenesis[J].Science,2002,298:584-586.
[11]李林.仿生氧化硅凝胶固定化D-葡萄糖醛酸苷酶的研究[D].天津:天津大学,2008.
[12]Avnir D,Coradin T,Lev O.Recent bio-applications of sol-gel materials[J].Material Chemistry,2006,16:1013-1030.
[13]Zhou Y L,Wang C,Jiang Y J,et al.Immobilization of papain in biosilica matrix and its catalytic property[J].Chinese journal of Chemical Engineering,2013,21:670-675.
[14]张羽飞.仿生固定化酶制备及其催化特性研究[D].天津:天津大学,2008.
Immobilization of phenylalanine ammonia lyase by biomimetic silica and its stability
CUI Jian-dong,LIANG Long-hao,HAN Cong,LIU Rong-lin
(Research Center for Fermentation Engineering of Hebei,College of Bioscience and Bioengineering,Hebei University of Science and Technology,Shijiazhuang 050000,China)
In this study,phenylalanine ammonia lyase(PAL)was encapsulated by in polyallylamine-mediated biomimetic silica.The conditions for the preparation of encapsulated PAL were optimized.Moreover,stability of the encapsulated PAL was examined.The optimal activity recovery(70%)of PAL were achieved when 0.06 mL polyallylamine(PEI)of 6 mg/mL,2 mL tetramethoxysilane(TMOS)of 1 mol/L and 1 mL PAL(2 U/mL)in 25 mmol/L phosphate buffer(pH7.0)were used.Compared with free PAL,the encapsulated PAL showed better properties in pH,thermal and storage stabilities,as well as the tolerance abilities against denaturants.In additional,the encapsulated PAL still retained 40%of its initial activity after consecutive 5 cycles.
phenylalanine ammonia lyase;biomimetic silica;monox;Immobilization enzyme;polyethyleneimine
TS202.3
A
1002-0306(2015)18-0193-05
10.13386/j.issn1002-0306.2015.18.030
2015-01-20
崔建东(1974-),男,博士,教授,研究方向:生物催化与微生物资源开发,E-mail:cjd007cn@163.com。
国家自然科学基金(21072041);河北省自然科学基金(B2014208054)。
