HPLC法同时测定枣叶中5种黄酮的含量
2015-11-04李喜悦王荣芳安小楠河北农业大学食品科技学院河北保定071000
李喜悦,高 哲,王荣芳,崔 璨,安小楠,崔 同(河北农业大学食品科技学院,河北保定071000)
HPLC法同时测定枣叶中5种黄酮的含量
李喜悦,高哲,王荣芳,崔璨,安小楠,崔同*
(河北农业大学食品科技学院,河北保定071000)
建立了一种枣叶中黄酮类成分定量分析的HPLC方法,并对14个品种的大枣及酸枣叶中这5种黄酮的含量进行了分析。结果得到采用Hypersil BDS C18色谱柱,以乙腈与0.1%甲酸水溶液为流动相梯度洗脱,流速1 mL/min,柱温30℃,检测波长360 nm,实现了槲皮素-3-O-洋槐糖苷、芦丁、槲皮素-3-O-β-D-葡萄糖苷、山奈酚-3-O-芸香糖苷、槲皮素-3-O-α-L-阿拉伯糖-(1→2)-α-L-鼠李糖苷5种黄酮苷的同时检测,最低检出限为1.44~2.59 μg/mL,加标回收率在93.8%~105.9%之间。5种黄酮苷的含量测定结果表明不同品种的枣叶中黄酮类成分的组成和含量差异较大,其中芦丁和槲皮素-3-O-洋槐糖苷的含量较高,平均为7.83 mg/g D.W和4.61 mg/g D.W;8个品种枣叶中检测到槲皮素-3-O-α-L-阿拉伯糖-(1→2)-α-L-鼠李糖苷,平均5.32 mg/g D.W;而槲皮素-3-O-β-D-葡萄糖苷和山奈酚-3-O-芸香糖苷的含量较低,分别为0.14 mg/g D.W和0.41 mg/g D.W。
HPLC,枣叶,黄酮,芦丁,槲皮素-3-O-洋槐糖苷
枣叶是鼠李科(Rhamnaceae)枣属植物枣(Ziziphus Jujuba Mill.)和酸枣[Ziziphus jujuba Mill.var.spinosa(Bunge)Hu ex H.F.Chow]的叶子。据《日华子本草》记载,枣叶性味“温,无毒”。而据《本草纲目》记载,酸枣叶可“敛疮解毒,治胫臁疮”。
据报道,黄酮类成分是枣叶中含量较高的活性成分[1-3],然而目前对枣叶中黄酮类成分定量分析方面的研究并不多见。李兰芳等[4]采用薄层扫描法测定了不同采收期酸枣叶中芦丁的含量。裴香萍等[5]利用HPLC法测定了不同产地、不同采收期酸枣叶中芦丁的含量,但其采用的色谱条件没有将芦丁与其前面的色谱峰有效分离。张倩倩等[6]经DAD检测发现芦丁与其色谱峰前面的组分不是同一种化学成分,但并没有进一步确证其化学结构。Guo Sheng等[1]建立了同时测定3种黄酮(芦丁、槲皮素-3-O-α-L-阿拉伯糖-(1→2)-α-L-鼠李糖苷、槲皮素-3-O-β-D-木糖-(1→2)-α-L-鼠李糖苷)以及2种皂苷和9种三萜的HPLC-ELSD分析方法,但是需要使用特殊的检测器。最近本实验室研究结果表明,大枣和酸枣的叶中有多种黄酮苷类成分,对其中5种含量较高的黄酮苷进行了分离纯化和结构鉴定[7]。本研究拟在前期研究基础上,建立一种同时测定枣叶中这5种黄酮含量的HPLC方法,并对不同品种的大枣及酸枣叶中的这5种黄酮的含量进行测定,为枣叶资源开发利用及相关产品质量控制提供新的检测手段。
1 材料与方法
1.1材料与仪器
枣叶样品共计14个品种(大酸枣、冬枣、赞皇大枣、敦煌大枣、大木枣、金丝小枣、串铃、茶壶枣、无核枣、梨枣、晋枣、宣城圆枣、板枣、连县木枣),均采自河北省沧县国家枣树良种繁育基地,采样时间为2013年10月7日,采回后经真空冷冻干燥,放置在真空干燥器中备用;对照品:槲皮素-3-O-洋槐糖苷、芦丁(槲皮素-3-O-芸香糖苷)、槲皮素-3-O-β-D-葡萄糖苷、山奈酚-3-O-芸香糖苷、槲皮素-3-O-α-L-阿拉伯糖-(1→2)-α-L-鼠李糖苷均由本实验室从枣叶中分离提纯,经HPLC-ESI-MS、1H-NMR和13C-NMR法鉴定[7]并与相关文献[8-11]对比得到确证,通过HPLC峰面积归一化法测得其纯度≥95%;乙腈Honeywell Burdick&Jackson公司,色谱纯,高效液相色谱(HPLC)流动相用;纯净水杭州娃哈哈集团有限公司;其余试剂为分析纯。
Agilent 1200型HPLC由在线脱气机,四元输液泵,光电二极管阵列检测器以及Agilent Chemstation色谱工作站组成,Agilent公司;配用CO-3010柱恒温控制箱天津美瑞泰克科技有限公司;Hypersil BDS C18(4.6 mm×250 mm,5 μm)、Thermo Hypersil BDS C18(4.6 mm×250 mm,5 μm)、Lab Alliance Kromasil C18(4.6 mm×250 mm,5 μm)色谱柱大连依利特公司;TB-215D型微量分析天平德国赛多利斯股份有限公司;SK5200H型超声振动仪上海波龙电子设备有限公司;FD-1B-50型冷冻干燥机北京博医康实验仪器有限公司;Anke TDL-5型离心机上海安亭科学仪器厂。
1.2实验方法
1.2.1样品前处理考察不同的提取溶剂:80%甲醇、50%甲醇、70%乙醇、95%乙醇的提取效果。准确称取冻干的枣叶样品1.000 g,放入研钵中,加入20 mL上述四种提取溶剂,研磨均匀后转移至25 mL容量瓶中,超声波(80 W)提取30 min,用提取溶剂定容,静置3 min,取部分上清液于离心机上4000 r/min离心5 min,经0.45 μm滤膜过滤,用于HPLC测定。
1.2.2HPLC分析条件的选择比较Hypersil BDS C18(4.6 mm×250 mm,5 μm),Thermo Hypersil BDS C18(4.6 mm×250 mm,5 μm),Lab Alliance Kromasil C18(4.6 mm×250 mm,5 μm)三种不同色谱柱的分离效果;比较甲醇-0.05%甲酸、甲醇-0.1%甲酸、乙腈-0.05%甲酸、乙腈-0.1%甲酸等不同流动相及不同的梯度洗脱程序;分析5种黄酮的检测波长(扫描范围210~400 nm),确定最合适的检测波长。
1.2.3HPLC分析条件色谱柱Hypersil BDS C18(4.6 mm×250 mm,5 μm);流动相:A:1 mL/L甲酸水溶液;B:乙腈含1 mL/L的甲酸;梯度洗脱程序:0~16 min,15%B;16~20 min,15%~17%B;20~28 min,17%B;28~30 min,17%~22%B;30~35 min,22%~100%B;35~40 min,100%B;40~42 min,100%~15%B;42~52 min,15%B;流速为1 mL/min;柱温30℃;DAD检测器,检测波长360 nm;进样量:10 μL。
1.2.4标准溶液的配制与曲线的绘制精确称取槲皮素-3-O-洋槐糖苷、芦丁、槲皮素-3-O-β-D-葡萄糖苷、山奈酚-3-O-芸香糖苷、槲皮素-3-O-α-L-阿拉伯糖-(1→2)-α-L-鼠李糖苷对照品溶于甲醇中,配制成1000 μg/mL的混合对照品贮备液。精密吸取贮备液,分别稀释成500、250、100、50、10 μg/mL的混标溶液,置于样品瓶中,4℃保存待用。按照1.2.3的色谱条件进行HPLC测定,以进样浓度(X,μg/mL)为横坐标,峰面积(Y,mv·s)为纵坐标,求出直线回归方程,绘制标准曲线。
1.3数据处理
数据统计及处理软件为Origin 6.0。
2 结果与分析
2.1提取溶剂的选择
结果表明,采用70%乙醇作为提取溶剂时,5种黄酮类成分的峰面积均达到最大值,因此,确定70%乙醇水溶液为枣叶黄酮的提取溶剂。
2.2色谱柱及填料的比较
结果表明,尽管3种色谱柱的装填尺寸相同,但使用Lab Alliance Kromasil C18色谱柱时槲皮素-3-O-洋槐糖苷与芦丁会重合为一个峰,而使用Thermo Hypersil BDS C18色谱柱时,山奈酚-3-O-芸香糖苷与槲皮素-3-O-α-L-阿拉伯糖-(1→2)-α-L-鼠李糖苷不能实现基线分离,而Hypersil BDS C18(4.6 mm× 250 mm,5 μm)色谱柱对5种黄酮均能实现很好的分离。
2.3检测波长的选择
鉴于实验中5种黄酮苷成分母核骨架为槲皮素或山奈酚,在此仅列出槲皮素-3-O-洋槐糖苷和山奈酚-3-O-芸香糖苷的紫外吸收光谱图,见图1,由图1可以看出,紫外吸收光谱接近一致,分别在255~265 nm和355~360 nm有2个强吸收带,且360 nm吸收带更强,为提高方法的灵敏度,减少干扰,本实验选择波长更长的360 nm为检测波长,使各组分均能得到较高的响应值。
2.4流动相的选择
结果显示,当用甲醇-水作为流动相梯度洗脱时,槲皮素-3-O-洋槐糖苷与芦丁会重合为一个峰,不能实现分离。样品用乙腈和水并按照上述1.2.3的梯度程序洗脱时,目标峰之间分离效果以及灵敏度均较好,所得色谱图基线平稳。由于黄酮苷属于多酚类成分,流动相中加入适量的酸可抑制拖尾,改善峰形,从而提高组分的分离度,因此实验采用含0.1%甲酸的乙腈水溶液为流动相,采用15%乙腈的洗脱强度,16 min的等度洗脱,使难分离组分槲皮素-3-O-洋槐糖苷和芦丁实现了分离,而在随后的梯度洗脱条件下,样品中的其他3种黄酮也都实现了基线分离。5种对照品和晋枣枣叶样品的色谱图见图2。由图2可以看到,在选定的分析条件下,样品中的5种黄酮的色谱峰与其他杂峰在30 min内实现了良好分离,峰形对称不拖尾。

图1 槲皮素-3-O-洋槐糖苷(A)和山奈酚-3-O-芸香糖苷(B)的紫外吸收光谱图Fig.1 UV absorption spectra of quercetin 3-O-robinobioside(A)and kaempferol-3-O-rutinoside(B)

图2 5种黄酮混合对照品(A)和晋枣枣叶样品(B)的HPLC图Fig.2 HPLC profile of flavonoid references(A)and jujube leaves sample(B)
2.5HPLC分析方法的评价
2.5.1精密度实验取混合对照品溶液(槲皮素-3-O-洋槐糖苷、芦丁、槲皮素-3-O-β-D-葡萄糖苷、山奈酚-3-O-芸香糖苷、槲皮素-3-O-α-L-阿拉伯糖-(1→2)-α-L-鼠李糖苷的质量浓度均为0.25 μg/mL),按1.2.3中的色谱条件重复进样分析,平行进样5次,统计色谱峰的面积,计算相对标准偏差以评价方法的精密度,结果见表1,相对标准偏差(RSD)在0.59%~1.14%之间,表明仪器精密度良好。

表1 方法精密度的评价结果Table 1 Evaluation of the precision
2.5.2方法的回归方程、线性范围和最低检出限按1.2.4步骤配制混合对照品系列标准溶液,按1.2.3色谱条件在10~1000 μg/mL浓度范围进样分析,评价方法的线性回归方程、相关系数和线性范围,并以3倍信噪比所对应的进样浓度求得最低检出限,结果列于表2。结果表明,响应值与进样量之间具有良好线性相关性,相关系数介于0.9996~0.9999之间,最低检出限较低(1.44~2.59 μg/mL),可以满足常规样品的定量分析。
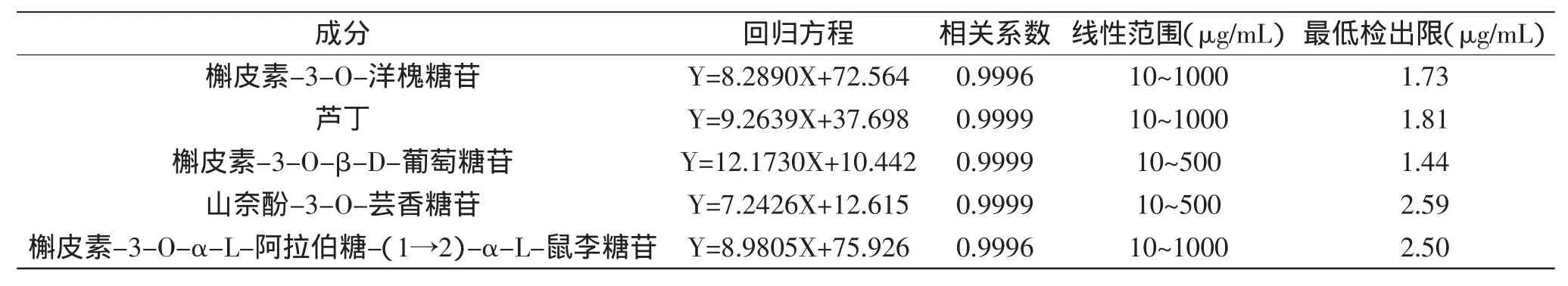
表2 回归方程、相关系数、线性范围和最低检出限Table 2 The regression equation,correlation coefficient,linear range and minimum detection limit
2.5.3方法的加标回收率实验分别准确称取已知质量的对照品,按其在枣叶中常规含量确定相应的加标水平,并以枣叶(冬枣)为样品按1.2.1所述方法进行处理,平行做5份加标实验,并按1.2.3中的色谱条件分别测定未加标样品和加标样品,进行分析。统计计算各成分的加标回收率,结果见表3。结果表明,5种黄酮的回收率介于93.8%~105.9%之间,RSD为0.84%~2.42%,回收率均较高,可满足常规定量分析需要。

表3 5种黄酮的加标回收率Table 3 Recoveries of 5 flavonoids
2.6不同品种枣叶中5种黄酮的含量测定
按照1.2所述的方法,对秋季采集的14个品种枣叶中5种黄酮的含量进行分析,结果见表4。
表4 不同品种枣叶中5种黄酮的含量测定结果(±SD,mg/g D.W)Table 4 Determination results of 5 flavonoids content in jujube leaves among different cultivars(±SD,mg/g D.W)

表4 不同品种枣叶中5种黄酮的含量测定结果(±SD,mg/g D.W)Table 4 Determination results of 5 flavonoids content in jujube leaves among different cultivars(±SD,mg/g D.W)
注:-表示未检出。
品种 槲皮素-3-O-洋槐糖苷 芦丁 槲皮素-3-O-β-D-葡萄糖苷山奈酚-3-O-芸香糖苷槲皮素-3-O-α-L-阿拉伯糖-(1→2)-α-L-鼠李糖苷大酸枣 5.39±0.10 8.89±0.12 0.17±0.01 0.41±0.01 6.96±0.14冬枣 3.82±0.10 3.84±0.08 0.07±0.01 0.66±0.03 3.59±0.03赞皇大枣 1.26±0.03 1.68±0.03 0.07±0.01 0.07±0.01 3.27±0.08敦煌大枣 2.68±0.09 4.80±0.17 0.08±0.01 0.08±0.01 -大木枣 3.06±0.14 5.23±0.06 0.11±0.01 0.40±0.01 5.23±0.16金丝小枣 4.33±0.11 6.35±0.16 0.18±0.01 0.41±0.01 6.86±0.11串铃 8.21±0.22 16.07±0.48 0.18±0.02 0.50±0.02 -茶壶枣 8.24±0.20 12.12±0.23 0.18±0.01 0.35±0.01 -无核枣 2.82±0.13 3.00±0.18 0.15±0.02 0.28±0.03 4.49±0.35梨枣 9.16±0.28 15.13±0.38 0.34±0.02 0.17±0.02 -晋枣 2.64±0.12 3.67±0.16 0.10±0.01 0.43±0.03 4.12±0.12宣城圆枣 1.98±0.15 4.86±0.13 0.13±0.01 0.26±0.02 -板枣 5.74±0.07 15.81±0.08 0.10±0.01 1.08±0.03 -连县木枣 5.17±0.10 8.16±0.20 0.10±0.01 0.65±0.04 8.05±0.10平均值 4.61±0.13 7.83±0.18 0.14±0.01 0.41±0.02 5.32±0.14
由表4可以看出,在14个不同品种的枣叶中均检测出槲皮素-3-O-洋槐糖苷、芦丁、槲皮素-3-O-β-D-葡萄糖苷、山奈酚-3-O-芸香糖苷4种黄酮,但其含量存在较大差异。14个品种枣叶中芦丁的含量最高,平均7.83 mg/g,其中串铃、梨枣和板枣中的含量高达15~16mg/g;在本研究中由于实现了槲皮素-3-O-洋槐糖苷与芦丁的分离,使得前者的含量可以单独进行统计,其在14个品种中的含量仅次于芦丁,平均4.61 mg/g,在串铃、茶壶枣和梨枣中其含量均超过8 mg/g,是枣叶中的重要黄酮成分。槲皮素-3-O-α-L-阿拉伯糖-(1→2)-α-L-鼠李糖苷是一种特殊的黄酮成分,仅在8个品种中检出,平均含量为5.32 mg/g。其余2种黄酮,槲皮素-3-O-β-D-葡萄糖苷和山奈酚-3-O-芸香糖苷,在14个品种枣叶中含量较低,平均值分别为0.14和0.41 mg/g。
3 结论
本文建立了一种同时测定枣叶中5种黄酮的反相高效液相色谱法,通过对色谱条件的优化,在选定的分析条件下,5种黄酮在30 min内实现了良好的分离,且该方法最低检出限较低(1.44~2.59 μg/mL),加标回收率均在93%以上。该方法简单准确、灵敏、重复性好,可用于枣叶中黄酮成分的定量分析。采用建立的方法对14个不同品种枣叶5种黄酮的含量进行了分析,结果表明,不同品种枣叶中这些黄酮类成分的组成和含量有较大差异,芦丁和槲皮素-3-O-洋槐糖苷是枣叶中含量最高的两种黄酮。
[1]Guo S,Duan J A,Tang Y P,et al.Simultaneous qualitative and quantitative analysis of triterpenic acids,saponins and flavonoids in the leaves of two Ziziphus species by HPLC-PDAMS/ELSD[J].J Pharm Biomed Anal,2011,56(2):264-270.
[2]Zhang R,Chen J,Shi Q,et al.Quality control method for commercially available wild jujube leaf tea based on HPLC characteristic fingerprint analysis of flavonoid compounds[J].J Sep Sci,2014,37(1-2):45-52.
[3]Zhang R,Chen J,Shi Q,et al.Phytochemical analysis of Chinese commercial available Ziziphus jujube leaf tea using high performance liquid chromatography-electrospray ionization-time[4]李兰芳,赵淑云.不同生长期酸枣叶中总黄酮和芦丁的含量测定[J].中国中药杂志,1992,17(2):81.
of flight mass spectrometry[J].Food Res Int,2014,56:47-54.
[5]裴香萍,杜晨晖,闫艳,等.HPLC-UV测定不同产地及不同采收期酸枣叶中芦丁的含量[J].中国实验方剂学杂志,2011,17(21):94-96.
[6]张倩倩,崔庆玲,刘晓秋,等.HPLC法同时测定酸枣叶中芦丁等4种黄酮苷的含量[J].沈阳药科大学学报,2014,1:7.
[7]李喜悦,高哲,崔璨,等.枣叶黄酮类成分的分离鉴定及其抗氧化活性研究[J].食品工业科技,2015,36,(10):135-138.
[8]郝福玲,方访,凌铁军,等.夹竹桃叶化学成分的研究[J].安徽农业大学学报,2013,40(5):795-801.
[9]Deng S,Deng Z,Fan Y,et al.Isolation and purification of three flavonoid glycosides from the leaves of Nelumbo nucifera(Lotus)by high-speed counter-current chromatography[J].J Chromatogr B,2009,877(24):2487-2492.
[10]Juan-Badaturuge M,Habtemariam S,Thomas M J K. Antioxidant compounds from a South Asian beverage and medicinal plant,Cassia auriculata[J].Food Chem,2011,125(1):221-225.
[11]石心红,王宇行,孔令义.准噶尔大戟根中黄酮类成分的研究[J].中国药学杂志,2006,41(20):1538-1540.
Determination of five flavonoids in jujube leaves by HPLC
LI Xi-yue,GAO Zhe,WANG Rong-fang,CUI Can,AN Xiao-nan,CUI Tong*
(College of Food Science and Technology,Agricultural University of Hebei,Baoding 071000,China)
The purpose was to establish a method for determining flavonoids in jujube leaves using HPLC,and analyze flavonoids contents in jujube leaves from 14 different cultivars by this method.The samples were separated on a Hypersil BDS C18column,the mobile phase consisted acetonitrile and water with 0.1%formic acid,separations were achieved by a gradient elution program,the flow rate was 1 mL/min,the column temperature was 30℃ and the detection wavelength was at 360 nm.Under these conditions,five flavonoids including quercetin-3-O-robinobioside,rutin,quercetin-3-O-β-D-glucoside,kaempferol-3-O-rutinoside and quercetin-3-O-α-L-arabinosyl-(1→2)-α-L-rhamnoside were detected by one injection.The minimum detection limit was 1.44~2.59 μg/mL.The average recovery rate was 93.8%~105.8%.The results revealed that in terms of flavonoids,the difference of the composition and contents among the different cultivars was siginificant.The average contents of rutin and quercetin-3-O-robinobioside were 7.83 and 4.61 mg/g D.W,respectively,which were higher compared with other flavonoids.Only 8 cultivars detected the existence of quercetin-3-O-α-L-arabinosyl-(1→2)-α-L-rhamnoside,whose average contents was 5.32 mg/g D.W. However,the contents of quercetin-3-O-β-D-glucoside and kaempferol-3-O-rutinoside were lower,they were 0.14 and 0.41 mg/g D.W,respectively.
HPLC;jujube leaves;flavonoids;rutin;quercetin-3-O-robinobioside
TS201.1
A
1002-0306(2015)18-0049-05
10.13386/j.issn1002-0306.2015.18.001
2015-01-16
李喜悦(1990-),女,在读硕士研究生,研究方向:功能食品化学,E-mail:lixiyue123456@163.com。
崔同(1956-),男,教授,研究方向:天然产物活性成分分析,E-mail:cuitong98@aliyun.com。
国家林业公益性行业科研专项(201304708)。
