肺癌循环肿瘤细胞的单细胞EGFR基因突变检测
2015-10-29孙帅邓宇亮
孙帅,邓宇亮
肺癌循环肿瘤细胞的单细胞基因突变检测
孙帅,邓宇亮
上海交通大学,系统生物医学研究院,上海200240
循环肿瘤细胞(Circulating tumor cells,CTCs)是从肿瘤原发病灶脱落并侵入外周血循环的肿瘤细胞。由于CTCs存在较大的异质性,其与癌症发展转移密切相关,但目前尚缺乏有效的CTCs单细胞异质性检测方法。鉴于此,本文发展了在单细胞层面对CTCs进行基因突变的检测方法并用于单个肺癌CTC的(Epidermal growth factor receptor)基因突变检测。首先用集成式微流控系统完成血液中稀有CTCs的捕获,接着将CTCs释放入含有多个微孔的微阵列芯片中,得到含有单个CTC的微孔,通过显微操作将单个CTC转入PCR管内完成单细胞基因组的放大,并进行单细胞的基因突变检测。以非小细胞肺癌细胞系A549、NCI-H1650和NCI-H1975为样本,通过芯片与毛细管修饰、引物扩增条件(复性温度、循环次数)的优化,结果显示在复性温度59℃、30个循环次数的条件下,引物扩增效果最优。利用该方法成功地对非小细胞肺癌(Non-small cell lung cancer, NSCLC)患者的血液样本进行了测试。从患者2 mL血液中获取5个CTCs,分别对其基因的第18、19、20、21外显子进行测序,发现该患者CTCs均为野生型。研究结果证明此检测方法可以灵敏地用于单个CTC基因突变的检测,在临床研究上具有重要的指导意义。
循环肿瘤细胞;微流控芯片;单细胞基因突变检测;
近年来,肺癌的发病率与死亡率持续走高,已经成为威胁我国居民健康的第一大癌症[1, 2]。在肺癌患者中,非小细胞肺癌(Non-small cell lung cancer, NSCLC)约占70%~80%。已有的研究[3~8]发现NSCLC中负责信号传导的表皮生长因子受体(Epidermal growth factor receptor,)发生突变会导致其表达量异常偏高,促进了肿瘤细胞的增殖、侵袭与转移。因此,对NSCLC进行突变检测具有重要的临床意义。与传统的检测(组织样本或者血清采样复杂、存在背景干扰等问题)相比,循环肿瘤细胞(Circulating tumor cells,CTCs)检测作为新型“液体活检”(Liquid biopsy)技术,以其非侵入性、易获得和可多次采样等优势,受到广泛关注[9, 10]。CTCs是从肿瘤病灶脱离并播散进入外周血循环的肿瘤细胞,已被证明是癌症转移的直接来源,与癌症的发生和发展密切相关。由于NSCLC患者的CTCs具有较大的异质性,因此需要对单个CTC进行检测,从而为临床诊断提供参考依据。
微流控芯片(Microfluidic chip)凭借其通道尺寸与细胞大小相当、集成度高等优势[11],成为进行单细胞检测的可靠平台[12]。它可通过将细胞隔离在独立单元,如微液滴[13, 14]、微腔室[15~17]、微孔[18, 19]中,实现单细胞的分配。本研究借助微孔芯片加工灵活、操作简单、通量大等优势,基于前期CTCs捕获的基础[20],将捕获到的CTCs释放后分配到独立微孔中,随后利用显微操作技术将单个CTC转移至低吸附的PCR管内进行单细胞基因组放大,并针对目的基因进行PCR扩增和Sanger测序,从而完成单个CTC的基因突变检测,并应用于临床样本的研究。
1 材料和方法
1.1 实验材料
3种非小细胞肺癌细胞系A549、NCI-H1650和NCI-H1975均来自中国科学院上海生命科学研究院细胞资源中心。采用90% RPMI-1640培养基(Life Technology, A10491-01),添加10%优质胎牛血清培养。A549由于携带突变,而与突变相互排斥,因此在基因突变检测阶段作为阴性对照;NCI-H1650携带外显子19缺失突变;NCI-H1975携带外显子20(T790M)和21(L858R)双突变。
1.2 循环肿瘤细胞的捕获与释放
采用本实验室之前报道的方法[20], 利用集成式微流控系统对血液中的CTCs进行高效分离。该系统利用光敏多聚核苷酸-抗体复合物对CTCs进行捕获,并且通过UV光照射,可以对多聚核苷酸中的光敏基团进行“剪切”,从而实现CTCs的释放。
1.3 微孔阵列芯片设计
为了与单细胞基因组扩增试剂盒的要求相匹配,设计了一个带有3200个微孔的微阵列芯片,每个微孔长800 μm,宽100 μm,深50 μm,体积为4 nL。循环肿瘤细胞的数目极少,分散在含有3200个微孔的芯片上,大部分微孔仅含有0个或1个细胞,有利于显微操作提取单个细胞检测基因突变。
1.4 显微操作获取单个循环肿瘤细胞
单细胞在操作过程中极易丢失,因此将捕获到的CTCs释放到微阵列芯片中以在不同的微孔内获得单个CTC。图1所示,在显微操作仪(显微镜Nikon ECLIPSE Ti-S;微型操作器Xenoworks NEW MP-265/MPC-365;拍照软件NIS-Elements Basic Research)上,利用处理好的毛细玻璃管(尖端口径约15 μm,比细胞直径稍大)负压吸取单个细胞,转入低吸附PCR管内进行后续单细胞基因组放大。

图1 显微操作获取单个循环肿瘤细胞
1: 显微镜视野下找到微孔中的目标CTC;2:用毛细玻璃管负压吸取单个CTC;3:转移单个CTC至低吸附的PCR管;4: 将毛细玻璃管中的缓冲液及单个CTC一起排出;5:显微操作完成,准备后续单细胞基因组放大实验。
1.5 单细胞全基因组放大
单个细胞的DNA量不易于目的基因的扩增,采用REPLI-g Single Cell Kit(Qiagen,USA)对单细胞全基因组进行放大。将单个细胞悬于4 µL磷酸盐缓冲液,加入3 µL变性液65℃高温孵育10 min后,加入3 µL终止缓冲液终止变性。然后,依次加入29 µL反应液、2 µLPhi29 DNA聚合酶(REPLI-g Single Cell Kit提供),并补水至体积50 µL,30℃反应8 h,最后于65℃高温继续反应3 min使酶失活,终止整个放大过程。利用酚氯仿乙醇沉淀进行提纯后,用于后续的目的基因扩增。
1.6引物序列与合成
采用Primer Premier 5.0软件设计引物,用于检测基因的4个外显子(表1)。为了便于对单个CTC的基因的4个外显子的测序结果进行比较,引物设计的原则是:4对引物的 复性温度接近一致。引物合成在Invitrogen公司完成。

表1 基因突变的引物合成
1.7 目的基因测序及分析
显微操作获取单个CTC后,首先完成单细胞的全基因组放大,然后根据设计的引物扩增目的片段,即基因的18~21号外显子。根据琼脂糖凝胶电泳的结果判断扩增效果,然后对单一目的条带进行纯化和Sanger测序,最后分别将细胞系NCI-H1650和NCI-H1975的单细胞测序结果与对照组A549的单细胞测序结果进行比对,确定目的突变的检测是否成功。Sanger测序同样在Invitrogen公司完成。
利用NCBI数据库的Nucleotide Blast将细胞系单细胞样本测序结果与数据库已有序列进行比对。根据文献调研,已有较多研究显示,A549细胞系不存在的基因突变,而且实际比对结果与调研结果显示一致。鉴于此,在本研究中,将细胞系NCI-H1650和NCI-H1975的测序结果与A549样本的序列进行比对,发现NCI-H1650携带有基因的外显子19缺失突变,NCI-H1975携带有基因的外显子20和21双点突变,结果均与已知结果相匹配。
2 结果与分析
2.1 单个CTC的获取
为了实现单个循环肿瘤细胞的分配与转移,本文设计并制作了微孔微阵列芯片(图2A),使用前将微阵列芯片贴在洁净的载玻片上。然后,在超净室内进行单个CTC的分配。具体方法如下:直接将悬于缓冲液的循环肿瘤细胞铺在微阵列芯片的表面,然后用Parafilm薄膜将表面溢出的液体刮净,静置15min,可在显微镜下观察到单个微孔中含有单个CTC(图2:B、C)。在获得单个微孔中的单个CTC的过程中,存在细胞没有进入微孔或者单个微孔中出现0、1、2、3个细胞的情况(图2C)。但鉴于实验的目的是单次实验中获得5个单微孔的单细胞,因此该现象不会影响后续实验。

图2 微阵列芯片实物图及单细胞分配
A:微阵列芯片贴在洁净的载玻片上;B:显微镜下的微阵列芯片结构,空白芯片图;C:铺展细胞悬液,单细胞在微阵列芯片内的分配图。箭头指向的圆圈表示得到的单个CTC。
由于微芯片的微孔体积只有4 nL,缓冲液在干燥的环境下极易挥发致使单细胞易于与聚二甲基硅氧烷(Polydimethylsiloxane,PDMS)基底发生粘连,从而降低显微操作获取单细胞的成功率。因此,视野下找到目标单细胞后,通过显微操作的毛细管再次注入缓冲液,通过轻微移动毛细管,对单个CTC进行刮取,然后对刮取下的单个CTC进行负压吸取,并转移到低吸附PCR管中,图3为从微阵列芯片内取走单细胞前后的对照情况。

图3 显微操作从微阵列芯片内取单细胞
A: 白光下找到单细胞的视野;B:显微操作单个CTC被取走后的视野。箭头指向的圆圈表示得到的单个CTC。
2.2 基底与毛细管双重修饰对获取单细胞的影响
本文采用的微孔芯片用PDMS制备,CTCs表面有蛋白表达,易与PDMS基底和玻璃毛细管发生粘连,影响显微操作转移CTCs的效率,进而影响CTCs的检测成功率。为避免非特异性吸附的影响,本实验采用BSA与三甲基氯硅烷(TMCS)分别对芯片基底和玻璃毛细管进行修饰。首先采用1% BSA对微芯片凹槽进行修饰,每次实验选取5个循环肿瘤细胞,结果发现单个循环肿瘤细胞从凹槽中取出的难度降低,成功率由0%~20%提高至40%。之后,在用BSA对微芯片凹槽修饰的基础上,同时采用TMCS对洁净的玻璃毛细管进行表面处理,方法是在干燥的环境中用TMCS蒸汽熏玻璃毛细管15 min,TMCS可与玻璃中的二氧化硅进行反应,使玻璃毛细管表面疏水化,从而不易与细胞产生粘附。实验结果显示,双重修饰大幅提高单个循环肿瘤细胞的转移效率,达到60%。
2.3 扩增条件的优化与细胞系验证
以非小细胞肺癌细胞系A549为样本,针对基因外显子20所对应的引物,进行引物扩增条件的优化,设计了4个复性温度梯度,分别是50℃、55℃、57℃和59℃。结果显示59℃的扩增条带清晰且亮度高(图4A)。在循环数的优化过程中,进行了25个循环与30个循环的比较,结果显示30个循环的扩增条带清晰且亮度高(图4B)。因此PCR扩增的优化条件最后确定为复性温度为59℃,循环数为30。其他3对引物进行了同样的优化过程。在本实验中,基因的4个外显子所对应的引物能在相同条件下完成目的基因的扩增,这不但可以节约时间,而且有利于单个CTC的结果比较。

图4 PCR扩增条件的优化
以A549细胞系为材料、以EGFR基因的外显子20对应引物进行条件优化。A:温度优化过程,最终选择59℃;B:循环数优化过程,最终选择30个循环。
为证明对单个CTC进行基因检测的有效性,选用非小细胞肺癌细胞系A549、NCI-H1650和NCI-H1975对基因的突变进行了检测。PCR复性温度59℃,重复30个循环。如图5所示,3个细胞系均成功扩增出基因的4个外显子。Sanger测序结果显示,A549的4个外显子全部为野生型,NCI-H1650发生外显子19缺失,NCI-H1975的外显子20和21出现双突变。实验结果与已知结果完全相符,从而证明该技术的可行性。
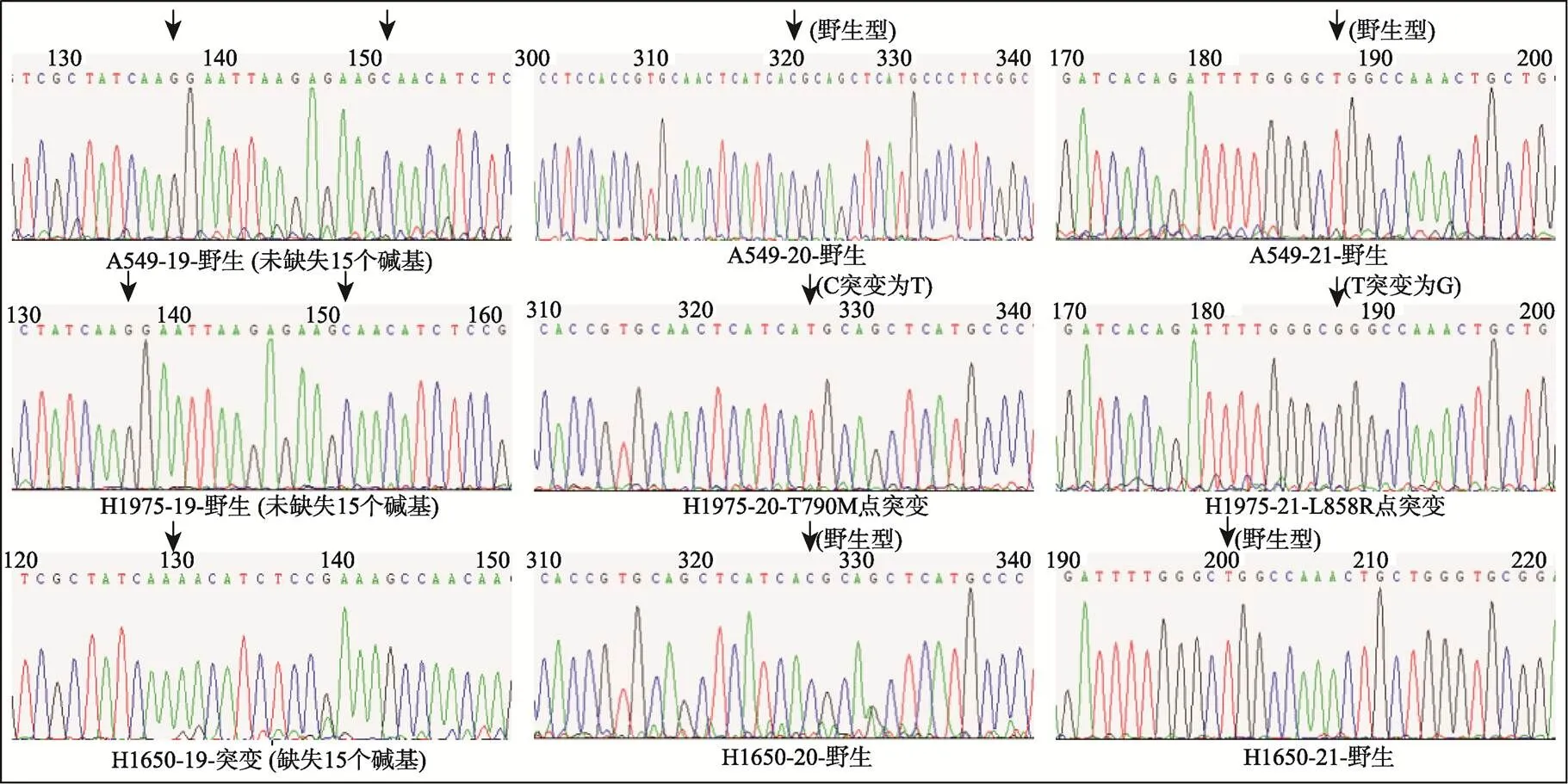
图5 单细胞测序图谱比较
A549、NCI-H1975和NCI-H1650单细胞均成功扩增出EGFR基因的4个外显子,测序显示A549的4个外显子全部呈现野生型,NCI-H160外显子19发生缺失突变,NCI-H1975的外显子20和21发生双点突变。本实验同时检测了EGFR基因的外显子18,由于3种细胞系的18号外显子均呈现野生型,所以未在测序结果中显示。
2.4 NSCLC患者CTCs单细胞EGFR突变检测
通过细胞系验证该检测技术的可行性后,本文利用此方法检测了NSCLC患者血液内单个CTC的基因突变状况。显微操作从芯片微孔中获取5个CTCs进行检测。电泳结果显示成功扩增了4个CTCs的不同目的基因,如图6所示。其中,1#~4#单细胞均明显看到成功扩增出基因的4个外显子,与阳性对照A549的基因扩增结果完全一致;5#单细胞未扩增出外显子18、19、20,但是却扩增出外显子21,原因可能是非小细胞肺癌患者出现了基因的缺失,而缺失片段恰好覆盖外显子18~20。测序图谱显示1#~4#单细胞的基因外显子18、19、20和21均未发生目的突变,即均为野生型,且5#单细胞的外显子21也呈现野生型。在临床中,检测患者原发病灶组织样本的基因突变对于治疗方式选择至关重要,与原发病灶组织样本检测相比,CTCs的获取与检测更为容易,一定程度上可以代表原发病灶。

图6 不同临床患者CTCs目的基因扩增结果
1#~5#代表5个不同NSCLC患者的CTCs样本。“N”代表阴性对照,“P”代表阳性对照。
3 讨论
近年来,随着研究的深入,单细胞基因检测取得了很大的进展,如哈佛大学谢晓亮课题组发展的基于多重复性和成环循环扩增的单细胞检测[21],华大基因研究院发展的基于多重置换扩增(Multiple displacement amplification, MDA)的单细胞测序[22, 23]等。单细胞基因测序技术取得的进展,使得在单细胞层面研究肿瘤细胞的异质性成为可能,然而如何进行单细胞样本的制备,是制约单细胞分析的瓶颈。目前使用较多的是Fluidigm公司C1系统[24],其采用双层泵阀芯片结构,通过流体的控制,可以完成单细胞的捕获与预扩增,由于C1系统为了保证单细胞的捕获效率,要求细胞进样量较多(103量级),稀有细胞(如本文提及的CTCs),由于其数目少,不能满足该系统的进样要求。此外,还有基于微液滴的分析方法[25],将细胞包裹在单个液滴中,完成单细胞独立单元的分配,由于液滴中包含PCR预扩增反应物,可以实现单细胞数字PCR,然而其同样需要细胞进样量较多,不适合于稀有细胞的分析。因此,为实现稀有细胞的单细胞分析,本文采用了微孔结构的芯片设计,其优点在于:(1)可以便利的实现单细胞独立单元的分配;(2)可以直观的对所需目标细胞通过显微操作的方式进行吸取转移等操作;(3)芯片制作简单,成本低。
本实验将捕获的CTCs释放入含有多个微孔的微阵列芯片,以得到含有单个CTC的微孔,并通过显微操作技术平台将单个CTC转入PCR管内完成单细胞基因组的放大,最后利用PCR技术和Sanger测序完成单细胞的基因突变检测。通过对基底与毛细管修饰,减少非特异性吸附的影响;通过对引物扩增的条件进行优化,寻找最佳的扩增温度与循环数;选择非小细胞肺癌细胞系A549、NCI-H1650和NCI-H1975分别对本实验技术路线进行验证,并对NSCLC患者的CTCs进行单细胞层面的检测。本文发展的基于微流控芯片、显微操作平台和一代测序相结合的技术可以快捷有效的针对单个循环肿瘤细胞进行基因检测,不但有助于研究CTC的异质性问题,更可能在一定程度上提供有效的靶向治疗信息,从而促进临床诊疗的进步。
参考文献
[1] 李占稳. 肺癌细胞系KRAS突变检测及联合通路抑制剂的生长抑制作用[学位论文]. 北京协和医学院, 2013: 11–14.
[2] Paz-Ares L, de Marinis F, Dediu M, Thomas M, Pujol JL, Bidoli P, Molinier O, Sahoo TP, Laack E, Reck M, Corral J, Melemed S, John W, Chouaki N, ZimmermannAH, Visseren-Grul C, Gridelli C. Maintenance therapy with pemetrexed plus best supportive care versus placebo plus best supportive care after induction therapy with pemetrexed plus cisplatin for advanced non-squamous non-small-cell lung cancer (PARAMOUNT): a double-blind, phase 3, randomised controlled trial., 2012, 13(3): 247–255.
[3] Goto K, Satouchi M, Ishii G, Nishio K, Hagiwara K, Mitsudomi T, Whiteley J, Donald E, McCormack R, Todo T. An evaluation study ofmutation tests utilized for non-small-cell lung cancer in the diagnostic setting., 2012, 23(11): 2914–2919.
[4] Maheswaran S, Sequist LV, Nagrath S, Ulkus L, Brannigan B, Collura CV, Inserra E, Diederichs S, Iafrate AJ, Bell DW, Digumarthy S, Muzikansky A, Irimia D, Settleman J, Tompkins RG, Lynch TJ, Toner M, Haber DA. Detection of mutations inin circulating lung-cancer cells., 2008, 359(4): 366–377.
[5] Oxnard GR, Paweletz CP, Kuang YN, Mach SL, O'Connell A, Messineo MM, Luke JJ, Butaney M, Kirschmeier P, Jackman DM, Jänne PA. Noninvasive detection of response and resistance in-mutant lung cancer using quantitative next-generation genotyping of cell-free plasma DNA., 2014, 20(6): 1698–1705.
[6] Wang ZJ, Chen R, Wang SH, Zhong J, Wu MN, Zhao J, Duan JC, Zhuo ML, An TT, Wang YY, Bai H, Wang J. Quantification and dynamic monitoring ofT790M in plasma cell-free DNA by digital PCR for prognosis of EGFR-TKI treatment in advanced NSCLC., 2014, 9(11): e110780.
[7] 李海静, 刘岩, 郝海生, 杜卫华, 赵学明, 王栋, 秦彤, 马友记, 朱化彬. 表皮生长因子受体与肺脏发育的关系. 遗传, 2012, 34(1): 27–32.
[8] 赵宝霞. EGFR突变型NSCLC的EGFR-TKI耐药机制体外研究[学位论文]. 大连医科大学, 2013: 15–17.
[9] den Toonder J. Circulating tumor cells: the Grand Challenge., 2011, 11(3): 375–377.
[10] Wang ST, Wang H, Jiao J, Chen KJ, Owens GE, Kamei K, Sun J, Sherman DJ, Behrenbruch CP, Wu H, Tseng HR. Three-dimensional nanostructured substrates toward efficient capture of circulating tumor cells., 2009, 48(47): 8970–8973.
[11] 林炳承. 微流控芯片实验室及其功能化. 中国药科大学学报, 2003, 34(1): 1–6.
[12] Sun J, Masterman-Smith MD, Graham NA, Jiao J, Mottahedeh J, Laks DR, Ohashi M, DeJesus J, Kamei K, Lee KB, Wang H, Yu ZTF, Lu YT, Hou S, Li KY, Liu M, Zhang NG, Wang ST, Angenieux B, Panosyan E, Samuels ER, Park J, Williams D, Konkankit V, Nathanson D, Van Dam RM, Phelps ME, Wu H, Liau LM, Mischel PS, Lazareff JA, Kornblum HI, Yong WH, Graeber TG, Tseng HR. A microfluidic platform for systems pathology: multiparameter single-cell signaling measurements of clinical brain tumor specimens., 2010, 70(15): 6128–6138.
[13] Qiu DM, Silva L, Tonkovich AL, Arora R. Micro-droplet formation in non-Newtonian fluid in a microchannel., 2010, 8(4): 531–548.
[14] 宋文斌, 董朝青, 任吉存. 微液滴微流控芯片: 微液滴的形成、操纵和应用. 分析科学学报, 2011, 27(1): 106–112.
[15] Eyer K, Kuhn P, Hanke C, Dittrich PS. A microchamber array for single cell isolation and analysis of intracellular biomolecules., 2012, 12(4): 765–772.
[16] Umemura K, Miyabayashi T, Taira H, Suzuki A, Kumashiro Y, Okano T, Mayama S. Use of a microchamber for analysis of thermal variation of the gliding phenomenon of singlecells., 2015, 44(3): 113–119.
[17] 廖红华, 廖宇, 易金桥, 徐建. PCR芯片中微腔室高度及加热器结构优化设计. 湖北民族学院学报(自然科学版), 2009, 27(4): 403–407.
[18] Wang MH, Zhu D. Fabrication of multiple electrodes and their application for micro-holes array in ECM., 2009, 41(1–2): 42–47.
[19] 张慧妍, 张珍, 吉邢虎, 何治柯. 纸基微孔阵列芯片比色法检测乳酸脱氢酶. 分析化学, 2014, 42(9): 1276–1280.
[20] Deng YL, Zhang Y, Sun S, Wang ZH, Wang MJ, Yu BQ, Czajkowsky DM, Liu BY, Li Y, Wei W, Shi QH. An integrated microfluidic chip system for single-cell secretion profiling of rare circulating tumor cells., 2014, 4: 7499.
[21] Zong CH, Lu SJ, Chapman AR, Xie XS. Genome-wide detection of single-nucleotide and copy-number variations of a single human cell., 2012, 338(6114): 1622–1626.
[22] Hou Y, Song LT, Zhu P, Zhang B, Tao Y, Xu X, Li FQ, Wu K, Liang J, Shao D, Wu HJ, Ye XF, Ye C, Wu RH, Jian M, Chen Y, Xie W, Zhang RR, Chen L, Liu X, Yao XT, Zheng HC, Yu C, Li QB, Gong ZL, Mao M, Yang X, Yang L, Li JX, Wang W, Lu ZH, Gu N, Laurie G, Bolund L, Kristiansen K, Wang J, Yang HM. Single-cell exome sequencing and monoclonal evolution of a-negative myeloproliferative neoplasm., 2012, 148(5): 873–885.
[23] Xu X, Hou Y, Yin XY, Bao L, Tang AF, Song LT, Li FQ, Tsang S, Wu K, Wu HJ, He WM, Zeng L, Xing MJ, Wu RH, Jiang H, Liu X, Cao DD, Guo GW, Hu XD, Gui YT, Li ZS, Xie WY, Sun XJ, Shi M, Cai ZM, Wang B, Zhong MM, Li JX, Lu ZH, Gu N, Zhang XQ, Goodman L, Bolund L, Wang J, Yang HM, Kristiansen K, Dean M, Li YR, Wang J. Single-cell exome sequencing reveals single-nucleotide mutation characteristics of a kidney tumor., 2012, 148(5): 886–895.
[24] Wang JB, Fan HC, Behr B, Quake SR. Genome-wide single-cell analysis of recombination activity and de novo mutation rates in human sperm., 2012, 150(2): 402–412.
[25] Theberge AB, Courtois F, Schaerli Y, Fischlechner M, Abell C, Hollfelder F, Huck WTS. Microdroplets in microfluidics: an evolving platform for discoveries in chemistry and biology., 2010, 49(34): 5846–5868.
Single-cell detection ofgene mutation in circulating tumor cells in lung cancer
Shuai Sun, Yuliang Deng
Circulating tumor cells (CTCs) are cells that shed from a primary tumor and enter the peripheral blood circulation. The CTCs are closely associated with tumor development and metastasis because of its high heterogeneity. However, there are still no effective methods to detect single-cell heterogeneity of the CTCs. To this end, we developed a method to detect gene mutation in CTCs at the single-cell level and applied it to the detection ofgene mutation in single lung cancer CTC. Specifically, the rare CTCs were captured from blood using an integrated microfluidic system, and then were released into a microchip with thousands of nanoliter wells to isolate single CTC. The single CTC was then transferred into a PCR tube under the microscope for single-cell genome amplification and detection ofgene mutation. We firstly modified chip and capillary and optimized PCR conditions (annealing temperature, number of cycles) using non-small-cell lung cancer (NSCLC) cell lines A549, NCI-H1650 and NCI-H1975 as samples, which showed maximal amplification after 30 cycles with an annealing temperature at 59℃. We then successfully detected blood samples from NSCLC patients using this method. 5 CTCs were obtained from 2 mL patient’s blood and the sequencing ofexons 18, 19, 20 and 21 showed no mutations. Our results demonstrated that this method is sensitive enough to detect gene mutation in single CTC and has guiding significance in clinic research.
circulating tumor cells; microfluidic chip; single-cell gene mutation;
2015-07-16;
2015-09-14
国家自然科学基金项目(编号:21205077),上海市自然科学基金项目(编号:13ZR1456100)和教育部博士点基金(编号:20130073120106)资助
孙帅,硕士研究生,专业方向:癌症患者血液循环肿瘤细胞的基因检测。E-mail: sunshuai_good@163.com
邓宇亮,博士,助理研究员,研究方向:基于微流控平台的循环肿瘤细胞的研究。E-mail: yldeng@sjtu.edu.cn
10.16288/j.yczz.15-130
网络出版时间: 2015-9-22 16:03:04
URL: http://www.cnki.net/kcms/detail/11.1913.R.20150922.1603.002.html
(责任编委: 史庆华)
