人FGF21原核表达载体的构建及重组蛋白表达
2015-10-26张礼林唐青蓝许庆忠雷霆雯李红梅
张礼林唐青蓝许庆忠雷霆雯李红梅
(1. 贵阳医学院生物化学与分子生物学教研室,贵阳 550004;2. 海南省第三人民医院检验科,三亚 572000)
人FGF21原核表达载体的构建及重组蛋白表达
张礼林1唐青蓝2许庆忠1雷霆雯1李红梅1
(1. 贵阳医学院生物化学与分子生物学教研室,贵阳 550004;2. 海南省第三人民医院检验科,三亚 572000)
构建人FGF21(fibroblast growth factor,FGF)cDNA的原核表达载体并诱导其重组蛋白表达。提取人肝脏总RNA后,经RT-PCR扩增获得目的片段,构建其T载体进行保存。再构建重组原核表达载体pET-28a(+)-hFGF21,重组质粒转化至大肠杆菌菌株BL21(DE3)中,在IPTG诱导下得到可溶性表达,采用亲和层析法纯化表达产物后,进行Western blot鉴定。成功构建重组质粒pET-28(+)-hFGF21,对其进行可溶性表达后成功纯化出his-hFGF21,经Western blot鉴定该融合蛋白可与FGF21抗体特异性结合。成功构建pET-28(+)-hFGF21,并可溶性表达his-hFGF21蛋白。
人成纤维细胞生长因子(FGF21);克隆;原核表达;蛋白纯化
成纤维细胞生长因子(fibroblast growth factor,FGF)是一类由FGF基因家族成员编码的结构相关蛋白质。目前,已经发现其家族有23个成员,其中心区域都含有一段同源性为30%-70%的氨基酸序列[1]。庞大的FGF家族成员可调节生物代谢;调控细胞增殖、迁移和分化;参与肿瘤的发生和发展[2,3]。FGF21是FGF家族的一个新成员,是一种可分泌的蛋白[4],近年来已经成为国际上研究肥胖和糖尿病的热点基因之一。FGF21可以降低血糖浓度,其对糖代谢的调节既不依赖于胰岛素,又能够增强胰岛素的敏感性,促进胰岛β细胞的存活,还可以降低胰岛素的使用浓度,改善胰岛素抵抗[5-9]。同时,FGF21可以调节脂代谢,改善脂蛋白图谱,降低血浆中低密度脂蛋白胆固醇,甘油三酯水平,并提高高密度脂蛋白胆固醇[10]。多项研究证明,糖尿病患者血清FGF21的表达量增高[11-13],且FGF21水平增高是2型糖尿病独立危险因素[14]。此外,在肥胖个体中FGF21的血清水平上升[12]。 本研究拟构建人FGF21的原核表达载体,并对其进行诱导表达和纯化,以获得人FGF21的融合蛋白,为后期进一步研究FGF21的活性、作用及其与原发性高血压相关性研究奠定试验基础。
1 材料与方法
1.1 材料
1.1.1 质粒与菌株 质粒pMD-19-T载体购自宝生物工程(大连)有限公司,受体菌E.coli DH5α菌株、E.coli BL21(DE3)菌株、pET-28a(+)质粒由本实验室提供。
1.1.2 酶与主要生化试剂 总RNA提取试剂盒购自天根生化科技有限公司,M-MuLV第一链cDNA合成试剂盒购自上海生工生物工程有限公司,Premix Taq、限制性内切酶XhoⅠ及BamHⅠ、T4 DNA Ligase、X-gal、IPTG、琼脂糖凝胶DNA片段纯化试剂盒、DNA Marker购自宝生物工程(大连)有限公司,Trizol、质粒DNA小量提取试剂盒购自OMEGA公司,蛋白marker购自Fermentas MBI,超级感受态细菌制备试剂盒购自上海碧云天生物技术有限公司,DMF、DMSO购自AMRESCO公司,过硫酸胺(APS)、叠氮化钠、溶菌酶、甘氨酸、Triton X-100、咪唑、PMSF、考马斯亮兰R-250、TRIS、丙烯酰胺购自Solarbio公司,HIS-Select Nickel Affinity Gel 购自Sigma-aldrich公司、FGF-21 Antibody rabbit polyclonal IgG、Goat anti-rabbit IgG-HRP购 自Santa Cruz Biotechnology公司。
1.2 方法
1.2.1 引物序列的设计 根据GenBank中人FGF21(NM_019113.2、GI:68215584)基因序列,设计引物扩增人FGF21cDNA从235至777之间的共543个碱基的片段,引物由宝生物工程(大连)有限公司合成。H上游:CGGGATCCCACCCCATCCCTGACTCCAGT(下划线为BamH I酶切位点,前两个为保护性碱基),H下游:CCCTCGAGTCAGGAAGCGTAGCTGGGGCT(下划线为Xho I酶切位点,前两个为保护性碱基)。
1.2.2 RT-PCR 获取目的片段与T载体构建 试剂盒法提取人肝脏总RNA(人肝组织取自于贵阳医学院附属医院肝胆外科行肝脏切除术者。),经M-MuLV酶合成人源型cDNA第一链,以cDNA第一链为模板,加入H上游、H下游引物各0.5 μL(10 μmol/L),Premix Taq 12.5 μL,加水至总体积25 μL。扩增条件:94℃预变性5 min后进入循环;94℃ 30 s,60℃ 30 s,72℃ 1 min,循环30次;72℃延长10 min。扩增出人FGF21 cDNA从235至777之间的共543个碱基的片段,构建于pMD19-T载体,经蓝白斑筛选出阳性克隆子,对其进行菌落PCR鉴定,并送上海生物工程公司测序,将测序正确的阳性克隆子命名为pMD19-T-hFGF21保存备用。
1.2.3 人FGF21cDNA表达载体的构建 以pMD19-T-hFGF21为模板,加入H上游(10 μmol/L)、H下游引物(10 μmol/L)各1 μL,Premix Taq 12.5 μL,加水至总体积25 μL。扩增条件:94℃预变性5 min后进入循环;94℃ 30 s,60℃ 30 s,72℃ 1 min,循环30次;72℃延长10 min。大体系扩增出目的片段,将PCR产物割胶回收后用BamHⅠ和XhoⅠ双酶切,回收酶切片段,并与用同样两种酶处理的pET-28a(+)质粒进行连接,连接产物转化E. coli BL21(DE3)感受态细胞,LK平板筛选阳性转化子,PCR鉴定后,挑单菌落接种培养,抽提质粒,经双酶切鉴定正确后送上海生物工程公司测序。
1.2.4 融合蛋白的诱导表达 将测序正确的质粒转化Ecoli.BL21DE3感受态细胞,LK平板筛选阳性菌落,挑取单菌落,在LK液体培养基中37℃ 200 r/min过夜培养。按1∶500的比例取上述菌液转接于LK液体培养基中,37℃ 200 r/min振摇,至 OD600达到0.4时,加入IPTG(终浓度为0.2 mmol/L),23℃120 r/min诱导4 h,收集菌体。将菌体蛋白进行12% SDS-PAGE电泳鉴定。
1.2.5 融合蛋白的纯化 按上述条件诱导表达大量表达载体,收集菌体后,100 mL菌体沉淀中加入8 mL裂解液、60 μL PMSF(0.1 mol/L)吹打混匀,振荡混匀20 min。冰浴超声破碎1 h,4℃,12 000 r/min离心20 min,收集上清与沉淀,将上清与沉淀分别进行12% SDS-PAGE电泳鉴定。取超声破碎上清,4℃ 12 000×g离心10 min后取100 μL裂解上清液与200 μL不含咪唑的平衡缓冲液,轻柔颠倒混匀数次。4℃ 5 000×g离心30 s,小心弃上清,并留样少许保存。向凝胶中加入1 mL预冷的不含咪唑的清洗缓冲液清洗3次。轻柔混合亲和凝胶30 s,4℃ 5 000×g离心30 s,小心弃上清,留样少许,重复3次。最后,向凝胶中加入100 μL his洗脱缓冲液,轻柔旋转混匀1 min,4℃ 5 000×g离心30 s,小心吸取上清,留样保存,重复操作2次。将纯化的蛋白液、留样的漂洗液、洗脱液分别进行12% SDS-PAGE电泳鉴定。
1.2.6 Western blot鉴定 分别取BL21(DE3)菌株诱导表达蛋白裂解液、未纯化的蛋白裂解液和纯化his-hFGF21蛋白液经SDS-PAGE凝胶泳后,将蛋白条带转至PVDF膜上,经Western blot封闭液封闭后,依次加入兔源性FGF21多克隆一抗,羊抗兔二抗,最后用ECL-Plus发光试剂显色,干燥后扫描图像保存。
2 结果
2.1 RT-PCR 获取目的片段与T载体构建
2.1.1 RT-PCR 获取目的片段 以人肝组织cDNA第一链为模板,经PCR扩增人FGF21 基因的完整开放阅读框区,结果表明成功地从人FGF21 cDNA扩增出目的片段。
2.1.2 T载体的构建 通过T-A克隆将PCR产物与pMD-19T载体连接,将重组pMD-19T-hFGF21载体经蓝白斑筛选挑选出阳性菌落进行PCR鉴定,结果见图1,初步验证了所构建T载体上带有目的基因。
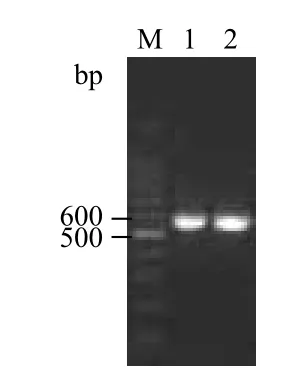
图1 琼脂糖凝胶电泳检测人FGF21重组载体pMD19T-hFGF21菌落PCR
2.1.3 测序鉴定 将菌落PCR鉴定正确的阳性菌落扩大培养12 h后,取1 mL送基因公司进行序列分析,经测定表明pMD19T-hFGF21基因碱基序列与GenBank公布的人FGF21cDNA序列一致,即可确认人FGF21基因成功克隆到pMD-19T载体,将正确的克隆命名为pMD19T-hFGF21。
2.2 人FGF21基因表达载体的构建
2.2.1 人FGF21重组表达载体连接 大体系扩增人FGF21目的片段后,对其与表达载体pET-28a(+)分别进行双酶切,分别回收双酶切片段,进行连接反应,连接产物转化大肠杆菌BL21(DE3)感受态细胞,涂布于LK平板筛选阳性菌落,结果见图2,初步表明人FGF21重组表达载体构建成功。
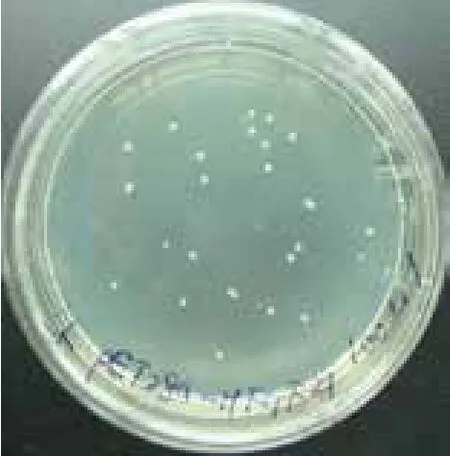
图2 人FGF21重组表达载体Kan抗性筛选平板
2.2.2 人FGF21重组表达载体酶切鉴定 将LK平板筛选的阳性菌落接种于LK液体培养基中,37℃200 r/min培养14 h后提取质粒,双酶切处理,酶切结果见图3,由此鉴定人FGF21重组表达载体构建成功,将其命名为pET-28a(+)-hFGF21。
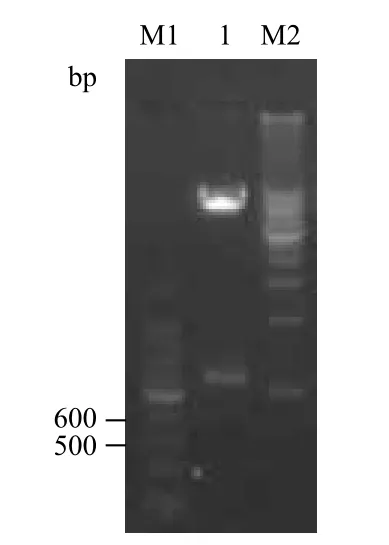
图3 琼脂糖凝胶电泳检测人FGF21重组表达载体酶切图
2.2.3 测序鉴定 双酶切鉴定正确的质粒DNA定量后取30 μg送基因公司进行序列分析,经测定表明pET-28a(+)-hFGF21基因碱基序列与GenBank公布的人FGF21基因序列一致,即可确认人FGF21基因成功克隆到pET-28a(+)表达载体上,将正确的克隆命名为pET-28a(+)-hFGF21。
2.3 融合蛋白的诱导表达
取pET-28a(+)-hFGF21的BL21DE3阳性菌经抗生素筛选后取单菌落接种于LK液体培养基中,37℃ 200 r/min振摇过夜,扩大培养至OD600为0.4时,在IPTG终浓度为0.2 mmol/L、1 mmol/L的条件下,以23℃ 120 r/min振摇后4 h,收集菌体沉淀,用2×sample buffer变性处理,SDS-PAGE鉴定(图4)发现在22 kD左右均出现明显目的蛋白条带。

图4 SDS-PAGE电泳检测hFGF21蛋白诱导表达产物
2.4 融合蛋白的纯化
2.4.1 菌体破碎 取pET-28a(+)-hFGF21的BL-21DE3菌种抗生素平板接种过夜后,挑取单菌落于LK液体培养基中振摇过夜,按1∶500的比例取20 μL菌液加入100 mL新鲜抗生素液体培养基中,37℃ 200 r/min振摇至OD600达到0.4时,加入IPTG使其终浓度为0.2 mmol/L,23℃ 120 r/min振摇4 h,收集菌体沉淀加入8 mL裂解液、PMSF后振荡混匀20 min,冰浴超声破碎1 h,离心后分离上清与沉淀,变性后SDS-PAGE鉴定(图5),由染色结果可知,his-hFGF21蛋白在上清液中大量表达。
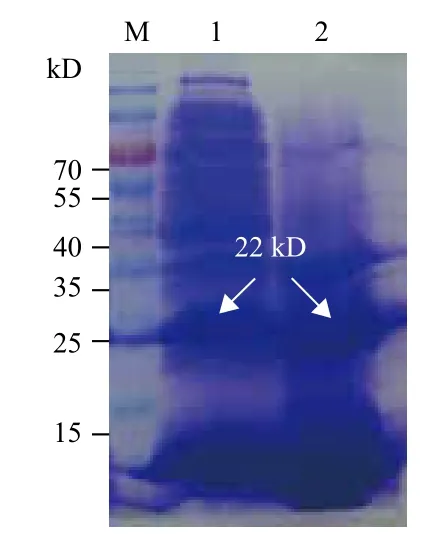
图5 SDS-PAGE电泳检测目的蛋白可溶性分析
2.4.2 FGF21蛋白纯化 将裂解后的his-hFGF21蛋白裂解上清液与 his镍亲和凝胶结合后,将未结合的蛋白漂洗除去,再用 his洗脱缓冲液,将his融合蛋白从凝胶上洗脱下来,即得到纯化的his-hFGF21融合蛋白。将洗脱液、漂洗液变性后进行SDS-PAGE鉴定(图6),均可见到明显的目的蛋白,纯化成功。
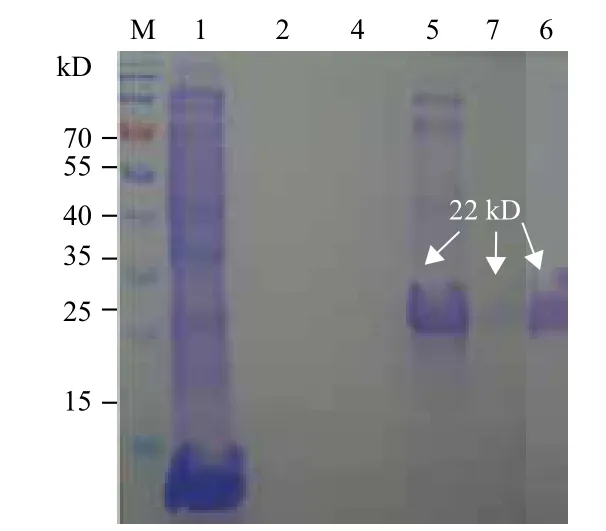
图6 SDS-PAGE电泳检测纯化蛋白his-hFGF21
2.5 Western blot鉴定FGF21蛋白
一抗为兔抗FGF21多克隆抗体,二抗为辣根过氧化物酶标记鼠抗兔IgG,进行Western blot免疫印迹分析,化学发光显色后结果如图7所示,hishFGF21蛋白与兔抗FGF21多克隆抗体呈阳性反应,在约22 kD处有特异性蛋白反应条带。

图7 Western blot鉴定his-hFGF21蛋白
3 讨论
FGF21是由肝、胰、脂肪和骨骼肌、心脏、胸腺产生,可能从外周组织中以活化形式分泌[15-19]。FGF21 mRNA主要在肝脏中高水平表达[19]。本研究获得了his-hFGF21融合蛋白,his-hFGF21的分子量约为22 kD,纯化后的融合蛋白经Western blot免疫印迹鉴定正确,说明关于his-hFGF21融合蛋白制备成功。
目前,关于FGF21的研究多集中在其糖尿病的相关性研究中,且将FGF21用于治疗糖尿病已经进入2期临床研究阶段[20],但尚未发现关于人FGF21与原发性高血压的相关性报道。本研究获得了人FGF21的表达,其表达产物his-hFGF21融合蛋白具有免疫原性,其活性还有待进一步研究。
4 结论
本试验成功构建了pET-28(+)-hFGF21,并可溶性表达出his-hFGF21蛋白。
[1]Kharitonenkov A. FGFs and metabolism[J]. Curr Opin Pharmacol,2009, 9(6):805-810.
[2]Kharitonenkov A, Shanafelt AB. Fibroblast growth factor-21 as a therapeutic agent for metabolic diseases[J]. Biodrugs, 2008, 22(1):37-44.
[3]Nicholes K, Guillet S, Tomlinson E, et al. A mouse model of hepatocellular carcinoma ectopic expression of fibroblast growth factor 19 in skeletal muscle of transgenic mice[J]. Am J Pathol,2002, 160(6):2295-2307 .
[4]付宏岐, 李海燕, 庞实锋, 等. 利用转基因番茄表达人成纤维细胞生长因子21(FGF21)[J]. 西北农林科技大学学报:自然科学版[J]. 2011, 39(7):163-170.
[5]张谢, 王周光, 李晓霞, 等. 一个新的代谢调节因子——成纤维细胞生长因子21[J]. 药物生物技术, 2011, 18(3)269-272.
[6]Xu J, Lloyd DJ, Hale C, et al. Fibroblast growth factor 21 reverses hepatic steatosis, increases energy expenditure, and improves insulin sensitivity in diet-induced obese mice[J]. Diabetes, 2009, 58(1):250-259.
[7] Mashili FL, Austin RL, et al. Direct effects of FGF21 on glucose uptake in human skeletal muscle:implications for type 2 diabetes and obesity[J]. Diabetes Metab Res Rev, 2011, 27(3):286-297.
[8]Kharitonenkov A, Wroblewski VJ, Koester A, et al. The metabolic state of diabetic monkeys is regulated by fibroblast growth factor 21[J]. Endocrinology, 2007, 148(2):774-781.
[9]Wang H, Xiao Y, Fu L, et al. High-level expression and purification of soluble recombinant FGF21 protein by SUMO fusion in Escherichia coli[J]. BMC Biotechnololy, 2010, 10:14.
[10]Seo JA, Kim NH. Fibroblast growth factor 21:a novel metabolic regulator[J]. Diabetes Metab, 2012, 36:26-28.
[11] Chen WW, Li L, et al. Circulating FGF-21 levels in normal subjects and in newly diagnosed patients with Type 2 diabetes mellitus[J]. Exp Clin Endocrinol Diabetes, 2008, 116:65-68.
[12]Zhang X, Yeung DC, Karpisek M, et al. Serum FGF21 levels are increased in obesity and are independently associated with the metabolic syndrome in humans[J]. Diabetes, 2008, 57:1246-1253.
[13]李思明, 沙长青, 高扬, 等. 中国东北地区妊娠期糖尿病妇女与妊娠健康妇女血清成纤维细胞生长因子(FGF21)表达量差异性研究[J]. 黑龙江科学, 2013, 4(8):23-25.
[14]Chen C, Cheung BM, Tso AW, et al. High plasma level of fibroblast growth factor 21 is an independent predictor of type 2 diabetes:A 5. 4-year population-based prospective study in Chinese subjects[J]. Diabetes Care, 2011, 34(9):2113-2115.
[15]Nishimura T, Nakatake Y, Konishi M, et al. Identification of a novel FGF, FGF-21, preferentially expressed in the liver[J]. Biochim Biophys Acta, 2000, 1492(1):203-206.
[16]Yasuhiro I, Holly AB, Noriyuki O, et al. FGF21 is an Akt-regulated myokine[J]. FEBS Letters, 2008, 58(2):3805-3810.
[17]Wang H, Qiang L, Farmer SR, et al. Identification of a domain within peroxisome proliferator-activated receptor gamma regulating expression of a group of genes containing fibroblast growth factor 21 that are selectively repressed by SIRT1 in adipocytes[J]. Mol Cell Biol, 2008, 28(1):188-200.
[18] Wente W, Alexander M, Efanov, et al. Fibroblast growth factor-21 improves pancreatic β-cell function and survival by activation of extracellular signal-regulated kinase 1/2 and akt signaling Pathways[J]. American Diabetes Association, 2006, 55(9):2470-2478.
[19]柳景华, 吕昀, 等. 成纤维细胞生长因子21基因在心脏中表达的研究[J]. 心肺血管病杂志, 2009, 28(6):415-418.
[20]Zhao Y, Dunbar JD, Kharitonenkov A. FGF21 as a therapeutic reagent[J]. Adv Exp Biol, 2012, 728:214-228.
(责任编辑 李楠)
Preparation of Prokaryotic Expression Construct of Human FGF21 cDNA and Its Recombinant Protein Expression
Zhang Lilin1Tang Qinglan2Xu Qingzhong1Lei Tingwen1Li Hongmei1
(1. Department of Biochemistry and Molecular Biology,Guiyang Medical College,Guiyang 550004;2. Department of Clinical Laboratory,the Third People's Hospital of Hainan Province,Sanya 572000)
Preparation of prokaryotic expression constructs of human FGF21(fibroblast growth factor,FGF)cDNA and induction of recombinant hFGF21 protein expression. Total RNA was extracted from human liver, and the target cDNA fragment was obtained using RTPCR. The amplified cDNA fragment was cloned into pMD19-T for preservation. Then the expression construct pET-28a(+)-hFGF21 was successfully constructed and expressed with IPTG induction, and the his-hFGF21 protein was purified with histide-selective nickel affinity gel and identified by Western blot. Western blot analysis showed that the fusion protein had specific binding with a FGF21 antibody.
human FGF21;molecular cloning;prokaryotic expression;protein purification
10.13560/j.cnki.biotech.bull.1985.2015.04.032
2014-09-25
贵州省科技计划项目资助课题(黔科合LG字[2011]012号)
张礼林,女,硕士研究生,研究方向:基因工程药物;E-mail : 2751628863@qq.com
雷霆雯,女,教授,硕士生导师,研究方向:基因工程药物;E-mail:leitw@sina.com李红梅,女,副教授,博士,研究方向:基因工程药物;E-mail:gylhm@gmc.edu.cn
