黑曲霉柠檬酸工业菌株原生质体制备与转化
2015-10-26张晓立郑小梅满云罗虎于建东郑平刘浩孙际宾
张晓立郑小梅满云罗虎于建东郑平刘浩孙际宾
(1.天津科技大学生物工程学院,天津 300457;2.中国科学院系统微生物工程重点实验室,天津 300308;3.中国科学院天津工业生物技术研究所,天津 300308;4.中粮生物化学(安徽)股份有限公司,蚌埠 233010)
黑曲霉柠檬酸工业菌株原生质体制备与转化
张晓立1,3郑小梅2,3满云4罗虎4于建东2,3郑平2,3刘浩1孙际宾2,3
(1.天津科技大学生物工程学院,天津 300457;2.中国科学院系统微生物工程重点实验室,天津 300308;3.中国科学院天津工业生物技术研究所,天津 300308;4.中粮生物化学(安徽)股份有限公司,蚌埠 233010)
黑曲霉是柠檬酸工业化生产的主要发酵菌株。尽管现代遗传操作技术在黑曲霉的实验室菌株、蛋白质生产菌株等的应用中获得了成功,但是柠檬酸工业菌株遗传转化异常困难,成为柠檬酸工业持续升级的重要限制因素。以柠檬酸工业生产实际应用的黑曲霉菌株为研究对象,对其原生质体的制备与再生以及PEG介导的转化等条件进行了细致优化。结果表明,柠檬酸高产工业菌株原生质体的制备需选取丰富培养基中培养48 h的年轻菌丝体,在1.5%裂解酶-0.5%蜗牛酶-0.2%溶菌酶的复合酶解体系下裂解2.5 h,原生质体的制备浓度可达106个/mL以上,原生质体再生效率可达90%以上。原生质体的浓度是原生质体-PEG介导转化方法的关键,当原生质体浓度达到106个/mL以上时,高产柠檬酸菌株的转化效率大幅提高。成功建立了由原生质体-PEG所介导的高产柠檬酸黑曲霉菌株的遗传转化体系。
黑曲霉;柠檬酸;遗传操作系统;原生质体;DNA转化
柠檬酸是生物体代谢活动中重要的中间产物[1],也是在食品、医药、化工等领域应用最为广泛的有机酸之一[2,3]。全球每年生产和消耗柠檬酸1.5×106t以上,黑曲霉是柠檬酸生产的主力菌种。但高产柠檬酸黑曲霉菌株由于经历了长期的诱变筛选过程,细胞结构和遗传可能发生了未知的变化,遗传转化困难。至今为止,黑曲霉高产柠檬酸工业菌株的分子遗传操作尚无文献报道。为提升柠檬酸工业生产的竞争力,急需建立黑曲霉工业菌株的遗传转化和操作体系。
黑曲霉常用的遗传转化方法与其他丝状真菌一样,包括孢子电转化法[8]、农杆菌介导转化法[9]、原生质体介导的转化法等。Meyer 等[10]对这些转化方法的利弊进行了系统的分析,认为孢子电转化法操作简单,但转化效率低。农杆菌介导转化虽具有转化受体形式多样、转化效率较高、转化子稳定、可转移大片段、单拷贝比例高等优点,但其操作复杂,周期长,转化过程受多种因素影响[9]。 Michielse等[11]也明确指出农杆菌介导转化方法在黑曲霉中的转化效率较低。原生质体介导的转化方法包括原生质体电转化法与原生质体-PEG介导的转化法。姚婷婷等[12]在产酶的黑曲霉菌株中原生质体-PEG介导的转化效率更高。原生质体-PEG介导的转化方法也在不同野生型菌株或淀粉酶等黑曲霉生产菌株中得到成功实践,如野生菌株A. niger NCIM565[13]与A. niger N402[14]、淀粉酶生产菌株A. niger CICIM F0410[12]与A. niger T21[15]等。由此可见,原生质体-PEG介导的转化法对黑曲霉菌株而言是较为有效的遗传操作方法。
本研究以高产柠檬酸的工业生产实际使用的黑曲霉菌株为研究对象,通过优化培养基、培养方式、菌龄、酶解体系与酶解时间等研究其原生质体制备与再生的最佳条件,建立柠檬酸高产菌株原生质体-PEG介导的遗传转化体系,旨在为高产柠檬酸黑曲霉原生质体转化及黑曲霉工业菌株改造奠定基础。同时本研究对其他遗传操作困难的丝状真菌的分子改造具有一定借鉴意义。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒 柠檬酸工业生产使用的黑曲霉菌株:由中粮生物化学(安徽)股份有限公司提供,经过基因组测序分析鉴定,为由野生黑曲霉菌株Aspergillus niger D多轮诱变的A. niger Co827的衍生菌株。
用于遗传转化的质粒pGm:来源于文献[16],携带有amdS的筛选标记,由本实验室保存。
1.1.2 工具酶和试剂 工具酶:α-淀粉酶(30 U/μL)购自诺维信(中国)生物技术有限公司;来源于木霉的细胞裂解酶购自Sigma;溶菌酶购自北京鼎国昌盛生物技术有限责任公司;蜗牛酶购自北京经科宏达生物技术有限公司。试剂:培养基配制及原生质体制备所需试剂均为国产分析纯。
1.1.3 培养基
(1)产孢培养基:黑曲霉专用固体培养基90 g/L;
(2)合成培养基Czapek-Dox(CD):参照文献[14]配置;
(3)丰富培养基(CMA):葡萄糖20 g/L,麦芽糖浸提物20 g/L,蛋白胨1 g/L;
(4)柠檬酸发酵培养基(FC):玉米粉200 g/L,α-淀粉酶(30 U/μL)300 μL/L,CaCl21 g/L;
(5)筛选培养基:上层培养基MMSA:乙酰胺0.59 g/L,CsCl 3.4 g/L,KCl 0.52 g/L,KH2PO41.52 g/L,山梨醇1.2 mol/L,微量元素1 mL/L,葡萄糖 10 g/L,MgSO40.5g/L,1%低熔点琼脂糖;下层培养基MMS:成分与MMSA相同,1%琼脂糖。
微量元素:FeSO4·7H2O 1 g/L,ZnSO4·7H2O 8.8 g/L,CuSO4·5H2O 0.4 g/L,MnSO4·H2O 0.1 g/L,Na2B4O7·10H2O 0.1 g/L,(NH4)6Mo7O24·4H2O 0.05 g/L。
(6)原生质体再生培养基:上层培养基MMSA+NaNO3:NaNO30.6 g/L,CsCl 3.4 g/L,KCl 0.52 g/L,KH2PO41.52 g/L,山梨醇1.2 mol/L,微量元素1 mL/L(如筛选培养基MMS所列,不再赘述),葡萄糖 10 g/L,MgSO40.5g/L,1%低熔点琼脂糖。
下层培养基MMS+NaNO3:成分与MMSA+NaNO3相同,1%琼脂糖。
1.2 方法
1.2.1 原生质体制备 柠檬酸工业生产菌株在产孢培养基上34℃培养6 d收集孢子并用含0.05%(V/V)Tween-80的生理盐水[0.9%(W/V)NaCl]制备孢子悬液(107个/mL)。取适量的孢子悬液接种到200 mL丰富培养基CMA或合成培养基Czapek-Dox或柠檬酸发酵培养基FC中,孢子接种的终浓度为105个/mL,在旋转式摇床34℃,250 r/min的条件下摇瓶液体振荡培养不同时间。培养方式还采用液体静止培养,或在液体摇瓶振荡培养基中加入适量0.5 mm的玻璃珠。
采用八层纱布过滤收集菌丝球,然后用200 mL无菌蒸馏水清洗菌丝球,再用50 mL 溶液I(5 mmol/L K2HPO4、5 mmol/L KH2PO4、0.8 mol/L MgSO4,pH5.5)除去残留的培养基,并使菌丝球处于溶液I的状态下。将1 g菌丝球 加入到20 mL采用不同细胞裂解酶配比的细胞壁裂解液(以溶液I为基底缓冲液)中,在旋转式摇床30℃,200 r/min的条件下分别对细胞壁进行不同时间的裂解处理。用3层无菌高级擦镜纸过滤菌丝球裂解液收集原生质体,加入20 mL的溶液II(10 mmol/L Tris-HCl、50 mmol/L CaCl2、1.2 mol/L山梨醇,pH7.5)轻轻混匀后,3 000×g离心5 min,弃上清液,再用30 mL溶液II洗涤原生质体沉淀2次。最后将原生质体沉淀重悬于500 μL溶液II中,即为黑曲霉的原生质体悬液,可用于原生质体的再生与转化。
1.2.2 原生质体再生 原生质体再生采用双层平板法,首先在显微镜下用血球计数板对原生质体悬液进行计数,取100 μL原生质体悬液用溶液II进行适当稀释。以MMS+NaNO3作底层培养基,以含1%低熔点琼脂糖的MMSA+NaNO3与0.1 mL 原生质体稀释液混合作上层培养基,置30℃ 培养3-4 d,对形成的菌落进行计数(A)。为消除由未除尽的菌丝片段再生出的菌落所造成的误差,同时采用双层平板法将原生质体置于未添加渗透压稳定剂MgSO4的MMS+NaNO3培养基,其再生菌落数作为对照(B)。显微镜下观察的原生质体数计为(C)。再生率用下式计算:原生质体再生率=[(A-B)/C]×100%。
1.2.3 原生质体转化 取100 μL原生质体悬液,加入10 μg的高纯度质粒(质粒浓度应在1 μg/μL以上),再加入25 μL现用现配的溶液III(50%(W/V)PEG-4000、1 mmol/L CaCl2、10 mmol/L Tris-HCl,pH7.5),轻轻颠倒混匀,冰浴20 min,取出后缓缓加入1 mL 溶液III,2 mL 溶液II,轻轻颠倒混匀,将其与42℃孵育后以乙酰胺为唯一氮源的MMSA上层筛选培养基(1%低熔点琼脂糖)混匀后,平铺于下层MMS筛选培养基上,30℃培养5-7 d。
2 结果
2.1 原生质体制备与再生
2.1.1 培养基对原生质体形成与再生的影响 在接种量与培养条件相同的条件下,将柠檬酸工业生产菌株在CMA培养基、FC培养基与CD培养基上培养,采用相同方法制备原生质体,考察培养基种类对原生质体形成和再生的影响。结果发现,CD培养基中菌丝球生长缓慢,培养48 h后菌丝长度仅有10-20 μm左右,总菌体生物量较低,难以进行原生质体的制备;在CMA培养基及FC培养基中,菌丝球生长迅速,菌丝细而长,培养48 h后菌丝长度可达80-120 μm左右,总菌体生物量较大;CMA培养基中菌丝球较密实,FC培养基中菌丝球较疏松(图1)。使用FC培养基的情况下获得的原生质体数量达5.5×106个/mL,再生率为74.5%;使用CMA培养基形成的原生质体数量为2.5×106个/mL,其再生率高达92%。结果表明,使用不同的培养基对菌丝球形态、原生质体的形成数量与再生率具有显著影响。综合考虑,CMA培养基为原生质体制备与再生的最佳培养基。
2.1.2 菌丝体培养方式对原生质体形成的影响 菌丝体培养方式影响黑曲霉菌球形态,分别考察了液体静止培养、液体摇瓶培养、液体摇瓶加玻璃珠培养对原生质体形成的影响。结果发现,液体静止培养时菌体漂浮在液体表面,菌体呈球状聚集,菌体量较少;液体摇瓶加玻璃珠培养菌丝体呈球状,菌丝断裂,玻璃珠不仅没有把较大的菌丝球分解,反而对菌体有一定的损伤,制备的原生质体数目与再生率较低,分别为0.28×106个/mL、82.1%;液体摇瓶培养菌丝体呈球状,菌体量较大,菌丝细长,菌球相对疏松,原生质的数目为1.95×106个/mL,再生率较高为92.3%。因此,液体摇瓶培养是原生质体制备的最佳菌体培养方式。
2.1.3 菌龄对原生质体形成与再生的影响 为考察不同菌龄的菌丝球对原生质体制备与再生的影响,本试验选取菌龄为36 h、48 h、60 h、72 h的菌丝球进行原生质体的制备。如图2-A所示,不同生长时期的菌丝球对原生质体数量影响较大。菌龄为48 h的菌丝球酶解2.5 h获得的原生质体数最高,达到6.5×106个/mL,而培养时间更短或更长的菌丝球获得的原生质体数量都有几倍的降低,表明适度培养时间的幼嫩菌丝的细胞壁更易被酶解释放出原生质体。同样原生质体的再生率在菌龄48 h时达到最高(图2-B),为98%;随着菌龄的增长,原生质体再生率没有明显变化,均超过90%。
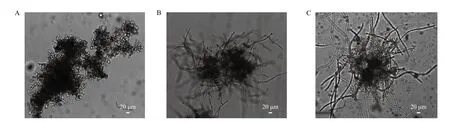
图1 柠檬酸工业生产黑曲霉菌株在不同培养基中菌丝球形态
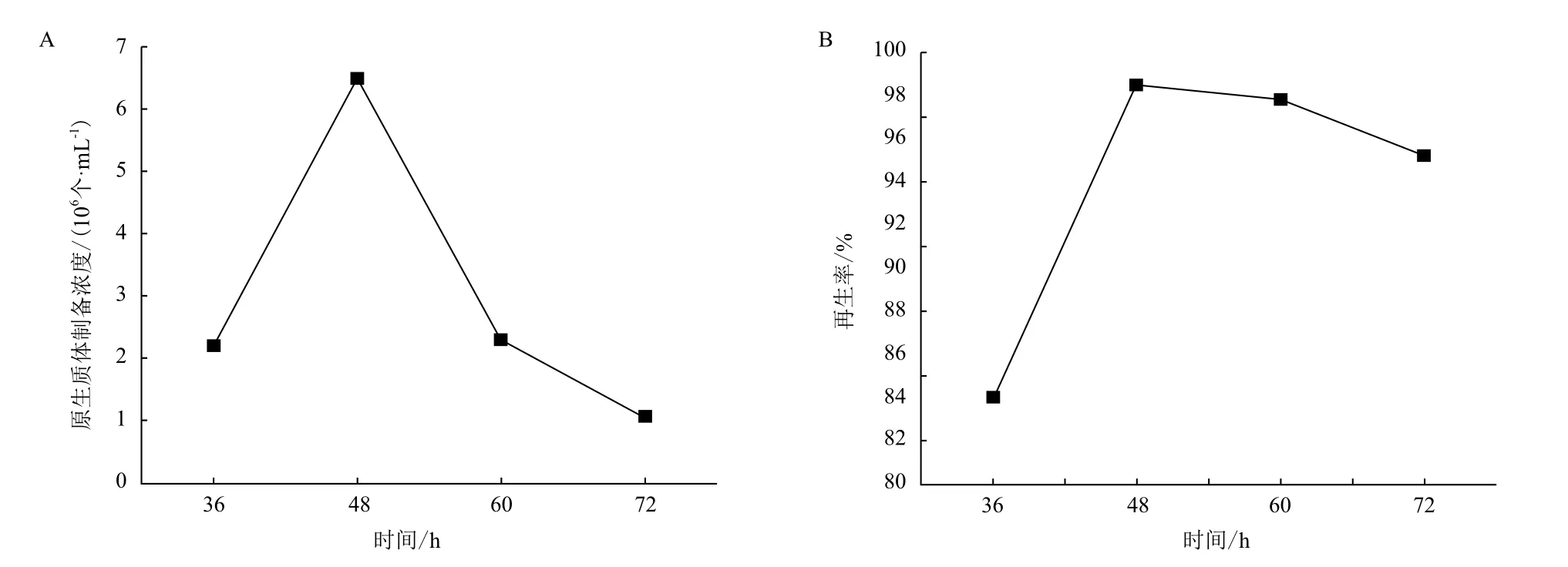
图2 培养时间-菌龄对原生质体制备(A)与再生(B)的影响
2.1.4 酶解体系与浓度对原生质体形成的影响 为研究柠檬酸工业生产黑曲霉菌株的最佳酶解体系,采用不同的酶解体系对CMA培养基液体摇瓶培养48 h的菌丝球进行原生质体的制备。结果(表1)表明,用不同配比的酶解液来酶解菌丝球均可获得原生质体,但是效果不同。当裂解酶、蜗牛酶与溶菌酶以不同的方式组合时,其裂解效果均比裂解酶单酶裂解效果好。其中裂解酶的浓度是关键,1.5%(W/V)高浓度的裂解酶比1%(W/V)浓度的裂解酶裂解效果好。总体来看,1.5%裂解酶、0.5%蜗牛酶与0.2%溶菌酶的酶解体系原生质体的制备效果最好,达3.2×106个/mL。
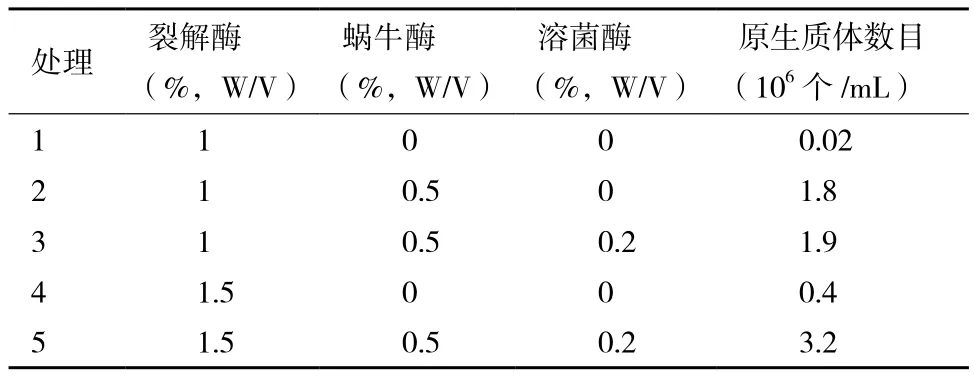
表1 不同酶解体系对原生质体制备的影响
2.1.5 酶作用时间对原生质体形成与再生的影响 为研究柠檬酸工业生产黑曲霉菌株的最佳酶解时间,采用1.5%裂解酶、0.5%蜗牛酶、0.2%溶菌酶的酶解体系对CMA培养基液体摇瓶培养 48 h的菌丝球进行原生质体的制备与再生检测。结果(图3)表明,随着酶解时间的延长,原生质体数逐渐增加,2.5 h 达到最高为1.84×106个/mL。同时2.5 h时原生质体的再生率也达到最高为96.7%。酶解时间超过2.5 h后,原生质体的制备效率与再生率出现明显的下降。因此,高产柠檬酸生产菌株的原生质体制备与再生的最佳酶解时间为2.5 h,并且酶解后应尽快除去酶解液,以防止过度裂解,降低原生质体的制备与再生效率。
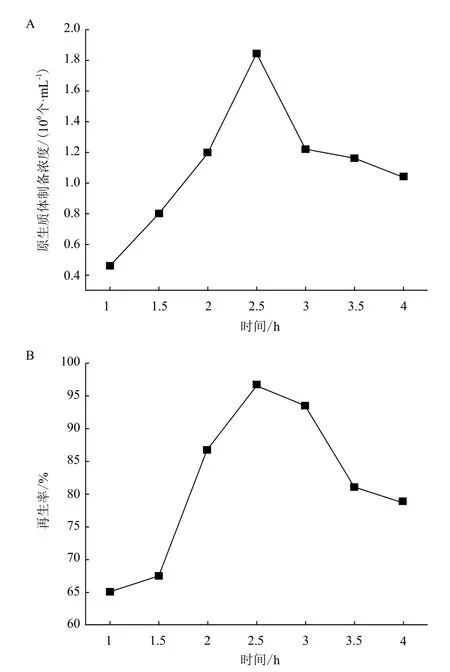
图3 酶解时间对原生质体制备(A)与再生效率(B)的影响
2.1.6 原生质体转化 采用PEG-4000-CaCl2介导的化学转化法将带有amdS筛选标记的质粒pGm转化至柠檬酸工业生产黑曲霉菌株的原生质体中。结果表明,随着原生质体数量的增加,转化率也相应的增加,当原生质体数目达106个/mL时,转化率为3-4个转化子/μg DNA。
3 讨论
近年来随着传统诱变技术对高产柠檬酸黑曲霉工业菌株的生产性能提升效果越来越有限,建立有效的遗传操作系统,通过分子改造提升菌株生产性能引起了人们的重视。本研究从培养基、菌丝培养方式、菌龄、酶解体系与酶解时间等不同方面对高产柠檬酸黑曲霉菌株的原生质体-PEG介导的遗传转化方法进行了系统探索,建立了高产柠檬酸黑曲霉原生质体遗传转化体系。
菌球形态是影响高产柠檬酸黑曲霉菌株原生质体制备的一个重要因素。前期研究发现具有不同菌体形态的产柠檬酸的不同黑曲霉菌株,其原生质体制备的效果差异较大。例如,黑曲霉野生型菌株菌球疏松,菌丝细长,形成的原生质体数量多;相反柠檬酸高产菌株菌球密实,菌丝短粗,形成的原生质体数量较少,不易于原生质体的制备,这可能是由于菌丝体与酶解体系接触表面积小造成的。
因此提出在保证一定菌体量的前提下,影响菌丝形态的因素,如培养基与培养方式,都会显著影响原生质体的形成与再生。本研究发现,CMA与FC培养基尽管都能够使菌体大量快速生长以保证原生质体制备所需的菌体量,但是培养的菌体形态存在较大不同。在FC培养基中菌丝细长,菌球疏松,获得的原生质体数多,可达到5.5×106个/mL;而在CMA培养基中菌球较密实,形成的原生质体数量较少为2.5×106个/mL,该结果从原生质体制备的结果来看,菌丝细长,菌球疏松比较利于原生质体的制备,与朱萍等[17]报道一致。而合成培养基CD因为营养成分不足导致菌丝量较少,显然不满足原生质体制备需要。
液体静置培养方式尽管因为供氧相对不足导致黑曲霉菌球相对松散,但由于生长过于缓慢,达不到原生质体制备所需的生长量,因而不适合;在液体摇瓶中加玻璃珠有助于菌体分散,然而我们发现玻璃珠将细长菌丝打断,反而降低了原生质体制备与再生效率。在本试验体系中液体摇瓶培养的效果更好。
本研究认为影响原生质体形成与再生的另一个主要因素是细胞壁结构与组成成分。其中一个表现是菌龄对原生质体的制备与再生影响显著。我们发现处于对数生长期的培养48 h菌体的原生质体制备和再生效果最好,培养36 h的菌体在原生质体形成和再生方面都是最差的,而超过60 h的菌体尽管形成原生质体的数量低,但对再生效率影响小。这可能是由于不同生长阶段的菌丝的细胞壁结构与组成成分不同[12],对裂解酶系的敏感性不同,形成的原生质体数目及原生质体再生能力也就不同。过于幼嫩的菌丝虽然细胞壁容易被酶解,但是相对细胞膜也容易破裂,因而得到原生质体的产量低;即使能形成原生质体,但也可能由于细胞膜不够完整或者细胞活力不强,导致细胞再生难度大。而菌龄过长的菌体细胞壁会沉积不宜被酶降解的物质,不利于原生质体的形成与释放[18],原生质体的形成数量减少,但其细胞结构可能相对完整且细胞活力强,因而对原生质体再生影响小。
有研究表明黑曲霉原生质体得率与酶解体系组成及配比关系密切。 Hamlyn等[19]就曾报道使用微生物产生的酶复合体或者商品酶的混合液制备原生质体比单独使用一种酶的效果好。本试验采用的混合酶系形成的原生质体数量是文献报道[12]的2倍。各种酶的浓度配比和酶解时间需要根据特定菌株的细胞特性进行优化,原则是既有利于原生质体的释放,又不要过度酶解降低原生质体的稳定性。原生质体的浓度和再生率对转化率的影响较大[20,21]。周礼红等[21]发现较高的转化效率需要合适的原生质体浓度,本研究中高产柠檬酸黑曲霉菌株原生质体的浓度只有达到106个/mL以上,转化效率才显著提高,低于此浓度则难以获得转化子。由此可见,由于高产柠檬酸黑曲霉菌株经过复杂诱变,细胞壁组成与结构复杂,制备高浓度可再生的原生质体是能够成功完成DNA转化的关键。
4 结论
首次成功建立了以原生质体-PEG法介导的柠檬酸生产菌株黑曲霉的遗传转化体系。以丰富培养基(CMA)液体摇瓶培养48 h的菌丝体,采用1.5%裂解酶-0.5%蜗牛酶-0.2%溶菌酶的复合酶解体系酶解2.5 h后,可获得高质量原生质体并可成功进行DNA转化,为柠檬酸工业黑曲霉菌株的分子改造奠定坚实基础。
[1]高年发, 张健, 高强, 等. 黑曲霉柠檬酸发酵机制研究的新进展[C]. 发酵有机酸科技交流, 2009:6-19.
[2]王玉堂, 刘绯. 我国斑点叉尾鮰产业发展现状及对策[J]. 中国水产, 2007, 12:14-16.
[3]周进. 斑点叉尾鮰肌肉营养的分析[J]. 河北渔业, 2003, 1:17-19.
[4] 郭艳梅, 郑平, 孙际宾. 黑曲霉作为细胞工厂:知识准备与技术基础[J]. 生物工程学报, 2010, 10;26(10):1410-1418.
[5] Weenink XO, Punt PJ, van den Hondel CA, Ram AFJ. A new method for screening and isolation of hypersecretion mutants in Aspergillus niger[J]. Appl Environ Microbiol, 2006, 69(6):711-717.
[6]Fleissner A, Dersch P. Expression and export:recombinant protein production systems for Aspergillus[J]. Appl Microbiol Biotechnol,2010, 87(4):1255-1270.
[7]Cherry JR, Fidantsef AL. Directed evolution of industrial enzymes:an update[J]. Curr Opin Biotechnol, 2003, 14(4):438-443.
[8]Ozeki K, Kyoya F, Hizume K, et al. Transformation of intact Aspergillus niger by electroporation[J]. Biosci Biotechnol Biochem, 1994, 58(12):2224-2227.
[9] Meyer V. Genetic engineering of filamentous fungi -Progress,obstacles and future trends[J]. Biotechnology Advances, 2008,26:177-185.
[10] Meyer V, Mueller D, Till S, et al. Comparison of different transformation methods for Aspergillus giganteus[J]. Curr Genet, 2003, 43(5):371-377.
[11] Michielse CB, Hooykaas PJ, van den Hondel CA, Ram AF. Agrobacterium-mediated transformation as a tool for functional genomics in fungi[J]. Curr Genet, 2005, 48:1-17.
[12] 姚婷婷, 王正祥. 黑曲霉原生质体的制备、再生及转化条件[J]. 食品与生物技术学报, 2006, 4(25):116-120.
[13] Ahuja M, Punekar NS. Phosphinothricin resistance in Aspergillus niger and its utility as a selectable transformation marker[J]. Fungal Genetics and Biology, 2008, 45:1103-1110.
[14] Carvalho ND, Arentshorst M, Jin Kwon M. et al. Expanding the ku70 toolbox for filamentous fungi:establishment of complementationvectors and recipient strains for advanced gene analyses[J]. Microbiol Biotechnol, 2010, 87:1463-1473.
[15] Liu L, Liu J, Qiu RX, et al. Improving heterologous gene expression in Aspergillus niger by introducing multiple copies of proteinbinding sequence containing CCAAT to the promoter[J]. Microbiology, 2003, 36, 358-361.
[16] 孙晶, 李景鹏, 王敖全, 等. 黑曲霉pepB 基因缺失菌株的构建及其功能分析[J]. 微生物学报, 2004, 6(44):766-770.
[17] 朱萍, 梁海秋, 张弘, 等. 黑曲霉Ni-5k 原生质体的制备和再生[J]. 广西农业生物科学, 2005, 4(24), 339-342.
[18] 王赓, 杜连祥. 新月弯孢霉原生质体制备及再生条件的研究[J]. 微生物学通报, 1999, 26(1):21- 23.
[19]Hamlyn PF, Bradshaw RE, Mellon FM, et al. Efficient protoplast isolation from fungi using commercial enzymes[J]. Enzyme Microbial Tech, 1981, 3:321- 325.
[20] 苏彩云, 靳发彬, 张佳, 等. 丝状真菌的DNA转化方法[J].河北化工, 2007, 7(30):29-31.
[21] 周礼红, 王正祥, 诸葛健. 红曲霉不同转化方法的比较[J].遗传技术与方法, 2006, 28(4):479-485.
(责任编辑 李楠)
Preparation of Protoplast for Efficient DNA Transformation of Citric Acid Hyper-producing Aspergillus niger Industrial Strain
Zhang Xiaoli1,3Zheng Xiaomei2,3Man Yun4Luo Hu4Yu Jiandong2,3Zheng Ping2,3Liu Hao1Sun Jibin2,3
(1. School of Biological Engineering,Tianjin University of Science and Technology,Tianjin 300457;2. Key Laboratory of Systems Microbial Biotechnology,Chinese Academy of Sciences,Tianjin 300308;3. Tianjin Institute of Industrial Biotechnology,Chinese Academy of Sciences,Tianjin 300308);4. COFCO Biochemical(Anhui)Co.,Ltd.,Bengbu 233010)
Aspergillus niger is the major industrial strain for citric acid production. In spite of many successes of modern molecular biology approaches in engineering laboratory or protein-producing strains of A. niger, there is few positive report on its application for citric acid industrial strains mainly due to the hard-to-transform nature of these strains. In this study, the protoplast-PEG mediated genetic transformation system for citric acid industrial strain was extensively studied, suggesting an optimized protocol for protoplast preparation, regeneration and DNA transformation. The concentration of protoplasts reached up to 106/mL by lysing younger mycelia for 2.5 h after 48 h incubation of a proper amount of conidia spores in enrichment medium. The optimal lysing enzyme mixtures comprised of 1.5% lysing enzyme, 0.5% snail enzyme and 0.2% lysozyme. Concentration of protoplast influenced the protoplast-PEG mediated transformation efficiency, which reached the maximal when the concentration of protoplast was higher than 106/mL. The genetic transformation system established in this study should pave the way to molecular biology study of the citric acid hyper-producing strains, for further understanding its acid-tolerant physiology and for rational design of the industrial strain for further improvement of the citric acid production process as well as creation of new organic acid-producing cell factories.
Aspergillus niger;citric acid; genetic manipulation system;protoplast;DNA transformation
10.13560/j.cnki.biotech.bull.1985.2015.04.025
2014-09-23
国家“863”计划(2013AA020302),国家自然科学基金面上项目(31370113)
张晓立,女,硕士研究生,研究方向:轻工技术与工程;E-mail:xiaolizhang0607@sina.com;郑小梅为本文并列第一作者,E-mail:zheng_xm@tib.cas.cn
孙际宾,男,研究员,博士生导师,研究方向:微生物代谢工程与系统生物技术;E-mail:sun_jb@tib.cas.cn
