半滑舌鳎性逆转的遗传特性研究
2015-10-26宋超蒋丽王景伟3李晓芳李耕张晓慧王书刘哲李恒德
宋超蒋丽王景伟,3李晓芳李耕张晓慧王书刘哲李恒德
(1.甘肃农业大学动物科学技术学院,兰州 730070;2.中国水产科学研究院生物技术研究中心,北京 100141;3.福建农林大学动物科学学院,福州 350002;4.中捷罗非鱼养殖有限公司,黄骅 061108;5.中国水产科学研究院营口增殖试验站,营口 115000;6. 中国水产科学研究院,资源与环境研究中心,北京 100141)
半滑舌鳎性逆转的遗传特性研究
宋超1,2蒋丽2王景伟2,3李晓芳4李耕5张晓慧6王书2刘哲1李恒德2
(1.甘肃农业大学动物科学技术学院,兰州 730070;2.中国水产科学研究院生物技术研究中心,北京 100141;3.福建农林大学动物科学学院,福州 350002;4.中捷罗非鱼养殖有限公司,黄骅 061108;5.中国水产科学研究院营口增殖试验站,营口 115000;6. 中国水产科学研究院,资源与环境研究中心,北京 100141)
半滑舌鳎雌雄个体生长差异悬殊,由于性逆转而造成的其群体中雌性比例过低大大制约了养殖效率。性逆转是鱼类及两栖类生物性别决定事件中有趣的生物学问题,其发生的遗传机制鲜有研究。在该研究中,分别利用雄鱼和伪雄鱼组建10个半同胞家系,对这10个半同胞家系中的子代雌雄比进行研究,结果发现,2个伪雄鱼的家系,其后代个体中遗传雌性鱼全部逆转为生理雄鱼;在另外8个雄鱼家系中其性逆转比呈连续分布,表现为典型的数量性状特征;半滑舌鳎性逆转的遗传力较低,仅为0.058。以上结果表明,伪雄鱼作为父本的遗传可能为完全的父本效应遗传,性逆转由于其较低的遗传力不适合于做家系选育而适合于做家系内的选育或结合分子标记的遗传评估,以提高雌性比的遗传进展,半滑舌鳎逆转比的数量遗传特征说明其性别决定是多基因作用的结果。
半滑舌鳎;性别决定;性逆转
半滑舌鳎隶属于鲽形目(Pleuronectiformes)、舌鳎科(Cynoglossidae)、舌鳎属(Cynoglossus),主要分布于我国黄、渤海近海区域。半滑舌鳎由于具有强适应性、高营养价值、味道鲜美等特点,成为当前海水养殖的重要品种之一[1]。半滑舌鳎雌、雄鱼生长速度差异比较大,雌鱼的生长速度是雄鱼的2-4倍,雄鱼经过两年培育尚不能达到商品规格,并且在苗种期存在着遗传雌鱼向表型雄鱼单向性逆转的现象[2,3]。在实际大生产的群体中,由于没有对雌雄亲本进行遗传鉴定,最终的雌雄比例往往不能确定,一般养殖场购买的苗种其雌性比例都在25%以下,最低的时候甚至连20%都难以保证,严重制约了生产效益的提高。尽管近些年半滑舌鳎的苗种繁育、健康养殖都得到了良好的发展,但其稳定、高比例的雌性苗种率及其稳步提高的问题一直是半滑舌鳎养殖中急需要解决的问题。
性别决定的机制可以被划分为两种类别:一种是遗传性别决定(genetic sex determination,GSD);另外一种是环境性别决定(environmental sex determination,ESD)。一种生物的最初性别是由其可遗传的遗传元件决定,从受精开始雌雄个体间的遗传物质就不同;然而环境性别决定在受精时却没有初始的性别,它是在生物系统发育过程中决定其性别的[4-6]。半滑舌鳎性染色体为ZW型,即雌性异配型(ZW)[7]。Chen等[8]利用自主开发的若干雌性特异性标记,通过染色体核型分析发现了成对的大型染色体,即为性别染色体Z和W。在舌鳎的人工养殖群体中至今还没有发现有WW成年个体的存在[2],事实上利用人工雌核发育创制超雌WW的个体研究表明其超雌个体可能只能存活到肌节期和出膜前期[9,19],这说明半滑舌鳎WW个体可能是由于缺乏Z染色体的功能而在出膜前期致死,而试图利用超雌鱼实现生产上的全雌化还有一定的距离,加之即使能制备超雌,超雌鱼的生产性能如何还是未知数。
半滑舌鳎的性别决定受温度等外界环境的影响比较大,使得其性别具有较大的可塑性[10]。在养殖过程中,人为地控制温度、使用激素等可以使鱼类的性别发生逆转。如邓思平等[11]通过控制养殖温度,出现了由遗传雌性向表型雄性逆转的伪雄个体。张晓彦等[12]利用天然激素17 β-雌二醇处理半滑舌鳎幼鱼得到了高达97%的雌性率。除了人工诱导的性逆转之外,在自然界中也存在着性逆转的现象,如黄鳝(Monopterus albus)[13]、石斑鱼(Epinephelus akaara)[14]、黑鲷(Acanthopagrus schlegelii)[15]等雌雄同体鱼类,以及青鳉(Oryzias latipes)[16]、半滑舌鳎(Cynoglossus semilaevis)[3,17]等雌雄异体鱼类。由于在半滑舌鳎养殖过程中使用激素来提高雌性率,此做法有食品安全和影响环境的弊端,不适宜生产性应用;而控制温度只能诱导半滑舌鳎雌鱼性逆转成雄鱼,不能达到提高养殖群体中的雌性比例的目的。利用伪雄鱼(ZW)建立的家系,其后代遗传雌鱼性逆转成生理雄鱼的比例高达91.4%[10,23]。研究发现,养殖过程中不同家系之间的生理雌雄比例存在着差异[18],但是目前还未见对性逆转进行遗传特性分析的报道。因此从群体的角度来研究不同家系间半滑舌鳎性逆转的遗传特性,对利用性别遗传特性进行遗传选育研究具有重要意义。
1 材料与方法
1.1 材料
2013年4月在河北中捷养殖厂进行半滑舌鳎亲鱼选育,轻压半滑舌鳎亲鱼的腹部采集精、卵建立10个家系,各家系在工厂化养殖模式下同池养殖,在这10个家系中以不同的雌性亲鱼(雌性亲鱼都为2龄)分为5组;第1组为1、2家系;第2组为12、14家系;第3组为16、17家系;第4组为19家系;第5组为38、39、40家系。第1、2组中的雄性亲鱼为3龄;第3、4组中的雄性亲鱼为4龄;第5组中的雄性亲鱼为2龄。在建立家系的同时,采集少量亲鱼鳍条以备后用。
1.2 方法
1.2.1 样品采集 2013年9月采集样品。随机捞取300尾F1代样本(理论上每家系捞取30尾),从鱼的腹部用强光照射,根据陈松林等[18]的方法用强光从鱼背面的性腺位置照射,在腹面用肉眼观察性腺的颜色和形状,并做雌雄记录。再解剖镜下取鱼的性腺放入Bouin氏液中(苦味酸饱和液∶甲醛∶冰醋酸=15∶5∶1),24 h之后将样品转移至70%酒精常温下可长期保存,并做好对应的标记。剪取适量的组织样品放入离心管中4℃保存以备用,并做好相应标记。
1.2.2 性别鉴定
1.2.2.1 遗传性别鉴定 基因组DNA提取:采用海洋动物组织基因组DNA快速提取试剂盒(北京艾德莱生物科技有限公司)提取DNA,溶解于50 μL TE中,用1.2%的琼脂糖凝胶电泳检测,4℃保存备用。根据Chen等[19]设计引物序列为:上游序列:GAGGCCGACAGGATCGTAC;下游序列:TACGACGTACTCCGGTGGTTTT 。引物由上海生工生物技术有限公司合成。PCR反应体系为20 μL,其中包括mix 10 μL,上下游引物各1 μL,模板1 μL,加ddH2O补足20 μL。PCR反应程序为:95℃预变性5 min,95℃(30 s),57℃(30 s),72℃(30 s),35个循环,72℃延伸7 min。PCR产物用3%的琼脂糖凝胶电泳检测,电压100 V,电泳时间1 h,检测出现两条带(218 bp,206 bp)的为雌鱼(ZW),出现一条带(206 bp)的为雄鱼(ZZ)。
1.2.2.2 生理性别鉴定 生理性别鉴定用石蜡组织切片的方法,将固定好的性腺进行各级脱水(70%、80%、90%、95%酒精、无水乙醇),透明,浸蜡,包埋。然后进行切片,切片仪为SYD-S2020型,切片厚度为6 μm,然后用蒸馏水展片,展片仪为Leica,HI1220型。37℃烘干12 h后HE染色,封片后于光学显微镜下观察并拍照。
1.2.3 亲子鉴定 本试验中的10个家系由于是同池养殖,所以为了统计每个家系中的各项试验指标,需要做亲子鉴定。针对亲子鉴定,本试验筛选了15对引物(表1)[20]送北京阅微基因技术有限公司利用毛细管电泳技术进行SSR分型检测,测序仪为3730XL DNA analyzer(ABI公司),检测结果用Cervus 3.0软件根据LOD值(似然率E的自然对数值)的高低判定亲子关系[21]。

表1 半滑舌鳎亲子鉴定引物设计
第14、17这两个家系中的雄性亲鱼为自然性逆转的伪雄鱼。
1.2.4 统计分析
1.2.4.1 家系间的遗传性别比例的差异分析 该分析只对将遗传性别作为一个性状,0表示雄性,1表示雌性,采用logistic分析家系间是否有显著差异。

其中,logit(xij)=log(px/(1-px)),p为遗传雌性比例,μ为群体均值,di为第i条雌鱼,sj(di)为第i条雌鱼配对的第j条雄鱼。
1.2.4.2 家系间的性逆转的差异分析 该分析只对所有遗传雌性将是否发生性逆转作为一个性状,0表示未发生性逆转,1表示发生性逆转。采用logistic分析家系间是否有显著差异,并剖分家系间和家系内的方差组分。
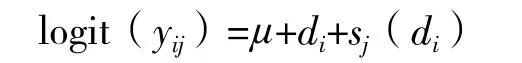
其中,logit(yij)=log(py/(1-py)),p为性逆转比例,μ为群体均值,di为第i 雌鱼,sj(di)为第i条雌鱼配对的第j条雄鱼。
1.2.4.3 性逆转的遗传力 由于试验设计为嵌套模型,采用logistic回归模型估计方差组分,其遗传力计算公式为:

2 结果
2.1 各家系伪雄鱼、雄鱼和雌鱼所占比例
试验发现(图1),不同家系间伪雄鱼、雄鱼和雌鱼所占比例有明显的差异,1-8号家系为正常遗传雄鱼做父本,伪雄鱼所占比例分别为1.5%,30.8%,10.0%,14.3%,17.1%,0.0%,12.5%,17.6%,其中6号家系中的遗传雌鱼不发生性逆转,1号家系性逆转比例很低,其余6个家系存在不同程度的性逆转;9和10号家系为伪雄鱼做父本,其后代中遗传雌鱼全部逆转为生理雄鱼,考虑到在取样时1-10号家系,可能存在偏取样导致所取的样本中雄性偏多,进而导致各个家系中遗传雄鱼的比例偏高,但是这并不影响为性逆转率高低的判定。
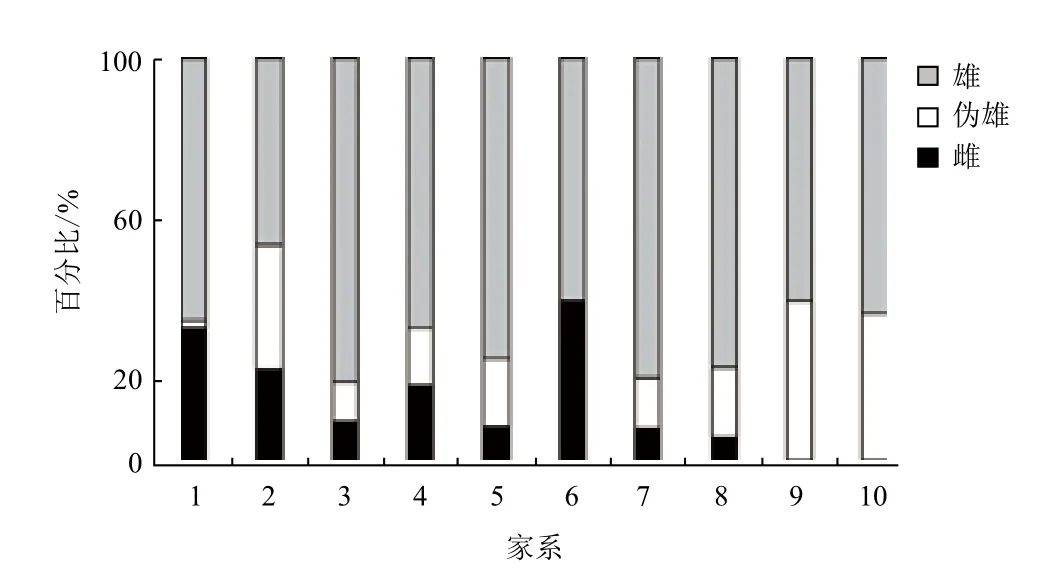
图1 各个家系雄鱼和伪雄鱼所占百分比
2.2 肉眼观察半滑舌鳎性成熟之前的生理性别的准确性
在腹面用肉眼观察性腺的颜色和形状,雌鱼的性腺比较狭长,颜色呈淡黄色或透明状;雄鱼的性腺短而小,颜色呈黑色或深蓝色,通过对肉眼观察与石蜡切片(图2)观察半滑舌鳎性成熟之前的生理性别比较(表2)。

图2 组织切片法与H.E染色法区分半环舌鳎表型性别

表2 肉眼观察和组织切片判断半滑舌鳎性成熟之前的生理性别的准确性比较
将用肉眼判断的样本全部进行组织切片和分子标记雌雄鉴定,结果发现,通过石蜡切片能够准确判断半滑舌鳎的生理性别,准确性为100%;而通过肉眼观察判断半滑舌鳎生理性别的准确性较低,准确性仅为54.70%。结果表明通过肉眼观察判断半滑舌鳎性成熟之前的生理性别的可靠性较低,所以在以后的试验过程中应采用组织切片观察判断生理性别。
2.3 性逆转的遗传力
方差组分分析的结果(表3)显示,看出雌鱼和雌鱼内雄鱼之间的变异都比较大,根据公式算得的性逆转的遗传力为0.058,属低遗传力。因此在实际选育低性逆转比例的家系时,必须同时考虑雌鱼和雄鱼的影响。
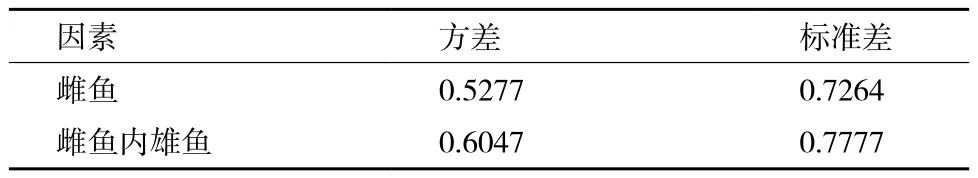
表3 方差组分剖分结果分析
3 讨论
3.1 父本伪雄鱼的遗传规律与生产利用
通过试验发现,伪雄鱼的后代全部为生理雄性,即遗传雌性的鱼100%都发生了性逆转,说明伪雄鱼的遗传是完全的父本效应,与母本无关,该结果与陈松林等[22,23]通过大量家系性别比例检测以及DNA甲基化分析所获得的结果相一致,即伪雄鱼的染色体的DNA甲基化修饰模式与其后代一致。由正常父本(ZZ)组建的群体后代中,其ZW型的遗传雌鱼能在一定的外界环境条件下逆转为生理雄鱼,而该生理雄鱼再做父本组建的后代群体中,其伪雄性状就会通过父本决定下来,这可能是一个比较典型的获得性遗传性状,在理论研究中具有重要的意义。伪雄鱼在配子体发生过程中如何避免发生染色质重编程的分子机制应该是有重要意义的研究领域,同时该分子机制的探索将为性状的固定提供新的视角。该遗传规律从亲本层面解释了在半滑舌鳎种苗大生产中雄性过多,雌雄比例不稳定的现象,因此在生产实践中,避免使用伪雄鱼将是调控舌鳎雌性比例的重要手段。
3.2 选育提高雌性比例
研究发现性逆转的遗传力非常低,传统鱼类的选育靠建立家系,以家系选育为主,一般高遗传力的性状适用于家系间选育,低遗传力的性状适用于家系内选择,要从选育上控制舌鳎性逆转,必须关注家系内的变异。传统选育的经济性状,如生长性状,其遗传力较高,往往采用家系间选育,因此以多性状为育种目标时,应将家系间选择和家系内选择结合起来,根据经济权重建立综合选择指数,以达到选育目标。
由于采用传统的以系谱为基础的BLUP遗传评估,其准确性对低遗传力性状来说很低,因此结合分子标记进行遗传评估是进行调控雌雄比例的一个有效手段,特别是以高通量标记为基础的遗传评估方法,更适合于低遗传力的性状,也是下一步的重点研究方向。
在性逆转这个性状上,雌性和雄性间的差异都比较大而其遗传力比较低,因此杂交手段也是控制性逆转的重要方法。对亲本进行配合力测定,充分评估各个亲本对性逆转的影响,建立相应品系,然后通过杂交来提高雌性比例。这种方法不仅可以对一个性状进行,也可以进行多性状的选育。
4 结论
利用伪雄鱼建立的家系其后代的遗传雌鱼更容易逆转为生理雄鱼,性逆转比例高达100%;而利用正常雄鱼建立的家系其后代的性逆转的比例呈连续性分布,表现为典型的数量性状特征;利用数量遗传学分析得出半滑舌鳎性逆转的遗传力较低,仅为0.058,从而表明,伪雄鱼作为父本的遗传可能为完全的父本效应遗传,性逆转由于其较低的遗传力不适合做家系间选育,而适合于做家系内的选育或结合分子标记的遗传评估。此外,利用手电照射半滑舌鳎的腹部肉眼判断其生理性别的准确性仅为54.70%,可靠性比较低。
[1] 姜言伟, 万瑞景. 渤海半滑舌鳎早期形态及发育特征的研究[J]. 海洋水产研究, 1988(9):193-201.
[2] 孟田湘, 任胜民. 渤海半滑舌鳎的年龄与生长[J]. 海洋水产研究, 1988, 9:173-183.
[3] 季相山, 陈松林, 马洪雨, 等. 半滑舌鳎养殖群体中自然性逆转伪雄鱼的发现[J]. 水产学报, 2010, 34(2):322-327.
[4] Bull JJ. Evolution of sex determining mechanisms[M]. Benjamin/ Cummings Publishing Company, Inc. , Menlo Park, CA. 1983.
[5] Stelkens RB, Wedekind C. Environmental sex reversal, Trojan sex genes, and sex ratio adjustment:conditions and population consequences[J]. Molecular Ecology, 2010, 19(4):627-646.
[6] Matsumoto Y, Crews D. Molecular mechanisms of temperaturedependent sex determination in the context of ecological developmental biology[J]. Molecular and Cellular Endocrinology,2012, 354(1):103-110.
[7] 周丽青, 杨爱国, 柳学周, 等. 半滑舌鳎染色体核型分析[J].水产学报, 2005, 29(3):417-419.
[8] Chen S, Tian Y, Yang J, et al. Artificial gynogenesis and sex determination in half-smooth tongue sole(Cynoglossus semilaevis)[J]. Marine Biotechnology, 2009, 11(2):243-251.
[9] 李虎, 陈四清, 刘海金, 姜宏波, 王美玉. 半滑舌鳎养殖群体的性比与雌雄形态差异比较[J]. 水产学报, 2012, 36(9):1331-1336.
[10] 梁卓, 陈松林, 张静, 等. 半滑舌鰨养殖群体雌雄比例与自然性逆转率[J]. 中国水产科学, 2013, 20(1):44-49.
[11] 邓思平, 陈松林, 田永胜, 等. 半滑舌鳎的性腺分化和温度对性别决定的影响[J]. 中国水产科学, 2007, 14(5):714-719.
[12] 张晓彦, 刘海金. 17β-雌二醇对半滑舌鳎性分化和生长的影响[J]. 东北农业大学学报, 2009, 40(6):67-72.
[13] 程翠, 曲宪成. 黄鳝性逆转研究进展[J]. 湖南农业科学,2010, (1):121-124.
[14] 邢晨光, 金珊, 袁思平. 石斑鱼性逆转研究现状[J]. 水产科学, 2006, 25(4):214-216.
[15] 刘绪生, 梁冰, 张树义. 黑鲷DMRT1基因cDNA的克隆、组织表达谱及在性别逆转前后性腺中的表达[J]. 动物学研究,2004, 25(2):158-161.
[16] Otake H, Shinomiya A, Matsuda M, et al. Wild-derived XY sexreversal mutants in the medaka, Oryzias latipes[J]. Genetics, 2006, 173(4):2083-2090.
[17] 马学坤, 柳学周, 温海深, 等. 半滑舌鳎性腺分化的组织学观察[J]. 海洋水产研究, 2006, 27(2):55-61.
[18] 陈松林, 李仰真, 张静, 等. 半滑舌鳎快速生长及高雌性家系的筛选[J]. 水产学报, 2013, 37(4):481-488.
[19] Chen SL, Ji XS, Shao CW, et al. Induction of mitogynogenetic diploids and identification of WW super-female using sexspecific SSR markers in half-smooth tongue sole(Cynoglossus semilaevis)[J]. Marine Biotechnology, 2012, 14(1):120-128.
[20] Liao X, Ma HY, Xu GB, et al. Construction of a genetic linkage map and mapping of a female-specific DNA marker in half-smooth tongue sole(Cynoglossus semilaevis)[J]. Marine Biotechnology,2009, 11(6):699-709.
[21] 张志和, 沈富军, 孙姗, 等. 应用微卫星分型方法进行大熊猫父亲鉴定[J]. 遗传, 2003, 25(5):504-510.
[22] Shao CW, Li QY, Chen SL, et al. Epigenetic modification and inheritance in sexual reversal of fish[J]. Genome Research,2014, 24(4):604-615.
[23] Chen SL, Zhang GJ, Shao CW, et al, Whole-genome sequence of a flatfish provides insights into ZW sex chromosome evolution and adaptation to a benthic lifestyle[J]. Nature Genetics, 2014, 46(3):253-260.
(责任编辑 李楠)
Studies on Genetic Features of Sex Reversal in Cynoglossus semilaevis
Song Chao1,2Jiang Li2Wang Jingwei2,3Li Xiaofang4Li Geng5Zhang Xiaohui6Wang Shu2Liu Zhe1Li Hengde2
(1. College of Animal Science and Technology,Gansu Agricultural University,Lanzhou 730070;2 Biotechnology Center,Chinese Academy of Fishery Sciences,Beijing 100141;3.College of Animal Science,Fujian Agricultural University,Fuzhou 350002;4. Zhongjie Tilapia Aquaculture Limited Company,Huanghua,Hebei 061108;5. Yingkou Proliferation Experimental Station,Chinese Academy of Fishery Sciences,Yingkou 115000;6. Research Center of Resources and Environment,Chinese Academy of Fishery Sciences,Beijing 100141)
The remarkable individual size differences of half-smooth tongue(Cynoglossus semilavi.)between female and male fishes exist. However, the lower ratio of female in cultured populations arise from sex reversal of the females leads to lower production efficiency. In sex-determination of some fishes and amphibians, sex reversal is interesting biology question and its molecular genetic mechanisms are rarely explored. In this study, 10 half-sib families are set up by utilizing two types of male parents:genetically males and pseudo males which are genetically females. The results showed that the females were all reversed into physiologically male fishes in two families with pseudo male parent. In the other 8 families with normal male parent, the ratio of sex reversal in individual populations presents continuous distribution, which fits for features of QTLs(Quantitative Trait Loci)typically;the heredity of sex reversal is lower, only 0.058. All of these results showed that,the pseudo males as parents, which demonstrate full paternal-effects, the female progenies were all reversed into pseudo males;interfamily selection for improving the genetic advances of sex ratio or genetic evaluation of sex reversal by using genetic markers are advantageous over intrafamily selection for lower heredity of sex-reversal;the continuous distribution of ratio of sex reversal implies the sex-determination for halfsmooth tongue is depended on the interactions among multiple QTLs.
half-smooth tongue;sex-dertermination;sex-reversal
10.13560/j.cnki.biotech.bull.1985.2015.04.030
2014-07-18
中央公益级基本科研业务费项目(2013A0401,2013A0506)
宋超,硕士,研究方向:鱼类生物学及水产养殖;E-mail:songchaosc168@163.com
刘哲,博士,研究方向:鱼类基础生物学及分子遗传,E-mail: liuz@gsau.edu.cn; 李恒德, 博士, 研究方向:统计遗传学,E-mail:hengde.li@cafs.ac.cn
