异育银鲫GABA A受体γ2亚基全长克隆及生物信息学分析
2015-10-26赵依妮胡鲲孙琪2杨先乐阮记明周爱玲
赵依妮胡鲲孙琪,2杨先乐阮记明周爱玲
(1. 上海海洋大学国家水生动物病原库,上海 201306;2. 上海黛龙生物科技工程有限公司,上海 201414)
异育银鲫GABA A受体γ2亚基全长克隆及生物信息学分析
赵依妮1胡鲲1孙琪1,2杨先乐1阮记明1周爱玲1
(1. 上海海洋大学国家水生动物病原库,上海 201306;2. 上海黛龙生物科技工程有限公司,上海 201414)
近年来GABA A受体亚基特异性在药物筛选、研发过程中的应用得到广泛地关注,其中有关α1、β2和γ2三种功能性亚基的研究最为深入。异育银鲫因其良好的生长、繁殖优势,在国内得到广泛养殖。采用RACE法克隆得到了异育银鲫GABA A受体γ2亚基基因全长cDNA,并进行了生物信息学分析。该基因长2 763 bp,其中CDS区长1437 bp,可编码477个氨基酸的前体蛋白。预测蛋白分子量55.3 kD,理论等电点9.13。异育银鲫体内GABA A受体γ2亚基氨基酸序列N端存在1个长度为35个氨基酸的信号肽,4个长度分别为23、20、23和23个氨基酸的跨膜区,3个N-糖基结合位点和2个O-糖基化位点,1个特异性结构域,其氨基酸序列具有明显的氯离子门控通道家族特征。氨基酸序列与其他物种氨基酸序列的同源性都在89%以上,表明该蛋白属于GABA A受体亚基家族。系统进化树表明异育银鲫与斑马鱼聚为一支,亲缘关系最近。
异育银鲫;GABA A受体γ2亚基;克隆;生物信息学分析
γ-氨基丁酸(GABA)是脑组织内主要的抑制性神经递质,主要通过GABA受体起作用。根据受体对激动剂及拮抗剂的敏感性差异,可将GABA受体分为A、B、C三种类型[1],其中A型受体是一种跨膜门控氯离子通道,可介导阶段性的抑制突触传递,也可强直性抑制外周突触传递,因此在神经性疾病如焦虑和癫痫的病理生理学中起着至关重要的作用[2]。GABA A受体上存在GABA、苯二氮卓类和神经甾体三种结合位点,它是几种临床常用抗焦虑、抗癫痫药物和麻醉剂的主要药物标靶[3]。该受体是一种由4次跨膜亚基聚合形成的五聚体,中间是中空的氯离子通道。迄今,已发现的GABA A受体亚基可分为7种(α1-6,β1-3,γ1-3,ρ1-3,δ,ε,θ)[4]。研究发现,多数GABA A受体是由α、β和γ亚基组成,且构成比多为2∶2∶1[4,5],其中α1、β2和γ2形成的五聚体约占40 %[6]。不同亚单位组合成的GABA A受体的生理学和药理学性质不同,γ2亚基在发育中和成熟脑以及脊髓中广泛表达,84%的GABA A受体包含γ2亚基[7,8],是GABA A受体主要的功能性亚基之一[9]。研究发现γ2亚基在GABA A受体突触聚集、突触后的定位、GABA A受体的胞吞作用、BDZ识别方面起着重要作用[10-13]。 此外,γ2亚基也为氯离子通道正常导电所必需[14]。研究发现γ2亚基存在两个剪接变体γ2L和γ2S,而这两种剪接变体表达的失衡将会导致GABA A受体表达的改变,从而导致疾病的发生;进一步的研究表明γ2亚基的突变与GABA A受体功能障碍和家族性癫痈综合征有关[10-12,15]。目前,有关GABA A受体的研究主要集中在癫痫病治疗药物、抗抑郁等神经药物和农用杀虫剂的创新与研制等方面[16-19],而在水产动物领域的相关研究鲜见报道。异育银鲫(Carassais auratus gibebiol)具有生长快、个体大、抗逆性强等特点,在养殖生产中显示出良好的经济性状,在国内得到广泛养殖。迄今为止,有关GABA A受体γ2亚基基因克隆在哺乳动物神经性疾病、新型药物研发的研究报道中较多,而在鱼类中的研究报道较少。本研究以异育银鲫为研究对象,利用 RACE 法对GABA A受体γ2亚基基因进行克隆和序列分析,以期为后续研究GABA A受体γ2亚基基因在渔药研发及安全性评估奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 试验动物 健康的异育银鲫购买于江苏省南通某国营农场,体重(61±5.5)g。用2% NaCl浸泡10 min,然后放置于高锰酸钾消毒后的水族箱(100×80×80 cm3)内暂养2周,饲喂普通颗粒饲料。试验期间使用自动控温系统控制水温为(20±2)℃,24 h 充气,2 d换一次水。试验时取异育银鲫6条,取脑组织样品,液氮迅速冷却,储存在-70℃条件下备用。
1.1.2 主要试剂和仪器 Trizol试剂(美国Invitrogen公司),反转录酶、Ex Taq DNA聚合酶(日本TaKara 公司),SMARTerTMRACE cDNA Amplification Kit(Clontech),DH5α感受态细胞(TaKaRa),引物、AXYGEN柱式凝胶回收试剂盒、AXYGEN小量质粒提取试剂盒(上海生工生物有限公司)。PCR仪为eppendof Mastercycle Gradient,核酸测定仪为eppendof Biophotomter。
1.2 方法
1.2.1 总RNA的提取与反转录 分离异育银鲫脑组织,按Trizol法提取总RNA。采用紫外分光光度计与1.0 %琼脂糖凝胶电泳检测RNA的浓度及完整性,-80℃保存备用。使用M-MLV反转录cDNA。反转录体系及反应条件按照试剂盒推荐体系进行。
1.2.2 引物设计、基因片段的克隆及测序 应用Primer Premier 5.0软件,根据GeneBank发表的斑马鱼(NM_001256250.1)GABA A受体的γ2亚基序列设计一对特异性引物F1&R1(表1),引物由上海生工生物有限公司合成。PCR反应体系及反应条件按照试剂盒推荐体系进行。1.0 % 的琼脂糖凝胶电泳检验扩增产物,按琼脂糖凝胶 DNA 回收试剂盒操作说明纯化回收特异性扩增产物,并连接至pMD19-T vector 载体,将链接好的质粒转化感受态DH5α,通过蓝白斑筛选和菌落PCR初步鉴定后,阳性菌落于37℃震荡培养过夜。提取质粒后将鉴定为阳性的克隆送上海生工生物科技有限公司进行测序。
1.2.3 5' RACE 和 3' RACE 以获得的基因片段为模板设计用于 3' 和 5' 端 RACE 所需引物(表 1)。利用BD SMARTTM RACE cDNA Amplification Kit 试剂盒反转录得到的cDNA 第一链为模板,按照试剂盒推荐体系进行3' 和 5' RACE 反应。反应产物的检验、纯化、克隆、测序与上述基因片段的克隆所述相同。

表1 本文所用引物
1.2.4 序列拼接与生物信息学分析 利用DNAStar软件中的 SeqMan 程序对测序结果进行载体序列的去除和拼接。序列同源性对比和相似性搜索用NCBI BLAST软件进行;开放阅读框(ORF)的寻找用NCBI上的ORF Finder进行;信号肽查找用Sginal P 4.1 Server程序进行;利用TMHMM对跨膜域进行预测;蛋白特征模体查找采用SMART软件;蛋白质性质分析采用ExPASy server软件;多序列比对采用ClustalW 1.8软件,用MEGA4.0的邻接法对异育银鲫GABA A受体γ2亚基氨基酸序列与GenBank上发表的氨基酸序列构建系统进化树,1 000次重复计算自展分析值,利用NCBI在线软件预测结构特征。
2 结果
2.1 GABA A 受体 γ2亚基基因全长cDNA的获得
以异育银鲫脑组织 cDNA 为模板,利用所设计的特异性引物 F1 和 R1 扩增获得了一条长约850 bp的特异性条带(图1-A),与预期大小相同。以异育银鲫脑组织总RNA为模板,用RACE试剂盒进行反转录、5' RACE 和 3' RACE反应,分别获得了一条长约1 400 bp 和 1 600 bp 的特异性条带(图1-B,1-C)。

图1 GABA A受体 γ2 亚基扩增产物
2.2 GABA A 受体 γ2亚基基因序列测定及分析
序列拼接后得到长度为2 763 bp的异育银鲫GABA A受体γ2亚基的cDNA序列(图2),其中5'非编码区长64 bp,3'非编码区长1 262 bp,蛋白质编码区(CDS)长1 437 bp,CDS区可编码477个氨基酸的前体蛋白。
2.3 GABA A 受体 γ2亚基蛋白生物信息学分析
Protparam 在线软件分析表明γ2亚基基因编码蛋白的分子式为C2515H3891N657O697S26,预测蛋白质分子量约为55.3 kD,理论等电点是9.13。GABA A受体γ2亚基蛋白质在异育银鲫体内半衰期30 h,不稳定系数为37.09,总平均亲水性为-0.062。以ProtScale程序分析GABA A受体γ2亚基CDS区cDNA编码的氨基酸,发现亲水性残基所占比列远大于疏水性残基,因此推测GABA A受体γ2亚基CDS区编码蛋白是亲水性的。
采用Signal P预测GABA A受体γ2亚基CDS区序列特征,结果表明存在1个信号肽,长35氨基酸,信号肽序列为MVIMASSSHRSSKCLNAMMIPAI SLKLCLWALLIA,故推测GABA A受体γ2亚基属于分泌型蛋白。TMHMM分析(图3)表明GABA A受体γ2亚基含有4个明显的跨膜区,长度分别为23、20、23、23个氨基酸,与其进行膜内外Cl-离子传递功能有关,属于跨膜蛋白类。通过NetNGlyc1.0 分析推测GABA A受体γ2亚基糖基结合位点,结果表明GABA A受体γ2亚基在含有3个N-糖基化位点、分别位于第53、第130和第248氨基酸处,且这3处氨基酸都是天门冬酰胺,此外,GABA A受体γ2亚基还含有两个O-糖基化位点,因此推测GABA A受体γ2亚基可能是个糖蛋白。
2.4 GABA A受体γ2亚基基因编码蛋白的系统发育分析
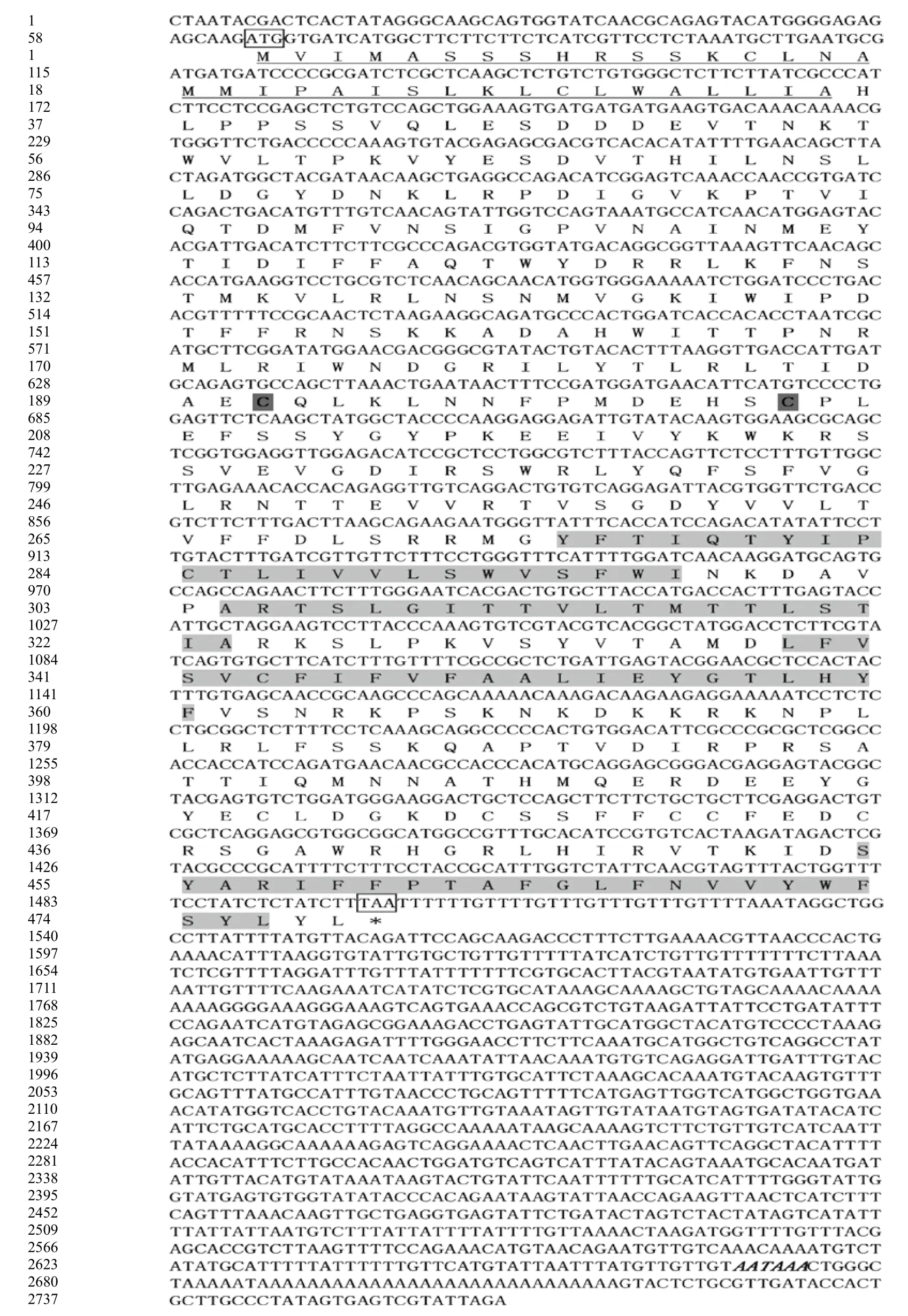
图2 异育银鲫GABA A受体 γ2亚基基因cDNA序列及推导的氨基酸序列
使用Blast程序检索异育银鲫GABA A受体γ2亚基氨基酸序列与其他物种的同源性(图4)。利用CLUSTAL 1.83软件将异育银鲫γ2亚基氨基酸序列与斑马鱼(Danio rerio,NP_001243179.1)、斑马宫丽鱼(Maylandia zabra,XP_004550435.1)、罗非鱼(Oreochromis niloticus,XP_005452616.1)、青鱂(Oryzias latipes,XP_004076169.1)、红鳍东方鲀(Takifugu rubripesTakifugu rubripes,XP_003970978.1), 斑 点雀鳝(Lepisosteus oculatus,XP_006631877.1),美洲狼鲈(Morone Americana,AAL50804.1),维多利亚湖慈鲷(Pundamilia nyererei,XP_005727815.1)进行比对,结果发现相似性在89%-95%之间。根据 GenBank 上已注册该亚基的氨基酸序列,使用MEGA 软件构建系统进化树(图 5)。结果显示,异育银鲫 GABA A 受体γ2 亚基的氨基酸与斑马鱼的聚为一支,表明其亲缘性最近。蛋白质二级结构预测分析发现 GABA A 受体γ2 亚基前体蛋白结构域包含1个配体门控离子通道(LGICs)超家族共有的结构域,该结构域保守核心区域氨基酸序列具有明显的氯离子门控超级家族的特征:主要位于N端细胞外域,约由240个氨基酸组成的亲水性肽链,含有两个保守性N糖基化位点,是主要的胞外配体结合区域。虽然不同物种之间该结构域氨基酸序列有一定差异性,但是其总体拓扑和折叠结构是高度保守的。
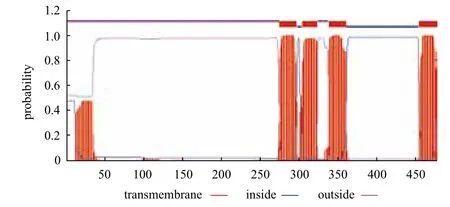
图3 GABA A受体γ2亚基蛋白质跨膜区分析结果
3 讨论
本研究获得了异育银鲫GABA A受体γ2亚基2 763 bp的cDNA全长序列,其中5'非编码区长64 bp,3'非编码区长1 262 bp,蛋白质编码区长1 437 bp,可编码477个氨基酸。到目前为止,在斑马鱼(Danio rerio,NP_001243179.1)、斑马宫丽鱼(Maylandia zabra,XP_004550435.1)、 罗 非 鱼(Oreochromis niloticus,XP_005452616.1)、青鱂(Oryzias latipes,XP_004076169.1)、红鳍东方鲀(Takifugu rubripesTakifugu rubripes,XP_003970978.1),斑点雀鳝(Lepisosteus oculatus,XP_006631877.1),美洲狼鲈(Morone Americana,AAL50804.1),维多利亚湖慈鲷(Pundamilia nyererei,XP_005727815.1)等水产动物中都已发现有GABA A受体γ2 亚基的存在。对GABA A受体γ2 亚基氨基酸序列进行种间相似性分析及MEGA4系统进化树分析,结果表明异育银鲫与斑马鱼遗传距离更近。鲤鱼、鲫鱼和斑马鱼又同属于鲤形目鲤科,而异育银鲫是以天然雌核发育的方正银鲫为母本,以兴国红鲤为父本,经人工授精繁育的子代,因此异育银鲫与斑马鱼亲缘关系比较近。陈笑霞[20]对鱼类GABA A受体的研究也发现异育银鲫同斑马鱼的遗传距离更近。斑马宫丽鱼、罗非鱼、维多利亚湖慈鲷同属鲈形目慈鲷科,因此聚为一支。而美洲狼鲈虽然也属于鲈形目,却并未与上述几种鲈形目鱼类聚为一支,显示出GABA A受体γ2 亚基在进化上的差异性。通常认为,蛋白质的空间结构及其功能较核酸一级序列(基因序列)具有更大的保守性,因此一般来讲,如果蛋白质序列间的相似性大于30%,它们很可能是同源的[21]。通过蛋白质同源性检索发现,γ2 亚基氨基酸序列种间相似性在89%-95%之间,表明γ2 亚基氨基酸序列的折叠结构和拓扑结构具有较高的保守性。在相似的基础上,不同动物之间GABA A受体亚基的氨基酸序列的相似性有所不同,这在一定程度上反映了生物进化的关系;同时,GABA A受体亚基的氨基酸结构具有较高的保守性,但不同物种间仍存在一定差异,反映出不同种属GABA A受体在生理功能上存在的差异性[22]。
异育银鲫γ2 亚基氨基酸序列及其蛋白质二级结构具有明显的GABA A受体亚基家族的特征。首先,所有跨膜区域都是以α-螺旋形式横过细胞膜,彼此之间通过亲水性氨基酸相连,并相互作用形成氯离子通道,而细胞膜内外两侧大量带正电的氨基酸残基则形成离子通道口,起着阴离子滤膜的作用,这与其进行调控膜内外氯离子传递这一功能有关[23]。此外,TM1部位脯氨酸(P 283)的存在,使肽链具备弯曲的能力,也使TM1在氯离子通道的打开及关闭过程中起着关键性作用[24];TM2构成了受体氯离子通道内壁且TM2中的氨基酸残基决定了受体对氯离子的选择性,进一步的研究表明TM2跨膜区域较多的苏氨酸(T 306、311、312、315、317、318和321)和丝氨酸(S 307,320),将有利于氯离子在通道内的流动[25];TM3-TM4之间有一个大的细胞内结构域,其上包含了许多潜在的磷酸化位点,因而它是受体磷酸化调节的主要区域[24]。其次,GABA A受体γ2亚基包含1个氯离子门控超级家族胞外共有结构域,该结构域主要位于N端,是长链的亲水区域,在GABA A受体形成过程中,亲水性氨基末端大量N糖基化部位(N- 53、130和248)形成了各种配体(GABA等激动剂和苯二氮卓类配体)的结合部位[26]。本研究还发现位于N端的胞外结构域其上的3个N糖基化位点在不同物种间都发生于相同的氨基酸残基处,这一结果同王秀坤等[27]所得结论相一致。
4 结论
本研究首次克隆得到了异育银鲫GABA A受体γ2 亚基基因全长序列,并对其进行了详细的位点分析和结构域预测,填补了国内外在该研究领域的空缺。同时,γ2 亚基全长基因克隆为异育银鲫体内GABA A受体其他亚基基因克隆提供参照,推动鱼类受体研究的发展,为进一步探讨GABA A受体在渔药安全性评价和新型渔药开发等方面的研究与应用提供奠定基础。
[1] 谢怡, 沈阅, 徐亚欧, 等. 癫痫患者额叶及颞叶脑组织A型GABA受体α1亚型基因表达定量研究[J]. 中国科学C辑:生命科学, 2009(9):904-907.
[2] Gangisetty O, Reddy D S. The optimization of TaqMan real-time RTPCR assay for transcriptional profiling of GABA-A receptor subunit plasticity[J]. Journal of Neuroscience Methods, 2009, 181(1):58-66.
[3] Hosie AM, Wilkins ME, Smart TG, et al. Neurosteroid binding sites on GABAAreceptors[J]. Pharmacology & Therapeutics, 2007. 116(1):7-19.
[4] Korpi ER, Gründer G, Lüddens H, et al. Drug interactions at GABAAreceptors[J]. Progress in Neurobiology, 2002. 67(2):113-159.
[5] Fritschy J, Brünig I. Formation and plasticity of GABAergic synapses:physiological mechanisms and pathophysiological implications[J]. J Med Chem, 2004. 47(24):5829-5832.
[6] Mark SC, John RA, Robert WC, et al. An orally bioavaialable,functionally selective inverse agonist at the benzodiazepine site of GABAA 5 receptoes with congnition enhancing properties[J]. Progress in Neurobiology, 2002, 67(2):113-159.
[7] Mascia MP, Biggio F, Mancuso L, etal. Changes in GABA(A)receptor gene expression induced by withdrawal of, but not by longterm exposure to, ganaxolone in cultured rat cerebellar granule cells[J]. J Pharmacol Exp Ther, 2002, 303(3):1014-1020.
[8] Benke D, Honer M, Michel C, et al. GABAAreceptor subtypes differentiated by their γ subunit variants:prevalence, pharmacology and subunit architecture[J]. Neuropharmacology, 1996, 35(9-10):1413-1423.
[9] Somogyi P, Fritschy JM, Benke D, et al. The gamma 2 subunit of the GABAAreceptor is concentrated in synaptic junctions containing the alpha 1 and beta 2/3 subunits in hippocampus, cerebellum and globus pallidus[J]. Neuropharmacology, 1996, 35(9-10):1425-1444.
[10] 李艳芳. 新生大鼠反复惊厥对脑内价氨基丁酸A受体γ2亚单位表达的影响[D]. 长沙:中南大学, 2008.

图5 不同物种GABA A受体 γ2亚基的系统进化树
[11] Bowser DN, Wagner DA, Czajkowski C, et al. Altered kinetics and benzodiazepine sensitivity of a GABAAreceptor subunit mutation[γ2(R43Q)]found in human epilepsy[J]. Proc Natl Acad Sci USA, 2002, 99:15170-15175.
[12] Chou IC, Lee CC, Tsai CH, et al. Association of GABRG2 polymorphisms with idiopathic generalized epilepsy[J]. Pediatr Neurol,2007, 36(1):40-44.
[13] Subramaniam JR, Corsi L, Vicini S, et al. Ribozyme-mediated reduction of the GABA(A)receptor alpha1 subunit[J]. Molecular Brain Research, 2001, 92(1-2):149-156.
[14] Mu W, Burt DR. Transcriptional regulation of GABA receptor γ2 subunit gene[J]. Brain Res Mol Brain Res, 1999, 67(1):137-147.
[15] Baulac S, Huberfeld G, Gourfinkel-An I, et al. First genetic evidence of GABA(A)receptor dysfunction in epilepsy:a mutation in the gamma2-subunit gene[J]. Nat Genet, 2001, 28(1):46-48.
[16] Whiting PJ. GABA-A receptor subtypes in the brain:a paradigm for CNS drug discovery?[J]. Drug Discovery Today, 2003, 8(10):445-450.
[17] Whiting PJ. The GABAAreceptor gene family:new opportunities for drug development. Curr Opin Drug Discov Devel[J]. Curr Opin Drug discov Devel, 2003, 6(5):648-657.
[18] Clément Y. Structural and pharmacological aspects of the GABA receptor:Involvement in behavioral pathogenesis[J]. Journal of Physiology, Paris, 1996, 90:1-13.
[19] Korpi ER, Sinkkonen ST. GABA(A)receptor subtypes as targets for neuropsychiatric drug development[J]. Pharmacol Ther,2006, 109(1-2):12-32.
[20] 陈笑霞, 李艳芬, 龙天澄. 南方鲇延髓面叶氨基酸类神经递质含量研究[J]. 广州大学学报:自然科学版, 2010, 9(5):88-91.
[21] 程章, 聂湘平, 王芳, 等. 阿部鲻鰕鯱P450 1A1克隆与分析[J]. 水生生物学报, 2009, 33(4):782-788.
[22] 李冰, 王杰, 张成锋, 等. 建鲤催乳素受体基因全长cDNA的克隆、序列分析与组织表达[J]. 中国水产科学, 2013, 20(4):722-732.
[23] 付立志, 徐进宜, 吴晓明, 等. γ-氨基丁酸受体及相关药物研究进展[J]. 中国医疗前沿, 2007, 2(8):35-37.
[24] Peran M, Hooper H, Rayner SL, et al. GABAAreceptor 1 and 6 subunits mediate cell surface anchoring in cultured cells[J]. Neurosci Lett, 2004, 364(2):67-70.
[25] Sarto I, Wabnegger L, Dogl E, et al. Homologous sites of GABAAreceptor alpha1, beta3 and gamma2 subunits are importantfor assembly[J]. Neuropharmacology, 2002, 43(4):482-491.
[26] Sieghart W. Structure, pharmacology, and function of GABAAreceptor subtypes[J]. Adv Pharmacol, 2006, 54:231-263.
[27] 王秀坤, Nielsen M. GABAA受体药理学研究进展[J]. 国外医学. 药学分册, 2001, 28(1):29-34.
(责任编辑 李楠)
Cloning and Bioinformatics Analysis of GABA A Receptor γ2 Subunit Gene in Carassais auratus gibebiol
Zhao Yini1Hu Kun1Sun Qi1,2Yang Xianle1Ruan Jiming1Zhou Ailing1
(1. State Collection Center of Aquatic Pathogen,Shanghai Ocean University,Shanghai 201306;2. Delon Hi-Tech Ltd.,Shanghai 201414)
The application of the specificity of GABA receptor subunits in drug screening and drug development got widely attention recently, of which three function subunits α1, β2 and γ2 studied deeply. Furthermore, Carassais auratus gibebiol as its good growth and reproduction had been widely farmed in china. In the present study, we cloned and characterized GABA A receptor γ2 subunit full-length gene. The full-length Carassais auratus gibebiol GABA A receptor γ2 subunit cDNA was 2 763 bp in length, contained a 1437 bp open reading frame(ORF), and encoded 477 amino acids which constituting a 55.3 kD protein molecule with an isoelectric point of 9.13. The γ2 subunit protein was hydrophilic. The protein sequence had one signal peptide, consisting of 35 amino acid residue. The sequence of amino acids contained four transmembrane regions, which length of 23,20,23 and 23 aa, involving in electronic transfer catalysis between the internal and external membrane. We found three N-glycosylation sites, two O- glycosylation sites and an extracellular domain which had obvious ligand-gated ion channels' characteristics. Sequence comparison revealed that the similarity of the γ2 subunit protein all above 89% with other aquatic animals showed that it belongs to GABA A receptor subunits' family. We conducted a phylogenetic analysis using the neighbor joining(NJ)method. The evolutionary tree showed that the γ2 subunit protein was clustered with the zebra fish which indicated that they are the two most closely related species.
Carassais auratus gibebiol;GABA-A receptor γ2 subunit;cloning;bioinformatics analysis
10.13560/j.cnki.biotech.bull.1985.2015.04.028
2014-08-29
国家科学自然基金项目(31172430),“863”计划项目(2011AA10A216),公益性农业行业专项项目(201203085)
赵依妮,女,硕士研究生,研究方向:鱼类药物受体,药物代谢动力学;E-mail:zhaoyini21@126.com
杨先乐,男,教授,研究方向:水产养殖疾病的防治;E-mail:xlyang@shou.edu.cn
